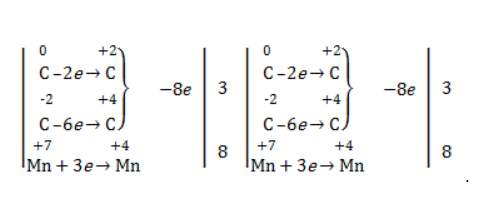В окислительно-восстановительных реакциях органические вещества чаще проявляют свойства восстановителей, а сами окисляются. Легкость окисления органических соединений зависит от доступности электронов при взаимодействии с окислителем. Все известные факторы, вызывающие увеличение электронной плотности в молекулах органических соединений (например, положительные индуктивный и мезомерные эффекты), будут повышать их способность к окислению и наоборот.
Склонность органических соединений к окислению возрастает с ростом их нуклеофильности , что соответствует следующим рядам:
Рост нуклеофильности в ряду
Рассмотрим окислительно-восстановительные реакции представителей важнейших классов органических веществ с некоторыми неорганическими окислителями.
- Окисление алкенов
- Окисление алкинов
- Окисление гомологов бензола
- Окисление спиртов
- Окисление альдегидов и кетонов
- Acetyl
- Окисление алкенов перманганатом калия
- Понятие о неполном окислении
- Определение степеней окисления
- Влияние среды на окислитель
- Мягкое окисление
- Жесткое окисление
- Окисление перманганатом калия в кислой среде
- Окисление алкенов в щелочной среде
- Окисление в нейтральном растворе
- Заключение
- 📺 Видео
Видео:Самые сложные ОВР с перманганатом калия | Химия ЕГЭ 2023 | УмскулСкачать

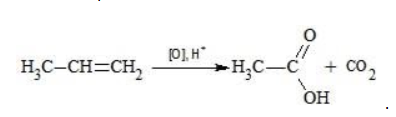
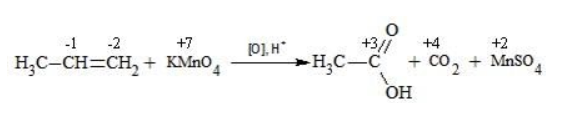
Окисление алкенов
При мягком окислении алкены превращаются в гликоли (двухатомные спирты). Атомы-восстановители в этих реакциях – атомы углерода, связанные двойной связью.
Реакция с раствором перманганата калия протекает в нейтральной или слабо щелочной среде следующим образом:
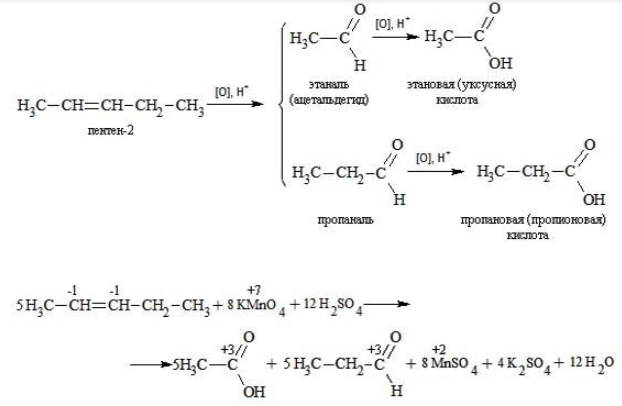
В более жестких условиях окисление приводит к разрыву углеродной цепи по двойной связи и образованию двух кислот (в сильно щелочной среде – двух солей) или кислоты и диоксида углерода (в сильно щелочной среде – соли и карбоната):
Дихромат калия в сернокислотной среде окисляет алкены аналогично реакциям 1 и 2.
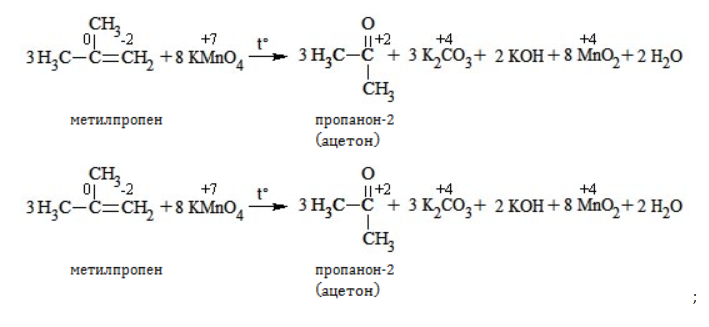
При окислении алкенов, в которых атомы углерода при двойной связи содержат по два углеродных радикала, происходит образование двух кетонов:

Видео:Реакция этилена с раствором перманганата калияСкачать

Окисление алкинов
Алкины окисляются в несколько более жестких условиях, чем алкены, поэтому они обычно окисляются с разрывом углеродной цепи по тройной связи. Как и в случае алкенов, атомы-восстановители здесь – атомы углерода, связанные кратной связью. В результате реакций образуются кислоты и диоксид углерода. Окисление может быть проведено перманганатом или дихроматом калия в кислотной среде, например:
Ацетилен может быть окислен перманганатом калия в нейтральной среде до оксалата калия:
3CH≡CH +8KMnO 4 → 3KOOC –COOK +8MnO 2 +2КОН +2Н 2 О
В кислотной среде окисление идет до щавелевой кислоты или углекислого газа:
Видео:Окисление органических соединений перманганатом калияСкачать

Окисление гомологов бензола
Бензол не окисляется даже в довольно жестких условиях. Гомологи бензола могут быть окислены раствором перманганата калия в нейтральной среде до бензоата калия:
Окисление гомологов бензола дихроматом или перманганатом калия в кислотной среде приводит к образованию бензойной кислоты.
Видео:ОВР с перманганатом калия.Скачать

Видео:Окисление органических веществ | Химия ЕГЭ для 10 класса | УмскулСкачать

Окисление спиртов
Непосредственным продуктом окисления первичных спиртов являются альдегиды, а вторичных – кетоны.
Образующиеся при окислении спиртов альдегиды легко окисляются до кислот, поэтому альдегиды из первичных спиртов получают окислением дихроматом калия в кислотной среде при температуре кипения альдегида. Испаряясь, альдегиды не успевают окислиться.
С избытком окислителя (KMnO 4 , K 2 Cr 2 O 7 ) в любой среде первичные спирты окисляются до карбоновых кислот или их солей, а вторичные – до кетонов.
Третичные спирты в этих условиях не окисляются, а метиловый спирт окисляется до углекислого газа.
Двухатомный спирт, этиленгликоль HOCH 2 –CH 2 OH, при нагревании в кислой среде с раствором KMnO 4 или K 2 Cr 2 O 7 легко окисляется до щавелевой кислоты, а в нейтральной – до оксалата калия.
3СН 2 (ОН) – СН 2 (ОН) + 8КMnO 4 → 3KOOC –COOK +8MnO 2 +2КОН +8Н 2 О
Видео:Окисление этанола раствором перманганата калияСкачать

Окисление альдегидов и кетонов
Альдегиды – довольно сильные восстановители, и поэтому легко окисляются различными окислителями, например: KMnO 4 , K 2 Cr 2 O 7 , [Ag(NH 3 ) 2 ]OH, Cu(OH) 2 . Все реакции идут при нагревании:
CH 3 CHO + Br 2 + 3NaOH → CH 3 COONa + 2NaBr + 2H 2 O
реакция «серебряного зеркала»
C аммиачным раствором оксида серебра альдегиды окисляются до карбоновых кислот которые в аммиачном растворе дают соли аммония (реакция «серебрянного зеркала»):
Муравьиный альдегид (формальдегид) окисляется, как правило, до углекислого газа:
Кетоны окисляются в жестких условия сильными окислителями с разрывом связей С-С и дают смеси кислот:
Карбоновые кислоты. Среди кислот сильными восстановительными свойствами обладают муравьиная и щавелевая, которые окисляются до углекислого газа.
НСООН + HgCl 2 =CO 2 + Hg + 2HCl
Муравьиная кислота , кроме кислотных свойств, проявляет также некоторые свойства альдегидов, в частности, восстановительные. При этом она окисляется до углекислого газа. Например:
2KMnO4 + 5HCOOH + 3H2SO4 → K2SO4 + 2MnSO4 + 5CO2↑ + 8H2O
При нагревании с сильными водоотнимающими средствами (H2SO4 (конц.) или P4O10) разлагается:
Видео:ОВР в органических реакциях на примере окисления алкенов растворами перманганата калияСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:Окисление алкенов с Тасей | Химия ЕГЭСкачать  Окисление алкенов перманганатом калияВ отличие от предельных углеводородов, алкены характеризуются высокой химической активностью, обусловленной особенностями строения молекулы. При обычных условиях алкены охотно вступают в реакции неполного окисления с превращением в органические соединения других классов. Универсальный реагент в процессах окисления алкенов – перманганат калия. Видео:Уравнивание органических ОВР за 12 минут | ХИМИЯ ЕГЭ | СОТКАСкачать  Понятие о неполном окисленииВ химии органических соединений под окислением понимается взаимодействие, при котором происходит обеднение реагента водородом или обогащение кислородом, сопровождающееся отдачей электронов молекулой. Обратный процесс называется восстановлением. Полное окисление происходит при горении углеводородов с разрушением молекулы. Продуктами в этом случае являются углекислый газ и вода. При неполном окислении продуктами становятся различные вещества. Высокая реакционная способность алкенов обусловливается присутствием в молекуле двойной связи. Один из ее компонентов – слабая Определение степеней окисленияДля того чтобы правильно записать уравнение реакции неполного окисления алкена, нужно определить степени окисления атомов до вступления во взаимодействие и после него. Они рассчитываются исходя из электроотрицательности элементов. Например, при окислении пропена перманганатом калия
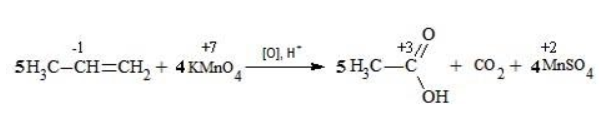
В общем виде результат можно записать следующим образом: Расчет степеней окисления в кислородсодержащих соединениях производится аналогично с учетом большей электроотрицательности кислорода. Видео:Окислительно-восстановительные реакции на примере алкенов (ОВР). ЕГЭ по химииСкачать  Влияние среды на окислительСостав раствора (наряду с температурой) определяет, до какого соединения окислится восстановитель – алкен. Окислитель в растворах с различным уровнем кислотности (щелочности) также ведет себя неодинаково. Неорганическая соль В нейтральной и слабощелочной среде марганец приобретает степень окисления +4 +4: Кислород из перманганат-аниона присоединяется к алкену по месту двойной связи. Под воздействием серной кислоты марганец восстанавливается до степени окисления +2 +2: При окислении со щелочью (гидроксид лития достаточно высокой концентрации) марганец восстановится до +6 +6: Видео:Окисление Толуола Перманганатом Калия В Сернокислой СредеСкачать  Мягкое окислениеПроцесс в нейтральной или слабощелочной среде при обычной температуре представляет собой так называемое мягкое окисление перманганатом калия, или гидроксилирование. В алкене разрывается
Продукт реакции – диол (двухатомный спирт). Например, окисление этилена перманганатом калия приводит к образованию этиленгликоля: Для составления полного уравнения нужно:
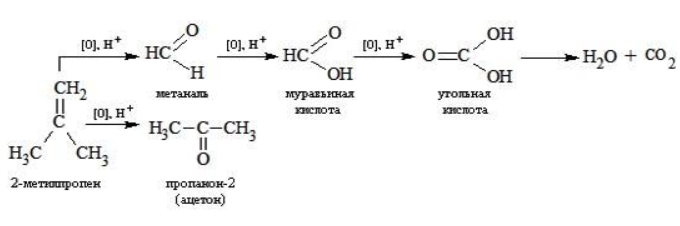
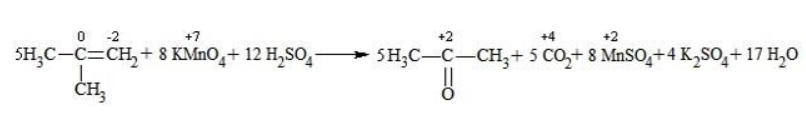
Реакция окисления пропена в нейтральной среде перманганатом калия составляется аналогично: Дальше мягкое окисление не идет, так как Видео:Химические свойства алканов. 1 часть. 10 класс.Скачать  Жесткое окислениеЖесткими называют процессы окисления, протекающие в нейтральном растворе в условиях повышенной температуры, а также при добавлении кислоты или щелочи. В этих случаях двойная связь в алкене разрушается полностью, а продуктами реакции становятся кетоны, кислоты (с промежуточным окислением до альдегида) либо соли. Окисление перманганатом калия в кислой средеПропен в содержащем кислоту растворе Степени окисления участвующих в реакции углеродных атомов и марганца составят: Электронный баланс определяется только с учетом углерода, вошедшего в состав кислоты: Сначала расставляются коэффициенты в окислителе, восстановителе и в продуктах окисления: Затем вписываются недостающие вещества и полностью рассчитываются коэффициенты: Еще один пример жесткого окисления алкенов перманганатом калия с серной кислотой – реакция с участием пентена-2. Молекула расщепляется по месту двойной связи, и ее фрагменты окисляются через промежуточное образование альдегидов до двух кислот: Электронный баланс составляется для двух углеродных атомов алкена, поскольку оба они являются восстановителями. Правило, по которому осуществляется окисление углерода, отражено в таблице: Так, в 2-метилпропене первичный атом окисляется через промежуточные формальдегид (метаналь) и муравьиную кислоту полностью – до углекислого газа, а третичный – только до ацетона: Окисление алкенов в щелочной средеПри нагревании с концентрированной щелочью алкены окисляются до солей: Если один из углеродных атомов – первичный, он окисляется до углекислого газа: Окисление в нейтральном раствореВ условиях высокой температуры образующаяся щелочь вступает в реакцию, в результате которой окисление алкенов продолжается до образования кетонов или солей. Так, при жестком окислении пропена в нейтральной среде получаются те же продукты, что и в присутствии концентрированного гидроксида калия: ацетат Кетон – результат окисления третичного углеродного атома, и дальнейшую реакцию они не поддерживают. Например, при окислении метилпропена как конечный продукт образуется ацетон: Видео:Химия | Схемы ОВР для перманганат и дихромат ионовСкачать  ЗаключениеВзаимодействие с раствором перманганата калия в мягких или жестких условиях является показателем высокой реакционной способности алкенов, которая обусловлена присутствием в молекуле легко разрываемой -связи. Реакции мягкого и жесткого окисления относятся к числу характерных химических свойств алкенов как ненасыщенных углеводородов. 📺 Видео3.3. Алкины: Химические свойстваСкачать  Самый легкий способ уравнять ОВР в органике!Скачать  Окислительно-восстановительные реакции с нуля!| Екатерина Строганова | 100балльный репетиторСкачать  Взаимодействие ацетилена с раствором перманганата калияСкачать  Жесткое окисление алкенов. Взаимодействие алкенов с перманганатом калия в щелочной средеСкачать  Получение АЦЕТОНАСкачать  7.4. Спирты: Химические свойства. ЕГЭ по химииСкачать  |











 -связь – легко разрушается с образованием у углеродных атомов свободной валентности (неспаренного электрона). За счет оттягивания или отрыва освободившихся электронов и происходит окислительно-восстановительный процесс.
-связь – легко разрушается с образованием у углеродных атомов свободной валентности (неспаренного электрона). За счет оттягивания или отрыва освободившихся электронов и происходит окислительно-восстановительный процесс.

 вступающий в реакцию пропен
вступающий в реакцию пропен 
 углерод, обладающий большей электроотрицательностью, смещает к себе электронные пары двух связей
углерод, обладающий большей электроотрицательностью, смещает к себе электронные пары двух связей 



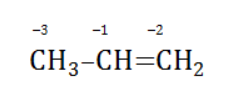

 в водном растворе диссоциирует на катион металла
в водном растворе диссоциирует на катион металла  и собственно окислитель – перманганат-анион
и собственно окислитель – перманганат-анион  . В ходе реакции марганец восстанавливается от степени окисления +7 +7 до той или иной величины в зависимости от среды.
. В ходе реакции марганец восстанавливается от степени окисления +7 +7 до той или иной величины в зависимости от среды.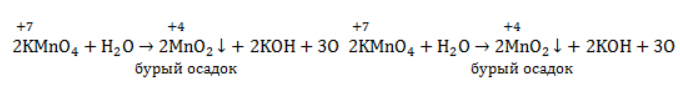
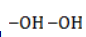 . Источниками их формирования служат:
. Источниками их формирования служат: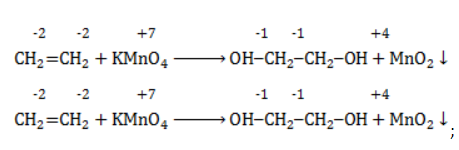

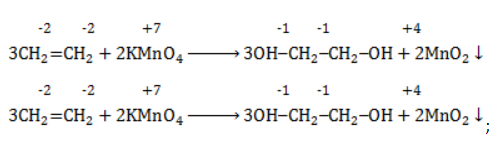
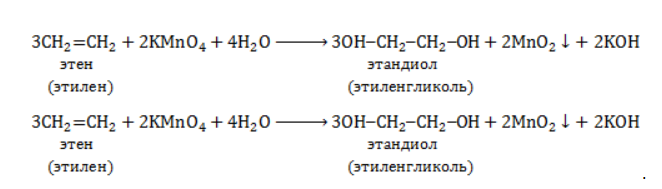
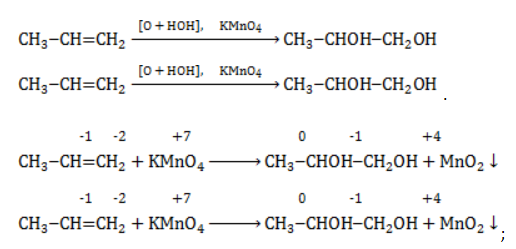
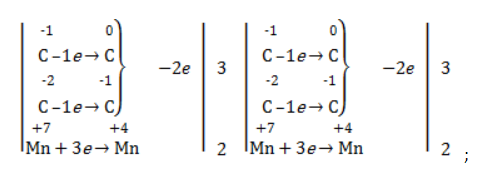
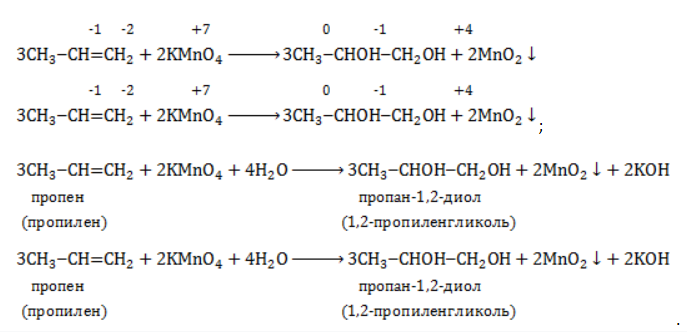
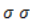 -связи в молекуле в мягких условиях сохраняются. Раствор перманганата теряет окраску, а оксид марганца выпадает в виде бурого осадка. Гидроксилирование, известное также как реакция Вагнера, служит для выявления в молекулах двойной связи.
-связи в молекуле в мягких условиях сохраняются. Раствор перманганата теряет окраску, а оксид марганца выпадает в виде бурого осадка. Гидроксилирование, известное также как реакция Вагнера, служит для выявления в молекулах двойной связи.
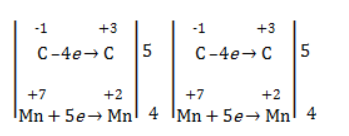


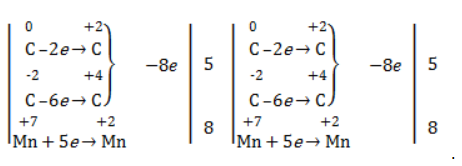

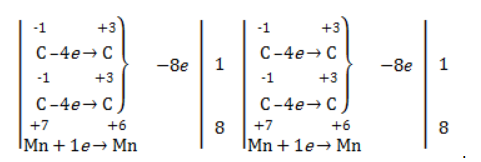




 .
.