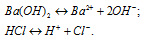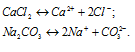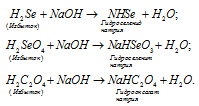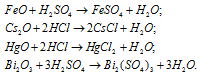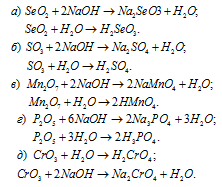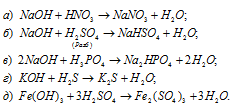Химия | 10 — 11 классы
Составте уравнения реакций между кислотами и основаниями, приводящих к образованию солей : NaNO3, Ca(HCO3)2, MgOHCl.
- Составте по два уравнения химических реакций оснований формула ( KOH) 1)с кислотами 2) кислотными оксидами 3) с солями?
- Составить уравнения реакций между соответствующими кислотами и основаниями, приводящих к образованию следующих солей : Fe(NO3)3, FeOHSO4, Ca(HS)2 если можно, с фото — объяснением?
- Привести пример (2 — 3) уравнение реакций свойства оснований, кислот, солей?
- Напишите уравнение реакции между оксидом и основанием, приводящей к образованию соли и воды?
- Приведите примеры реакций взаимодействия соляной кислоты с металлами, основными оксидами, основаниями, солями и напишите уравнения их реакций?
- Напишите уравнение реакций кислот с основаниями с образованием солей и воды :H3PO4 + NaOH⇒HCl + Fe(OH)3⇒H2SiO3 + NaOH⇒HNO3 + Cu(OH)2⇒?
- Помогите с химией пожалуйста?
- Помогите составить уравнения химических реакция где исходные вещества металл и кислота ; металл и соль ; основной оксид и кислотный оксид (2 уравнения) ; основной оксид и кислота (2 уравнения) ; основ?
- Составте формулы всех солей, соответствующих кислотам и основаниям ;Ca (OH) 2, Сo (OH)3 , HNO2, H2S2O3Напишите уравнения реакций получения нормальных(средних) солей в молекулярной и ионной форме?
- Какую реакцию на лакмус покажут растворы солей, образованых : слабым основанием и сильной кислотой ; сильным основанием и слабой кислотой?
- Решение задач по теме «Классы неорганических соединений»
- Нитрат натрия: способы получения и химические свойства
- Способ получения
- Качественная реакция
- Химические свойства
- 📹 Видео
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Составте по два уравнения химических реакций оснований формула ( KOH) 1)с кислотами 2) кислотными оксидами 3) с солями?
Составте по два уравнения химических реакций оснований формула ( KOH) 1)с кислотами 2) кислотными оксидами 3) с солями.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Составить уравнения реакций между соответствующими кислотами и основаниями, приводящих к образованию следующих солей : Fe(NO3)3, FeOHSO4, Ca(HS)2 если можно, с фото — объяснением?
Составить уравнения реакций между соответствующими кислотами и основаниями, приводящих к образованию следующих солей : Fe(NO3)3, FeOHSO4, Ca(HS)2 если можно, с фото — объяснением.
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Привести пример (2 — 3) уравнение реакций свойства оснований, кислот, солей?
Привести пример (2 — 3) уравнение реакций свойства оснований, кислот, солей.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Напишите уравнение реакции между оксидом и основанием, приводящей к образованию соли и воды?
Напишите уравнение реакции между оксидом и основанием, приводящей к образованию соли и воды.
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Приведите примеры реакций взаимодействия соляной кислоты с металлами, основными оксидами, основаниями, солями и напишите уравнения их реакций?
Приведите примеры реакций взаимодействия соляной кислоты с металлами, основными оксидами, основаниями, солями и напишите уравнения их реакций.
Видео:СОЛИ ХИМИЯ 8 КЛАСС // Урок Химии 8 класс: Классификация солей, Формулы Солей, Кислотный ОстатокСкачать

Напишите уравнение реакций кислот с основаниями с образованием солей и воды :H3PO4 + NaOH⇒HCl + Fe(OH)3⇒H2SiO3 + NaOH⇒HNO3 + Cu(OH)2⇒?
Напишите уравнение реакций кислот с основаниями с образованием солей и воды :
Видео:ХИМИЯ | Основные классы соединений. Уравнения реакций ч.1Скачать

Помогите с химией пожалуйста?
Помогите с химией пожалуйста!
1. Напишите уравнение реакций образования основной соли и назовите её :
Гидроксид кобальта (2) + соляная кислота — >
Напишите уравнение реакций образования кислой соли и назовите её :
Гидроксид калия + сероводородная кислота — >
Гидроксид калия + фосфорная кислота — >.
Видео:8 класс. Составление уравнений химических реакций.Скачать

Помогите составить уравнения химических реакция где исходные вещества металл и кислота ; металл и соль ; основной оксид и кислотный оксид (2 уравнения) ; основной оксид и кислота (2 уравнения) ; основ?
Помогите составить уравнения химических реакция где исходные вещества металл и кислота ; металл и соль ; основной оксид и кислотный оксид (2 уравнения) ; основной оксид и кислота (2 уравнения) ; основание и кислотный оксид (2 уравнения) ; основание и кислота (2 уравнения) ; основание и соль (2 уравнения) ; соль и кислота (2 уравнения) ; соль и соль.
Видео:Составление уравнений химических реакций. 2 часть. 8 класс.Скачать

Составте формулы всех солей, соответствующих кислотам и основаниям ;Ca (OH) 2, Сo (OH)3 , HNO2, H2S2O3Напишите уравнения реакций получения нормальных(средних) солей в молекулярной и ионной форме?
Составте формулы всех солей, соответствующих кислотам и основаниям ;
Ca (OH) 2, Сo (OH)3 , HNO2, H2S2O3
Напишите уравнения реакций получения нормальных(средних) солей в молекулярной и ионной форме.
Для амфотерных гидроксидов необходимо составлять формулы их солей, образованных при реакциях с кислотами и с основаниями.
Видео:Диссоциация электролитов в водных растворах. Видеоурок 39. Химия 9 классСкачать

Какую реакцию на лакмус покажут растворы солей, образованых : слабым основанием и сильной кислотой ; сильным основанием и слабой кислотой?
Какую реакцию на лакмус покажут растворы солей, образованых : слабым основанием и сильной кислотой ; сильным основанием и слабой кислотой?
На странице вопроса Составте уравнения реакций между кислотами и основаниями, приводящих к образованию солей : NaNO3, Ca(HCO3)2, MgOHCl? из категории Химия вы найдете ответ для уровня учащихся 10 — 11 классов. Если полученный ответ не устраивает и нужно расшить круг поиска, используйте удобную поисковую систему сайта. Можно также ознакомиться с похожими вопросами и ответами других пользователей в этой же категории или создать новый вопрос. Возможно, вам будет полезной информация, оставленная пользователями в комментариях, где можно обсудить тему с помощью обратной связи.
Видео:Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

Решение задач по теме «Классы неорганических соединений»
Задача 149.
Можно ли получить раствор, содержащий одновременно: а) Ва(ОН)2 и HCl; б) СаСI2 и Na2СО3; в) NaCl и AgNO3 ; г) КСI и NaNO3. Указать, какие комбинации невозможны и почему.
Решение:
а) Ba(OH)2 и HCl – сильные электролиты, поэтому в водных растворах диссоциируют полностью:
Находящиеся в растворе ионы Ba 2+ и Cl – не связываются с ионами H + и OH – с образованием осадка, газа или слабого электролита. Поэтому раствор Ba(OH)2 и HCl будет существовать.
б) Растворимые соли CaCl2 и Na2CO3 как сильные электролиты в водных растворах диссоциируют полностью по схемам:
Ионы Ca 2+ и CO3 – связываются друг с другом, образуя осадок — не растворимая соль. В растворе останутся ионы Cl – и OH – , которые не связываются друг с другом, молекулами CaCO3 и ионами воды H + и OH — . Поэтому невозможно получить раствор, содержащий одновременно CaCl2 и Na2CO3, так как выпадает осадок СаСО3.
в) NaCl и AgNO3, как сильные электролиты в водных растворах диссоциируют полностью по схемам:
Ионы Ag + и Cl — связываются друг с другом, образуя осадок AgCl. В растворе остаются ионы Na + и NO3 — , которые не связываются друг с другом с молекулами AgCl, ионами воды H+ и OH- и не образуют осадок, газ или слабый электролит. Поэтому невозможно получить раствор, содержащий одновременно NaCl и AgNO3, так как выпадает осадок AgCl.
г) КСI и NaNO3 – растворимые соли, которые в водных растворах полностью распадаются на ионы:
KCl ⇔ K + + Cl — ;
NaNO3 ⇔ Na + + NO 3 — .
Образовавшиеся ионы K + , Na + , Cl — и NO 3 — не связываются друг с другом и ионами воды H + и OH — и не образуют осадок, газ или слабодиссоциируемое вещество. Таким образом, можно получить раствор одновременно содержащий КСI и NaNO3.
Задача 150.
Какие из перечисленных кислот образуют кислые соли: HJ, H2Se, H2SeO3, H2C2O4, CH3COOH.
Решение:
Кислые соли образуют многоосновные кислоты, в которых атомы водорода не все замещены на катионы кислоты. Так как кислоты HJ и CH3COOH содержат по одному катиону водорода в составе молекул, то они не могут образовать кислых солей. Кислоты H2Se, H2SeO3, H2C2O4 являются двухосновными кислотами, то они могут образовать кислые соли при замещении одного атома водорода на катион металла. При взаимодействии этих кислот с основаниями, в случае, если кислота взята в избытке, образуется кислая соль, например:
Названия кислых солей образуются, так же как и средних, но при этом добавляют приставку «гидро» и указывают наличие незамещённых атомов водорода, число которых обозначают греческими числительными («ди», «три» и т.д.). Например: NaH2HO4 — дигидроортофосфат натрия; KH2AsO4 – дигидроортоарсенат калия; Mg(HCO3)2 – гидрокарбонат магния.
Задача 151.
Какие кислоты могут быть получены непосредственным взаимодействием с водой оксидов: Р2О5, СО2, N2O5, NO2, SO2?
Решение:
а) При взаимодействии P2O5 с водой могут образоваться различные кислоты, например метафосфорная HPO3 и ортофосфорная H3PO4:
б) При пропускании углекислого газа через воду образуется раствор слабой угольной кислоты H2CO3:
в) При растворении N2O5 в воде образуется азотная кислота HNO3 – сильный электролит.
г) при взаимодействии NO2 с водой может быть получена смесь двух кислот азотистой HNO2 и азотной HNO3:
В присутствии избытка кислорода в воде образуется только азотная кислота:
д) SO2 хорошо растворим в воде (36 об. ч. SO2 на 1 об. ч. Н2О при 20 0 С), при этом образуется сернистая кислота H2SO3 – кислота средней силы:
Задача 152.
С какими из перечисленных ниже веществ будет реагировать соляная кислота: N2O5, Zn(ОН)2, СаО, AgNO3, Н3РO3, Н2SO4? Составить уравнения реакций.
Решение:
а) Оксид азота (V) N2O5 является кислотным оксидом, поэтому не реагирует с соляной кислотой HCl.
б) гидроксид цинка Zn(ОН)2 является амфотерным основанием, поэтому реагирует как с основаниями, так и с кислотами. Реакция между Zn(ОН)2 и HCl протекает:
в) Оксид кальция СаО является основным оксидом, поэтому реагирует с соляной кислотой:
г) Нитрат серебра AgNO3 – сильный электролит, который в водных растворах диссоциирует на ионы Ag + и NO3 — , а соляная кислота как электролит распадается на ионы H + и Cl — . Ионы Ag + и Cl — , соединяясь, образуют нерастворимую соль AgCl, которая выпадает в осадок. Реакция между нитратом серебра и соляной кислотой протекает по схеме:
д) Ортофосфорная кислота Н3РO4, серная кислота H2SO4 и соляная кислота HCl – электролиты, которые в водных растворах распадаются на ионы:
Ионы PO4 3- , SO4 2- , H + и Cl — не связываются друг с другом, не образуют осадок, газ или малодиссоциируемое вещество. Поэтому Н3РO3 и Н2SO4 не реагируют с HCl.
Задача 153.
Какие из указанных веществ реагируют с гидроксидом натрия: HNO3, CaO, CO2, CuSO4, Cd(OH)2, P2O5. Составить уравнения реакций.
Решение:
а) Азотная кислота как кислота вступает в реакцию нейтрализации с основанием NaOH, при этом образуется соль и вода:
б) Оксид кальция СаО – основной оксид, поэтому не будет реагировать с NaOH – сильным основанием.
в) Оксид углерода (II) СО2 – кислотный оксид, поэтому будет реагировать с гидроксидом NaOH с образованием соли и воды:
г) CuSO4 и NaOH – сильные электролиты, поэтому в водных растворах распадаются на ионы:
CuSO4 ⇔ Cu 2+ + SO4 2- ;
NaOH ⇔ Na + + OH —
Ионы Cu 2+ и OH — связываются друг с другом, образуя осадок из нерастворимого Cu(OH)2. Значит, между CuSO4 и NaOH реакция протекает по уравнению:
д) Гидроксид кадмия Сd(OH)2 имеет слабо выраженные кислотные свойства, поэтому в растворе гидроксида натрия высокой концентрации при длительном кипячении образует неустойчивые гексагидроксокадмиат(I) – ионы [Cd(OH)6] 4- :
Сd(OH)2 + 4NaOH → Na4[Cd(OH)6]
Оксид фосфора(V) Р2О5 – кислотный оксид, поэтому будет реагировать с раствором гидроксида натрия с образованием соли и воды:
Задача 154.
Написать уравнения реакций, свидетельствующих об основных свойствах FeO, Cs2O, HgO, Bi2O3.
Решение:
Оксиды FeO, Cs2O, HgO, Bi2O3 имеют основной характер, поэтому все они растворяются в кислотах с образованием соли и воды:
Задача 155.
Написать уравнения реакций, доказывающих кислотный характер SеО2, SО3, Мn2O7, Р2O5, СrО3.
Решение:
Кислотные оксиды SеО2, SО3, Мn2O7, Р2O5 и СrО3 при взаимодействии с водой образуют соответствующие кислоты. Все они проявляют кислотные свойства, взаимодействуют как с основаниями, так и с основными оксидами:
Задача 156.
Составить уравнения реакций получения хлорида магния: а) действием кислоты на металл; б) действием кислоты на основание; в) действием кислоты на соль.
Решение:
Уравнения реакций получения хлорида магния:
а) Действием кислоты на металл:
б) Действием кислоты на основание:
в) Действием кислоты на соль:
Задача 157.
Составить уравнения реакций между кислотами и основаниями, приводящих к образованию солей: NaNO3, NaHSO4, Na2HPO4, K2S, Fe2(SO4)3.
Решение:
Уравнения реакций образования солей:
Задача 158.
Какие вещества могут быть получены при взаимодействии кислоты с солью? Кислоты с основанием? Соли с солью? Привести примеры реакций.
Решение:
а) При взаимодействии кислоты с солью могут быть получены кислота и соль, а также и другие вещества, например оксиды и вода:
б) При взаимодействии кислоты с основанием (реакция нейтрализации) образуются соль и вода:
в) Реакция между солями идёт, если при этом образуется малорастворимое соединение (реакция обмена). При взаимодействии соли с солью образуются новые соли, одна из них нерастворима:
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Нитрат натрия: способы получения и химические свойства
Нитрат натрия NaNO3 — соль щелочного металла натрия и азотной кислоты. Белое вещество, весьма гигроскопичное, которое плавится без разложения, при дальнейшем нагревании разлагается.
Относительная молекулярная масса Mr = 84,99; относительная плотность для тв. и ж. состояния d = 2,266; tпл = 306,5º C;
Видео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Способ получения
1. Нитрат натрия можно получить путем взаимодействия гидроксида натрия и разбавленной азотной кислоты, образуется нитрат натрия и вода:
2. В результате взаимодействия горячего гидроксида натрия, оксида азота (IV) и кислорода образуется нитрат натрия и вода:
3. В результате реакции между горячим гидроксидом натрия, оксидом натрия (IV) и кислородом, происходит образование нитрата натрия и воды:
4. При комнатной температуре, в результате взаимодействия оксида азота (IV) и натрия образуется нитрат натрия и газ оксид азота (II):
2NO2 + Na = NO↑ + NaNO3
5. При смешивании горячего пероксида водорода и нитрита азота происходит образование нитрата натрия и воды:
Видео:Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Качественная реакция
Качественная реакция на нитрат натрия — взаимодействие с медью при нагревании в присутствии концентрированной кислоты:
1. При взаимодействии с серной кислотой и медью, нитрат натрия образует сульфат натрия, нитрат меди, газ оксид азота и воду:
Видео:Составление уравнений реакций. 1 часть. 10 класс.Скачать

Химические свойства
1. Hитрат натрия разлагается при температуре 380–500º С с образованием нитрита натрия и кислорода:
2. Н итрат натрия может реагировать с простыми веществами :
2.1. Н итрат натрия реагирует со свинцом при температуре выше 350 ºС . При этом образуется нитрит натрия и оксид свинца:
NaNO3 + Pb = NaNO2 + PbO
2.2. Нитрат натрия реагирует при комнатной температуре с цинком и разбавленной хлороводородной кислотой с образованием нитрита натрия и воды:
📹 Видео
Составление уравнений реакций горения. 11 класс.Скачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Уравнивание реакций горения углеводородовСкачать

Составление уравнений реакций. 1 часть. 8 класс.Скачать