Вопрос по химии:
Напишите пожалуйста гидролиз соли LiNO3
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
- Как написать хороший ответ?
- Составить молекулярные и ионные уравнения гидролиза солей : 1)LiNO3?
- Напишите молекулярные и ионные уравнения гидролиза соли?
- ПОМОГИТЕ?
- Составить ионно — молекулярные уравнения гидролиза солей FeCl3, Na3PO4?
- Составить ионно — молекулярное и молекулярное уравнения гидролиза соли CrCl3?
- Напишите уравнение реакций гидролиза сульфидов натрия, аммония и алюминия в молекулярной и ионной формах?
- Составить молекулярные и ионные уравнение гидролиза солей : NaCH3COO ; Cr(SO4)3, MnS, NaNO3 указать PH среды?
- В какой цвет окрасился лакмус в растворе соли нитрата меди 2?
- Составьте молекулярные и ионно — молекулярные уравнения гидролиза гидрокарбоната рубидия (RbHSO₃) и на основании этих уравнений определите реакцию среды (кислая, нейтральная, щелочная) и рН?
- В какой цвет окрасится лакмус в растворе нитрата железа(2)?
- Написать молекулярное полное и сокращенное ионное уравнение гидролиза солей, указать реакцию среды и окраску лакмуса в результате гидролиза K2S?
- Гидролиз солей
- 🔍 Видео
Ответы и объяснения 1
LiNO3 + H2O —> гидролиз не идет.. так как это соль образована сильной кислотой (HNO3)и сильным основанием (КОН)
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Видео:Гидролиз солей. 1 часть. 11 класс.Скачать

Составить молекулярные и ионные уравнения гидролиза солей : 1)LiNO3?
Химия | 10 — 11 классы
Составить молекулярные и ионные уравнения гидролиза солей : 1)LiNO3.
Определить pH среды изменение цвета лакмуса.
2)ZnCl2 + HOH = ZnOHCl + HCl Zn(2 + ) + HOH = ZnOH( + ) + H( + ) — лакмус красный
4) Na2SO3 + HOH = NaHSO3 + NaOH SO3(2 — ) + HOH = HSO3( — ) + OH( — ) — синий
3)Ca(2 + ) + HOH = CaOH( + ) + H( + )
Ca(2 + ) + 2CH3 — COO( — ) + HOH = CaOH( + ) + CH3 — COO( — ) + H( + ) + CH3 — COO( — )
Ca(CH3COO)2 + HOH = CaOHCH3COO + CH3COOH — красный.
Видео:Гидролиз солей. 9 класс.Скачать

Напишите молекулярные и ионные уравнения гидролиза соли?
Напишите молекулярные и ионные уравнения гидролиза соли.
И укажыте рН среды : NH4Cl.
Видео:ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

ПОМОГИТЕ?
составить уравнение гидролиза соли(сокращенное ионное и полное молекулярное), запишите выражение для константы гидролиза и определите реакцию среды
Видео:Гидролиз солей. 2 часть. 11 класс.Скачать

Составить ионно — молекулярные уравнения гидролиза солей FeCl3, Na3PO4?
Составить ионно — молекулярные уравнения гидролиза солей FeCl3, Na3PO4.
Видео:Химия 9 класс (Урок№8 - Гидролиз солей.)Скачать

Составить ионно — молекулярное и молекулярное уравнения гидролиза соли CrCl3?
Составить ионно — молекулярное и молекулярное уравнения гидролиза соли CrCl3.
Вычислить константу, степень и рН гидролиза соли в 0, 1 М растворе этой соли.
Видео:11 класс. Гидролиз солей.Скачать

Напишите уравнение реакций гидролиза сульфидов натрия, аммония и алюминия в молекулярной и ионной формах?
Напишите уравнение реакций гидролиза сульфидов натрия, аммония и алюминия в молекулярной и ионной формах.
В какой цвет окрасится индикаторы фенолфталеин и лакмус в растворах этих солей.
Видео:Ступенчатый гидролиз солей по аниону. Решаем примеры.Скачать

Составить молекулярные и ионные уравнение гидролиза солей : NaCH3COO ; Cr(SO4)3, MnS, NaNO3 указать PH среды?
Составить молекулярные и ионные уравнение гидролиза солей : NaCH3COO ; Cr(SO4)3, MnS, NaNO3 указать PH среды.
Видео:Гидролиз солей. Классификация солей. Решение примеров.Скачать

В какой цвет окрасился лакмус в растворе соли нитрата меди 2?
В какой цвет окрасился лакмус в растворе соли нитрата меди 2.
Напишите ионное и молекулярное уравнение реакций.
Видео:Гидролиз солей. Практическая часть. 10 класс.Скачать

Составьте молекулярные и ионно — молекулярные уравнения гидролиза гидрокарбоната рубидия (RbHSO₃) и на основании этих уравнений определите реакцию среды (кислая, нейтральная, щелочная) и рН?
Составьте молекулярные и ионно — молекулярные уравнения гидролиза гидрокарбоната рубидия (RbHSO₃) и на основании этих уравнений определите реакцию среды (кислая, нейтральная, щелочная) и рН.
Укажите цвет лакмуса и фенолфталеина в растворах солей.
Видео:Гидролиз примерСкачать

В какой цвет окрасится лакмус в растворе нитрата железа(2)?
В какой цвет окрасится лакмус в растворе нитрата железа(2)?
Напишите уравнения гидролиза в краткой ионной молекулярной формах.
Видео:Гидролиз солейСкачать

Написать молекулярное полное и сокращенное ионное уравнение гидролиза солей, указать реакцию среды и окраску лакмуса в результате гидролиза K2S?
Написать молекулярное полное и сокращенное ионное уравнение гидролиза солей, указать реакцию среды и окраску лакмуса в результате гидролиза K2S.
Вы перешли к вопросу Составить молекулярные и ионные уравнения гидролиза солей : 1)LiNO3?. Он относится к категории Химия, для 10 — 11 классов. Здесь размещен ответ по заданным параметрам. Если этот вариант ответа не полностью вас удовлетворяет, то с помощью автоматического умного поиска можно найти другие вопросы по этой же теме, в категории Химия. В случае если ответы на похожие вопросы не раскрывают в полном объеме необходимую информацию, то воспользуйтесь кнопкой в верхней части сайта и сформулируйте свой вопрос иначе. Также на этой странице вы сможете ознакомиться с вариантами ответов пользователей.
Вот так вот все выходит.
3Zn + 2H3PO4 = Zn3(PO4)2 + 3H2 n(Zn) = m / M = 4 г / 65 г / моль = 0, 06 моль n(Zn3(PO4)2) = 1 / 3 n(Zn) = 0, 02 моль — по уравнению реакции m(Zn3(PO4)2) = n * M = 0, 02 моль * 386 г / моль = 7, 72г.
M = 25 (г) M(PH3) = 31 + 3 * 1 = 34 (г / моль) n = m / M = 25 / 34 = 0. 74(моль) V = Vm * n, Vm — объем газа при н. У. = 22, 4 (л / моль) V = 22. 4 * 0. 74 = 16. 58 (л) m = 10 (г) M(SO3) = 32 + 3 * 16 = 80 (г / моль) n = m / M = 10 / 80 = 0. 13..
1. Где в периодической таблице находятся неметаллы, которые проявляют особенно сильные окислительные свойства, т. Е. способность присоединять электроны? — во 2 — ом и 3 — м периодах VI — VII групп. 2. Какой элемент из неметаллов проявляет самые си..
1)ков. Не полярная 2)ионная 3)ков. Полярная.
1) в 2) Б 3) В 4) Б 5) Б 6) Б 7) А 8) А 9) А 10) В 11) 1в, 2а, 3г, 4б.
Просуммировав количество электронов на уровнях, мы получим порядковый номер элемента и заряд его атома. 1) 2 + 8 + 3 = 13 (это порядковый номер алюминия и его заряд атома + 13) 2) 4 + 2 = 6 это УГЛЕРОД , заряд ядра его атома + 6 ; 3) 2 + 8 + 5 = 15 ..
Ковалентная полярная молекула неметалла с кислотным остатком никак не может образовать ионную связь + неорганическое вещество.
1) 4 2) 2 3) 1 4) 1 5) 2 6) 2 7) 4 8) 2 9) 3 10) 11) 3 12) 2.
Видео:Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать

Гидролиз солей
Водные растворы солей имеют разные значения рН и показывают различную реакцию среды — кислую, щелочную, нейтральную.
Например, водный раствор хлорида алюминия AlCl3 имеет кислую среду (рН 7), растворы хлорида натрия NaCl и нитрита свинца Pb(NO2)2 — нейтральную среду (pН = 7). Эти соли не содержат в своем составе ионы водорода Н + или гидроксид-ионы ОН — , которые определяют среду раствора. Чем же можно объяснить различные среды водных растворов солей? Это объясняется тем, что в водных растворах соли подвергаются гидролизу.
Слово «гидролиз» означает разложение водой («гидро» — вода, «лизис» — разложение).
Гидролиз — одно из важнейших химических свойств солей.
Гидролизом соли называется взаимодействие ионов соли с водой, в результате которого образуются слабые электролиты.
Сущность гидролиза сводится к химическому взаимодействию катионов или анионов соли с гидроксид-ионами ОН — или ионами водорода Н + из молекул воды. В результате этого взаимодействия образуется малодиссоциирующее соединение (слабый электролит). Химическое равновесие процесса диссоциации воды смещается вправо.
Поэтому в водном растворе соли появляется избыток свободных ионов Н + или ОН — , и раствор соли показывает кислую или щелочную среду.
Гидролиз — процесс обратимый для большинства солей. В состоянии равновесия только небольшая часть ионов соли гидролизуется.
Любую соль можно представить как продукт взаимодействия кислоты с основанием. Например, соль NaClO образована слабой кислотой HClO и сильным основанием NaOH.
В зависимости от силы исходной кислоты и исходного основания соли можно разделить на 4 типа:
Соли I, II, III типов подвергаются гидролизу, соли IV типа не подвергаются гидролизу
Рассмотрим примеры гидролиза различных типов солей.
I. Соли, образованные сильным основанием и слабой кислотой, подвергаются гидролизу по аниону. Эти соли образованы катионом сильного основания и анионом слабой кислоты, который связывает катион водорода Н + молекулы воды, образуя слабый электролит (кислоту).
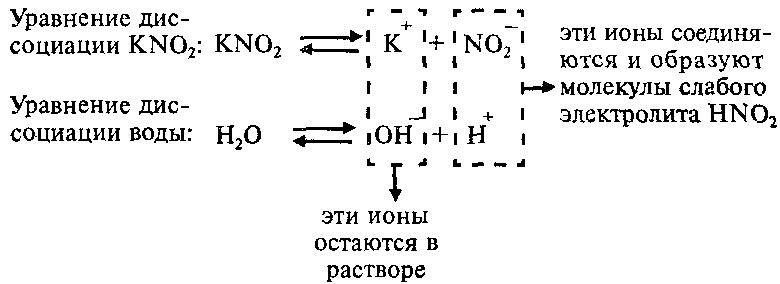
Пример: Составим молекулярное и ионные уравнения гидролиза нитрита калия KNO2.
Соль KNO2 образована слабой одноосновной кислотой HNO2 и сильным основанием KОН, что можно изобразить схематически так:
Напишем уравнение гидролиза соли KNO2:
Каков механизм гидролиза этой соли?
Так как ионы Н + соединяются в молекулы слабого электролита HNО2, их концентрация уменьшается и равновесие процесса диссоциации воды по принципу Ле-Шателье смещается вправо. В растворе увеличивается концентрация свободных гидроксид-ионов ОН — . Поэтому раствор соли KNO2 имеет щелочную реакцию (pН > 7).
Вывод: Соли, образованные сильным основанием и слабой кислотой, при растворении в воде показывают щелочную реакцию среды, pН > 7.
II. Соли, образованные слабым основанием и сильной кислотой, гидролизуются по катиону. Эти соли образованы катионом слабого основания и анионом сильной кислоты. Катион соли связывает гидроксид-ион ОН — воды, образуя слабый электролит (основание).
Пример: Составим молекулярное и ионное уравнения гидролиза йодида аммония NH4I.
Соль NH4I образована слабым однокислотным основанием NH4OH и сильной кислотой НI:
При растворении в воде соли NH4I катионы аммония NH4 + связываются с гидроксид-ионами ОН — воды, образуя слабый электролит – гидроксид аммония NH4OH. В растворе появляется избыток ионов водорода Н + . Среда раствора соли NH4I – кислая, рН — из молекулы воды и образует слабое основание, и анионом слабой кислоты, который связывает ионы Н + из молекулы воды и образует слабую кислоту. Реакция растворов этих солей может быть нейтральной, слабокислой или слабощелочной. Это зависит от констант диссоциации слабой кислоты и слабого основания, которые образуются в результате гидролиза.
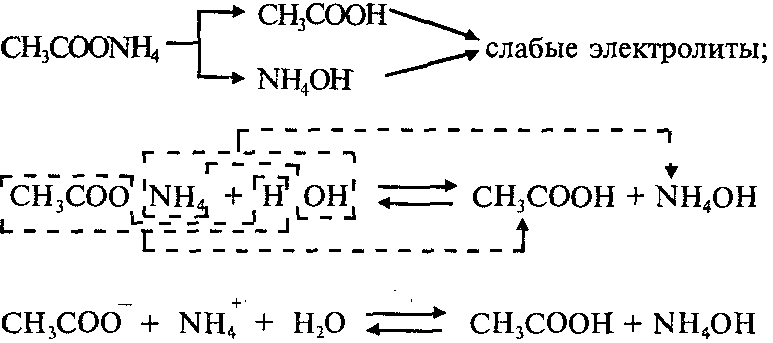
Пример 1: Составим уравнения гидролиза ацетата аммония CH3COONH4. Эта соль образована слабой уксусной кислотой СН3СООН и слабым основанием NH4ОH:
Реакция раствора соли CH3COONH4 – нейтральная (рН=7), потому что Kд(СН3СООН)=Kд(NH4ОH).
Пример 2: Составим уравнения гидролиза цианида аммония NH4CN. Эта соль образована слабой кислотой HCN и слабым основанием NH4ОH:
Реакция раствора соли NH4CN — слабощелочная (pН > 7), потому что Kд(NH4ОH)> Kд(HCN).
Как уже было отмечено, для большинства солей гидролиз является обратимым процессом. В состоянии равновесия гидролизуется только небольшая часть соли. Однако некоторые соли полностью разлагаются водой, т. е. для них гидролиз является необратимым.
Необратимому (полному) гидролизу подвергаются соли, которые образованы слабым нерастворимым или летучим основанием и слабой летучей или нерастворимой кислотой. Такие соли не могут существовать в водных растворах, К ним, например, относятся:
Пример: Составим уравнение гидролиза сульфида алюминия Al2S3:
Гидролиз сульфида алюминия протекает практически полностью до образования гидроксида алюминия Al(OH)3 и сероводорода H2S.
Поэтому в результате обменных реакций между водными растворами некоторых солей не всегда образуются две новые соли. Одна из этих солей может подвергаться необратимому гидролизу с образованием соответствующего нерастворимого основания и слабой летучей (нераствориой) кислоты. Например:
Суммируя эти уравнения, получаем:
или в ионном виде:
IV. Соли, образованные сильной кислотой и сильным основанием, не гидролизуются, потому что катионы и анионы этих солей не связываются с ионами Н + или ОН — воды, т. е. не образуют с ними молекул слабых электролитов. Равновесие диссоциации воды не смещается. Среда растворов этих солей — нейтральная (рН = 7,0), так как концентрации ионов Н + и ОН — в их растворах равны, как в чистой воде.
Вывод: Соли, образованные сильной кислотой и сильным основанием, при растворении в воде гидролизу не подвергаются и показывают нейтральную реакцию среды (рН = 7,0).
Ступенчатый гидролиз
Гидролиз солей может протекать ступенчато. Рассмотрим случаи ступенчатого гидролиза.
Если соль образована слабой многоосновной кислотой и сильным основанием, число ступеней гидролиза зависит от основности слабой кислоты. В водном растворе таких солей на первых ступенях гидролиза образуются кислая соль вместо кислоты и сильное основание. Ступенчато гидролизуюгся соли Na2SO3, Rb2CО3, K2SiO3, Li3PO4 и др.
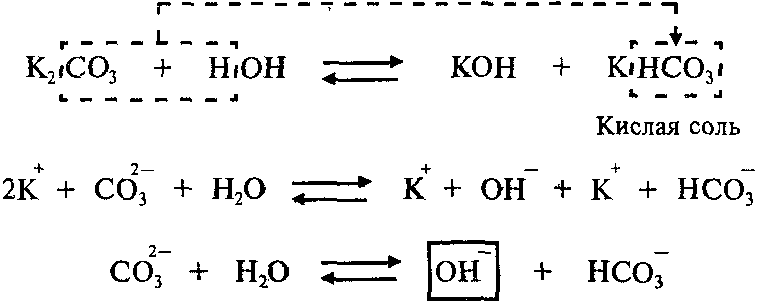
Пример: Составим молекулярное и ионное уравнения гидролиза карбоната калия K2СО3.
Гидролиз соли K2СО3 протекает по аниону, потому что соль карбонат калия образована слабой кислотой Н2СО3 и сильным основанием KОН:
Так как Н2СО3 – двухосновная кислота, гидролиз K2СО3 протекает по двум ступеням.
Продуктами первой ступени гидролиза K2СО3 являются кислая соль KHCO3 и гидроксид калия KОН.
Вторая ступень (гидролиз кислой соли, которая образовалась в результате первой ступени):
Продуктами второй ступени гидролиза K2СО3 являются гидроксид калия и слабая угольная кислота Н2СО3. Гидролиз по второй ступени протекает в значительно меньшей степени, чем по первой ступени.
Среда раствора соли K2СО3 — щелочная (рН > 7), потому что в растворе увеличивается концентрация ионов ОН — .
Если соль образована слабым многокислотным основанием и сильной кислотой, то число ступеней гидролиза зависит от кислотности слабого основания. В водных растворах таких солей на первых ступенях образуется основная соль вместо основания и сильная кислота. Ступенчато гидролизуются соли MgSО4, CoI2, Al2(SO4)3, ZnBr2 и др.
Пример: Составим молекулярное и ионное уравнения гидролиза хлорида никеля (II) NiCl2.
Гидролиз соли NiCl2 протекает по катиону, так как соль образована слабым основанием Ni(OH)2 и сильной кислотой НСl. Катион Ni 2+ связывает гидроксид-ионы ОН — воды. Ni(OH)2 — двухкислотное основание, поэтому гидролиз протекает по двум ступеням.
Продуктами первой ступени гидролиза NiCl2 являются основная соль NiOHCl и сильная кислота HCl.
Вторая ступень (гидролиз основной соли, которая образовалась в результате первой ступени гидролиза):
Продуктами второй ступени гидролиза являются слабое основание гидроксид никеля (II) и сильная хлороводородная кислота НCl. Однако степень гидролиза по второй ступени намного меньше, чем по первой ступени.
Среда раствора NiCl2 — кислая, рН + .
Гидролизу подвергаются не только соли, но и другие неорганические соединения. Гидролизуются также жиры, углеводы, белки и другие вещества, свойства которых изучаются в курсе органической химии. Поэтому можно дать более общее определение процесса гидролиза:
Гидролиз — это реакция обменного разложения веществ водой.
🔍 Видео
Гидролиз солей и среда водных растворов веществ, Задание 21 | ЕГЭ по химии 2024Скачать

Гидролиз этоСкачать

Химия 8 класс: Гидролиз солейСкачать

Гидролиз без уравнений реакций #химия #химияскатей #гидролиз #егэхимия #химияегэ #огэхимия #химияогэСкачать

гидролиз солейСкачать

Гидролиз солей.ПримерыСкачать

10 класс § 11 "Гидролиз солей"Скачать

Гидролиз гидридов #химия #химияскатей #химияегэ #химияогэ #егэхимия #огэхимия #easy.chemistryСкачать