Нитрат кальция Ca(NO3)2 — соль щелочного металла кальция и азотной кислоты. Белый, при нагревании разлагается. Хорошо растворяется в воде (гидролиза нет).
Относительная молекулярная масса Mr = 164,09; относительная плотность для тв. и ж. состояния d = 2,36; tпл = 561º C (разлагается).
- Способ получения
- Качественная реакция
- Химические свойства
- Гидролиз
- Определение гидролиза
- Условия гидролиза
- Индикаторы среды раствора
- Виды гидролиза
- Соль с сильным основанием и сильной кислотой
- Соль со слабым основанием и сильной кислотой
- Соль с сильным основанием и слабой кислотой
- Ступенчатый гидролиз
- Обратимый и необратимый гидролиз
- Степень гидролиза
- Вопросы для самопроверки:
- 1.4.7. Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная.
- 💡 Видео
Видео:Гидролиз солей. 9 класс.Скачать

Способ получения
1. Нитрат кальция можно путем взаимодействия кальция и разбавленной азотной кислоты, образуется нитрат кальция, оксид азота (I) и вода:
если кальций будет взаимодействовать с очень разбавленной азотной кислотой , то на выходе будет образовываться нитрат кальция, нитрат аммония и вода:
2. В результате взаимодействия сульфида кальция и концентрированной азотной кислоты образуется нитрат кальция, сера, оксид азота (IV) и вода:
Видео:Гидролиз солей. 1 часть. 11 класс.Скачать

Качественная реакция
Качественная реакция на нитрат кальция — взаимодействие с медью при нагревании в присутствии концентрированной кислоты:
1. При взаимодействии с серной кислотой и медью, нитрат кальция образует сульфат кальция, нитрат меди, бурый газ оксид азота и воду:
Видео:Гидролиз солей. Классификация солей. Решение примеров.Скачать

Химические свойства
1. Hитрат кальция разлагается при температуре 450 — 500º С с образованием нитрита кальция и кислорода:
а если температуре поднимется выше 561 о С, то на выходе реакции будут образовываться оксид кальция, оксид азота (IV) и кислород:
2. Нитрат кальция реагирует с простыми веществами :
2.1. Нитрат кальция вступает в реакцию с атомным водородом (цинком и в присутствии соляной кислоты). В результате реакции образуется нитрат кальция и вода :
3. Возможны реакции между нитратом кальция и сложными веществами :
Нитрат кальция вступает в реакцию с cолями :
В результате реакции между нитратом кальция и гидрофосфатом натрия при кипении образуется фосфат кальция, азотная кислота и нитрат натрия:
Видео:Химия 9 класс (Урок№8 - Гидролиз солей.)Скачать

Гидролиз
О чем эта статья:
11 класс, ЕГЭ/ОГЭ
Видео:Электролиз. 10 класс.Скачать

Определение гидролиза
| Гидролиз — это процесс взаимодействия сложного химического вещества с водой, итогом которого становится разложение молекул этого вещества. Сам термин происходит от двух греческих слов: hydor, что значит «вода», и lysis, то есть «распад». |
Гидролизации подвержены как органические, так и неорганические вещества: углеводы, белки, оксиды, карбиды, соли и т. д. Например, гидролиз органических соединений напрямую связан с пищеварением — с его помощью происходит распад и усвоение клетками организма жиров, белков, углеводов. Но сейчас мы займемся неорганической химией и рассмотрим гидролизацию на примере солей.
| Гидролиз солей — это реакция взаимодействия ионов соли с Н + и ОН − ионами воды, которая ведет к распаду исходного соединения. В результате такого ионного обмена образуется слабый электролит — кислотный, щелочной или нейтральный. |
Видео:Гидролиз солейСкачать

Условия гидролиза
Далеко не все соединения распадаются, вступая в реакцию с молекулами воды. Сейчас мы на примере солей рассмотрим, какие вещества подвергаются гидролизу, а какие нет, и от чего это зависит.
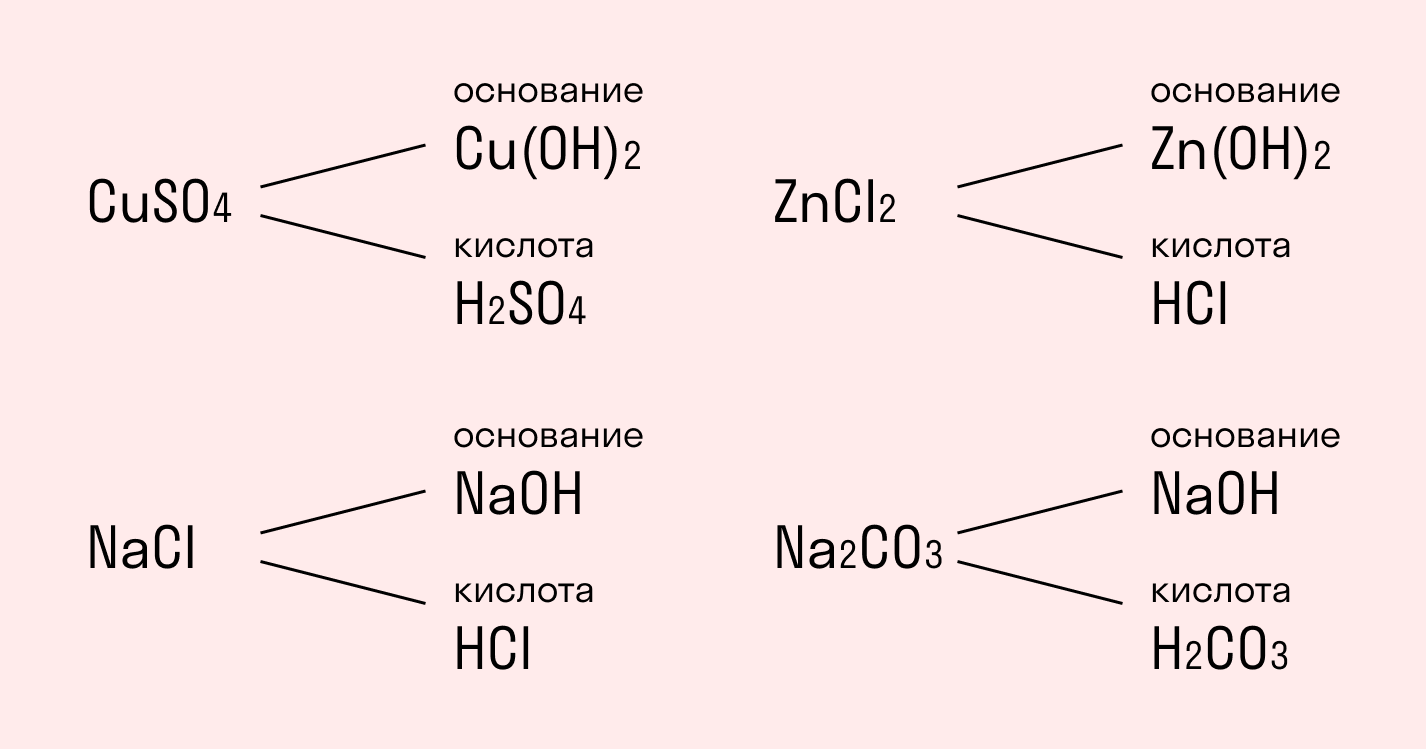
Начнем с того, что любая соль включает основание — амфотерный гидроксид, и кислотный остаток.
сульфат меди CuSO4состоит из основания Cu(ОН)2и кислоты H2SO4;
хлорид натрия NaCl состоит из основания NaOH и кислоты HCl;
хлорид цинка ZnCl2состоит из основания Zn(ОН)2 и кислоты HCI;
карбонат натрия Na2CO3состоит из основания NaOH и кислоты H2CO3.
В жизни первым разрушается самое слабое, и гидролиз в химии действует по тому же принципу. В ходе этой реакции распадаются более слабые соединения (основания или кислотные остатки). Слабый катион или слабый анион вступают во взаимодействие с ионами воды и связывают один из них или оба. В растворе образуется избыток ионов H + или гидроксильная группа OH − .
В зависимости от того, какие соли подвергаются гидролизу — со слабым основанием или слабой кислотой, в итоге может получиться кислая, щелочная или нейтральная среда водного раствора.
А что происходит, если соль состоит из сильного основания и сильного кислотного остатка? Ничего. 🙂 В этом случае ее сильные катионы и анионы не взаимодействуют с ионами воды. Такая соль не распадается, то есть не подвержена гидролизу.
Схема химической реакции гидролиза выглядит так:
XY + HOH ↔ XH + HOY
В данном случае:
XY — формула соли;
XH — кислотный остаток;
Видео:Химия | Молекулярные и ионные уравненияСкачать

Индикаторы среды раствора
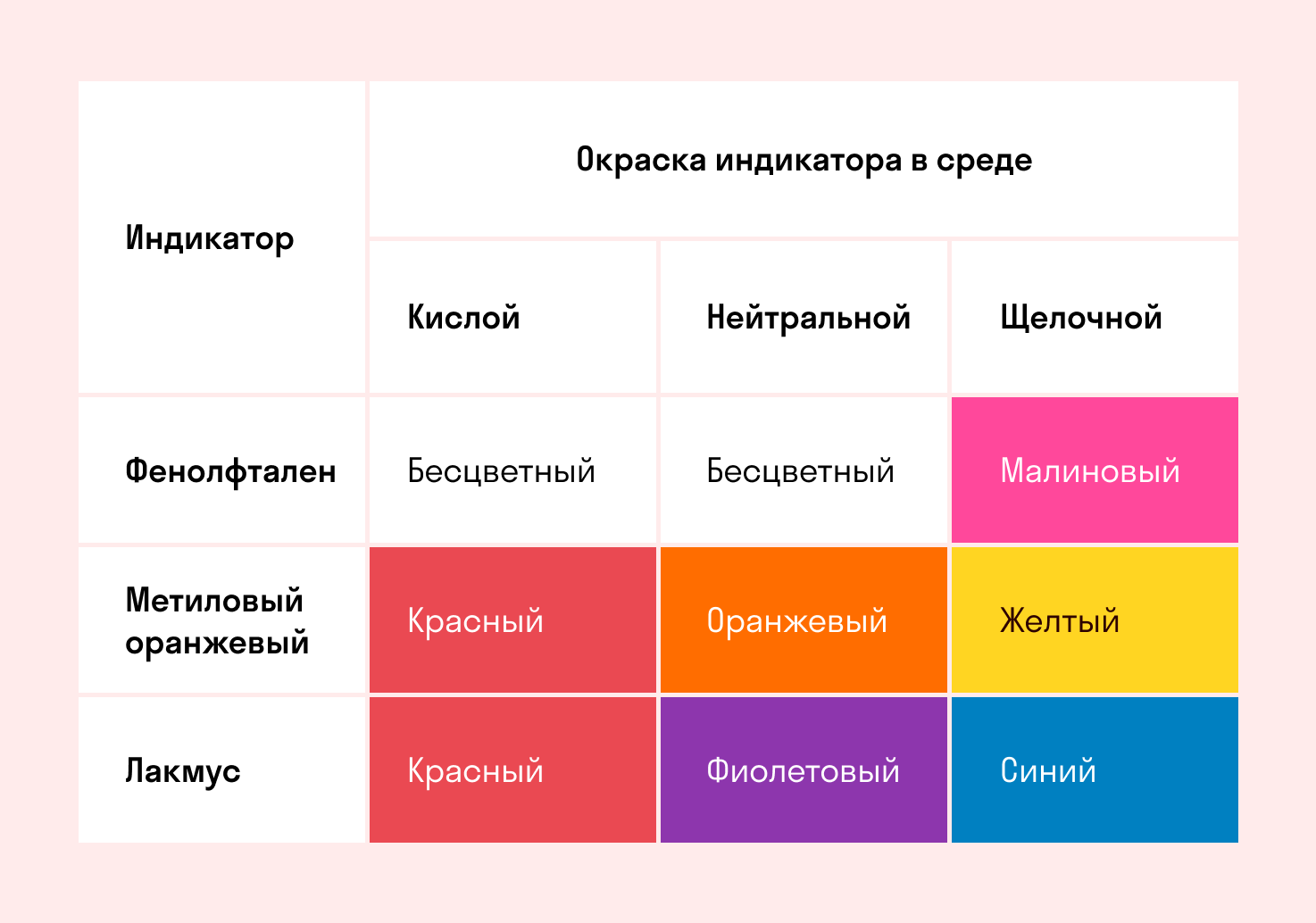
Для определения среды раствора за считанные секунды используются специальные индикаторы. Самый распространенный из них — лакмусовая бумага, но также популярны фенолфталеин и метиловый оранжевый. В нейтральной среде они не меняют свой цвет, а в кислотной или щелочной — приобретают другую окраску.
Изменение цвета индикатора однозначно говорит о том, что произошла гидролизация. Однако если цвет остался тем же — это не всегда означает отсутствие гидролиза. Среда будет почти нейтральной и в том случае, когда гидролизу подвергается соль со слабым основанием и слабой кислотой. Но об этом поговорим дальше, а пока посмотрите таблицу.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Виды гидролиза
Мы выяснили, что в составе соли может быть слабый ион, который и отвечает за гидролизацию. Он находится в основании, в кислотном остатке или в обоих компонентах, и от этого зависит тип гидролиза.
Соль с сильным основанием и сильной кислотой
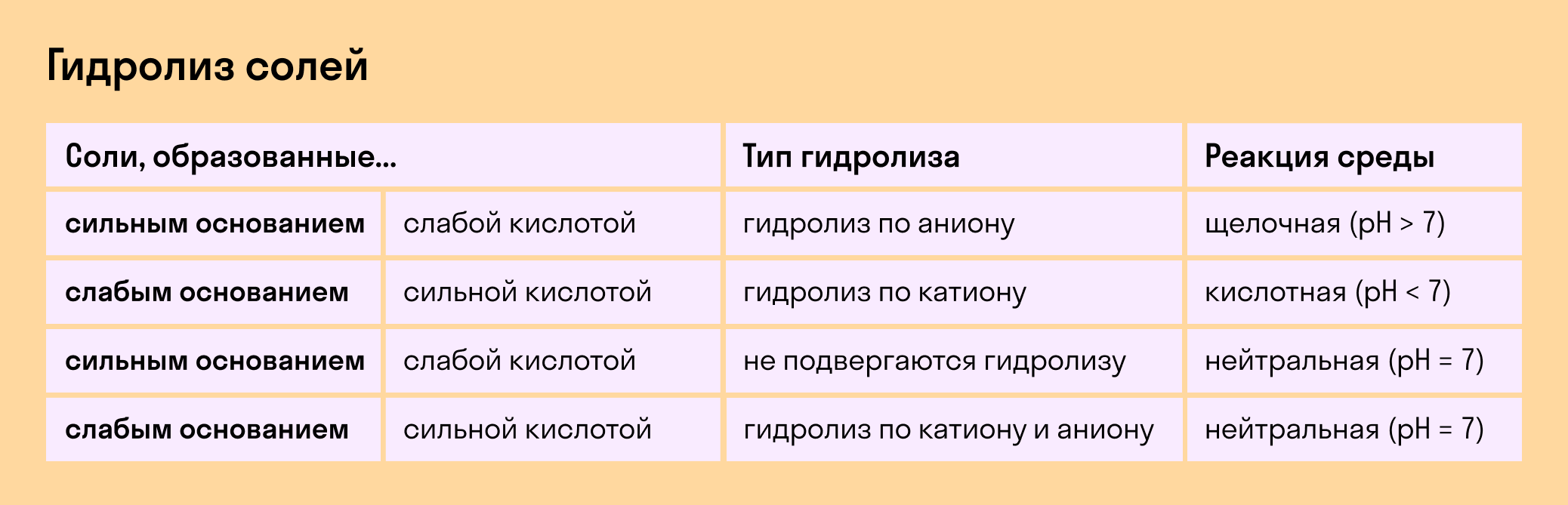
Гидролиз отсутствует. Как вы уже знаете, при наличии сильного основания и сильного кислотного остатка соль не распадается при взаимодействии с водой. Так, например, невозможен гидролиз хлорида натрия (NaCl), поскольку в составе этого вещества нет слабых ионов. К таким же не подверженным гидролизации солям относят KClO4, Ba(NO3)2 и т. д.
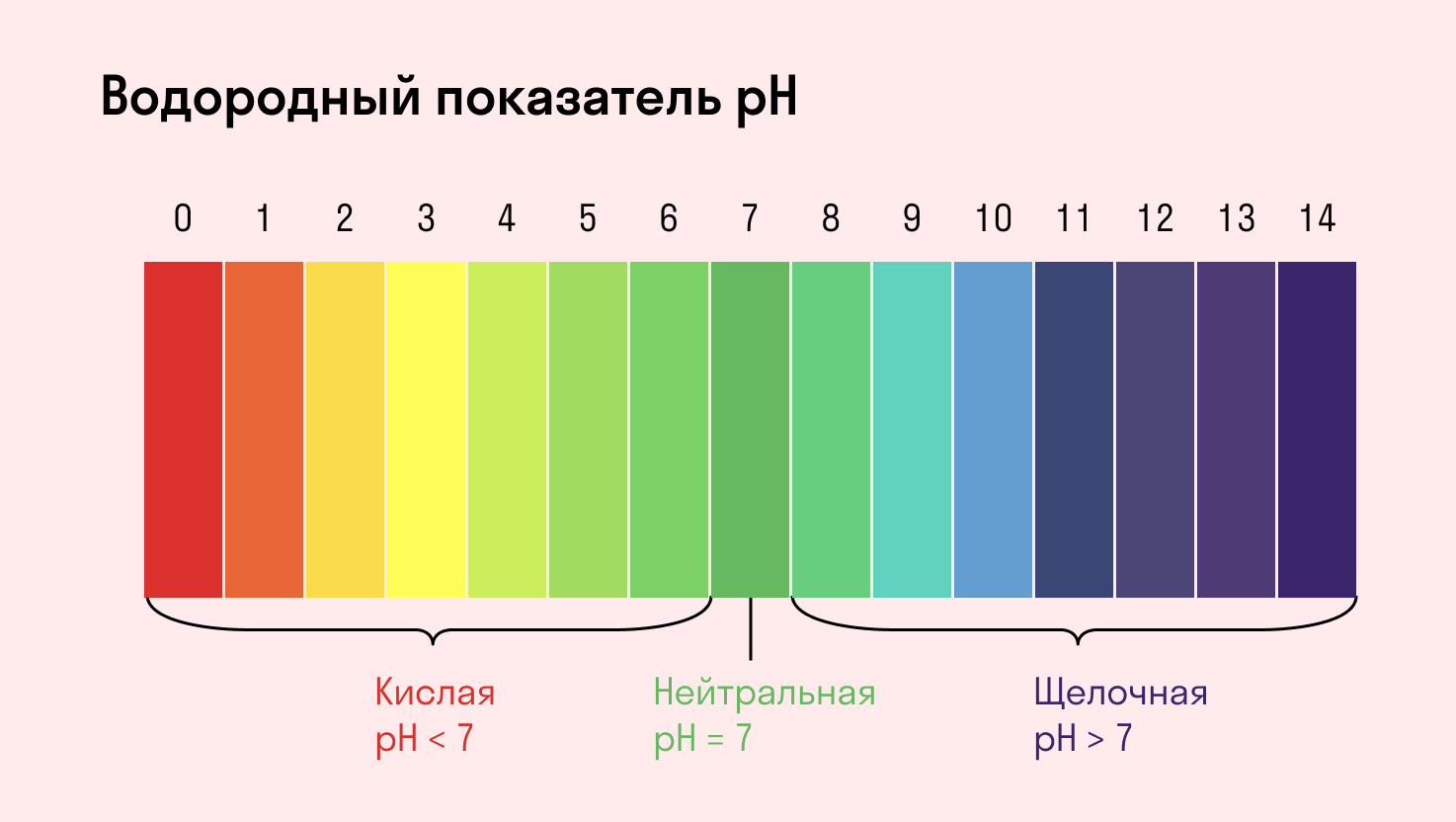
Среда водного раствора — нейтральная, т. е. pH = 7.
Реакция индикаторов: не меняют свой цвет (лакмус остается фиолетовым, а фенолфталеин — бесцветным).
Соль со слабым основанием и сильной кислотой
Гидролиз по катиону. Как мы помним, гидролизация происходит только при наличии слабого иона, в данном случае — иона основания. Его катион вступает в реакцию и связывает гидроксид-ионы воды OH − . В итоге образуется раствор с избытком ионов водорода H + .
Среда водного раствора — кислая, pH меньше 7.
Реакция индикаторов: фенолфталеин остается бесцветным, лакмус и метиловый оранжевый — краснеют.
Нитрат аммония NH4NO3 состоит из слабого основания NH4OH и сильного кислотного остатка HNO3, поэтому он гидролизуется по катиону, то есть его катион NH4 + связывает ионы воды OH − .
Соль с сильным основанием и слабой кислотой
Гидролиз по аниону. Если слабым оказывается ион кислотного остатка, его отрицательно заряженная частица (анион) взаимодействует с катионом водорода H + в молекуле воды. В итоге получается раствор с повышенным содержанием OH − .
Среда водного раствора — щелочная, pH больше 7.
Реакция индикаторов: фенолфталеин становится малиновым, лакмус — синим, а метиловый оранжевый желтеет.
Нитрат калия KNO2 отличается сильным основанием KOH и слабым кислотным остатком HNO2, поэтому он гидролизуется по аниону. Другими словами, анион кислоты NO2 − связывает ионы воды H + .
Молекулярное уравнение: KNO2 + H2O ↔ HNO2 + KOH
Ионное уравнение: K + + NO2 − + HOH ↔ HNO2 + K + + OH −
Гидролиз по катиону и аниону. Если у соли оба компонента — слабые, при взаимодействии с водой в реакцию вступает и анион, и катион. При этом катион основания связывает ионы воды OH − а анион кислоты связывает ионы H +
Среда водного раствора: нейтральная, слабокислая или слабощелочная.
Реакция индикаторов: могут не изменить свой цвет.
Цианид аммония NH4CN включает слабое основание NH4OH и слабую кислоту HCN.
Молекулярное уравнение: NH4CN + H2O ↔ NH4OH + HCN
Ионное уравнение: NH4 + + CN − + HOH ↔ NH4OH + HCN
Среда в данном случае будет слабощелочной.
Обобщим все эти сведения в таблице гидролиза солей.
Ступенчатый гидролиз
Любой из видов гидролиза может проходить ступенчато. Так бывает в тех случаях, когда с водой взаимодействует соль с многозарядными катионами и анионами. Сколько ступеней будет включать процесс — зависит от числового заряда иона, отвечающего за гидролиз.
Как определить количество ступеней:
если соль содержит слабую многоосновную кислоту — число ступеней равняется основности этой кислоты;
если соль содержит слабое многокислотное основание — число ступеней определяют по кислотности основания.
Для примера рассмотрим гидролиз карбоната калия K2CO3. У нас есть двухосновная слабая кислота H2CO3, а значит, гидролизация пройдет по аниону в две ступени.
I ступень: K2CO3+HOH ↔ KOH+KHCO3, итогом которой стало получение гидроксида калия (KOH) и кислой соли (KHCO3).
II ступень: K2HCO3+HOH ↔ KOH+H2CO3, в итоге получился тот же гидроксид калия (KOH) и слабая угольная кислота (H2CO3).
Для приблизительных расчетов обычно принимают в учет только результаты первой ступени.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Обратимый и необратимый гидролиз
Химические вещества могут гидролизоваться обратимо или необратимо. В первом случае распадается лишь некоторое количество частиц, а во втором — практически все. Если соль полностью разлагается водой, это необратимый процесс, и его называют полным гидролизом.
Необратимо гидролизуются соли, в составе которых есть слабые нерастворимые основания и слабые и/или летучие кислоты. Такие соединения могут существовать лишь в сухом виде, их не получить путем смешивания водных растворов других солей.
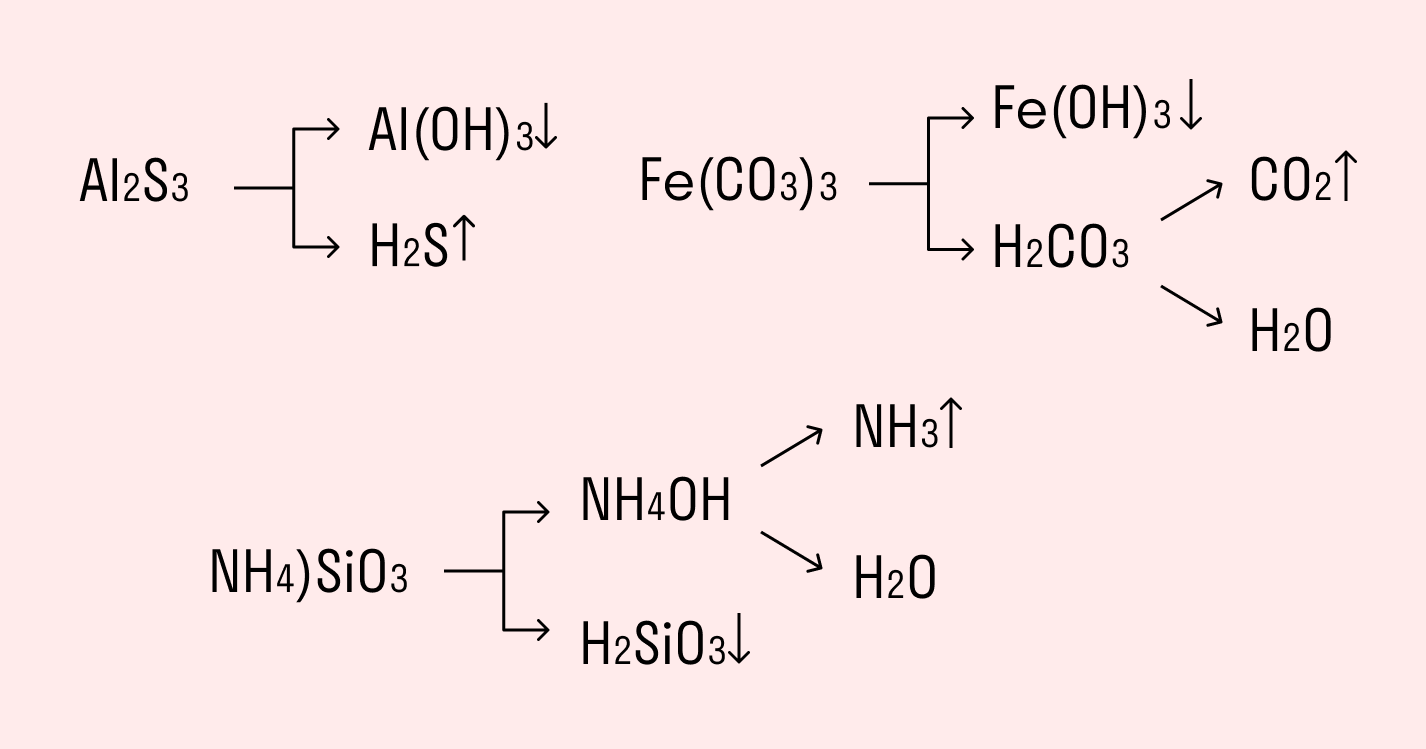
Например, полному гидролизу подвергается сульфид алюминия:
Как видите, в результате гидролизации образуется гидроксид алюминия и сероводород.
Необратимые реакции при взаимодействии с водой имеют место и в органической химии. В качестве примера рассмотрим полный гидролиз органического вещества — карбида кальция, в результате которого образуется ацетилен:
Степень гидролиза
Взаимодействие соли или другого химического соединения с водой может усиливаться или ослабляться в зависимости от нескольких факторов. Если нужно получить количественное выражение гидролиза, говорят о его степени, которая указывается в процентах.
h — степень гидролиза,
nгидр. — количество гидролизованного вещества,
nобщ. — общее количество растворенного в воде вещества.
На степень гидролизации может повлиять:
температура, при которой происходит процесс;
концентрация водного раствора;
состав участвующих в гидролизе веществ.
Можно усилить гидролиз с помощью воды (просто разбавить полученный раствор) или стимулировать процесс повышением температуры. Более сложным способом будет добавление в раствор такого вещества, которое могло бы связать один из продуктов гидролиза. К соли со слабой кислотой и сильным основанием нужно добавить соль со слабым основанием и сильной кислотой.
Для ослабления гидролиза раствор охлаждают и/или делают более концентрированным. Также можно изменить его состав: если гидролизация идет по катиону — добавляют кислоту, а если по аниону — щелочь.
Итак, мы разобрались, что такое гидролиз солей и каким он бывает. Пора проверить свои знания и ответить на вопросы по материалу.
Вопросы для самопроверки:
Назовите необходимое условие для гидролиза.
Какие типы гидролиза вы знаете?
В каком случае в результате гидролиза может образоваться слабощелочная или слабокислая среда?
По какому типу гидролизуется соль с сильным основанием и слабым кислотным остатком?
При гидролизе соли с сильным основанием и слабой кислотой для ослабления процесса нужно добавить в раствор кислоту или щелочь?
Как воздействует на гидролиз разбавление раствора водой?
Как определяется количество ступеней гидролиза?
Какая среда раствора образуется при гидролизации солей NaF, KCl, FeBr2, Na2PO4? Ответов может быть несколько.
Какие из солей гидролизуются по катиону: Csl, FeSO4, RbNO3, CuSO4, Mn(NO3)2? Ответов может быть несколько.
Какая из солей не подвергается гидролизу: K2HPO4, KNO3, KCN, Ni(NO3)2?
Видео:ЕГЭ по химии: гидролиз солей (теория и примеры)Скачать

1.4.7. Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная.
Для того, чтобы понять, что такое гидролиз солей, вспомним для начала, как диссоциируют кислоты и щелочи.
Общим между всеми кислотами является то, что при их диссоциации обязательно образуются катионы водорода (Н + ), при диссоциации же всех щелочей всегда образуются гидроксид-ионы (ОН − ).
В связи с этим, если в растворе, по тем или иным причинам, больше ионов Н + говорят, что раствор имеет кислую реакцию среды, если ОН − — щелочную реакцию среды.
Если с кислотами и щелочами все понятно, то какая же реакция среды будет в растворах солей?
На первый взгляд, она всегда должна быть нейтральной. И правда же, откуда, например, в растворе сульфида натрия взяться избытку катионов водорода или гидроксид-ионов. Сам сульфид натрия при диссоциации не образует ионов ни одного, ни другого типа:
Тем не менее, если бы перед вами оказались, к примеру, водные растворы сульфида натрия, хлорида натрия, нитрата цинка и электронный pH-метр (цифровой прибор для определения кислотности среды) вы бы обнаружили необычное явление. Прибор показал бы вам, что рН раствора сульфида натрия больше 7, т.е. в нем явный избыток гидроксид-ионов. Среда раствора хлорида натрия оказалась бы нейтральной (pH = 7), а раствора Zn(NO3)2 кислой.
Единственное, что соответствует нашим ожиданиям – это среда раствора хлорида натрия. Она оказалась нейтральной, как и предполагалось.
Но откуда же взялся избыток гидроксид-ионов в растворе сульфида натрия, и катионов-водорода в растворе нитрата цинка?
Попробуем разобраться. Для этого нам нужно усвоить следующие теоретические моменты.
Любую соль можно представить как продукт взаимодействия кислоты и основания. Кислоты и основания делятся на сильные и слабые. Напомним, что сильными называют те кислоты, и основания, степень диссоциации, которых близка к 100%.
примечание: сернистую (H2SO3) и фосфорную (H3PO4) чаще относят к кислотам средней силы, но при рассмотрении заданий по гидролизу нужно относить их к слабым.
Кислотные остатки слабых кислот, способны обратимо взаимодействовать с молекулами воды, отрывая от них катионы водорода H + . Например, сульфид-ион, являясь кислотным остатком слабой сероводородной кислоты, взаимодействует с ней следующим образом:
S 2- + H2O ↔ HS − + OH −
Как можно видеть, в результате такого взаимодействия образуется избыток гидроксид-ионов, отвечающий за щелочную реакцию среды. То есть кислотные остатки слабых кислот увеличивают щелочность среды. В случае растворов солей содержащих такие кислотные остатки говорят, что для них наблюдается гидролиз по аниону.
Кислотные остатки сильных кислот, в отличие от слабых, с водой не взаимодействуют. То есть они не оказывают влияния на pH водного раствора. Например, хлорид-ион, являясь кислотным остатком сильной соляной кислоты, с водой не реагирует:
То есть, хлорид-ионы, не влияют на pН раствора.
Из катионов металлов, так же с водой способны взаимодействовать только те, которым соответствуют слабые основания. Например, катион Zn 2+ , которому соответствует слабое основание гидроксид цинка. В водных растворах солей цинка протекают процессы:
Zn 2+ + H2O ↔ Zn(OH) + + H +
Zn(OH) + + H2O ↔ Zn(OH) + + H +
Как можно видеть из уравнений выше, в результате взаимодействия катионов цинка с водой, в растворе накапливаются катионы водорода, повышающие кислотность среды, то есть понижающие pH. Если в состав соли, входят катионы, которым соответствуют слабые основания, в этом случае говорят что соль гидролизуется по катиону.
Катионы металлов, которым соответствуют сильные основания, с водой не взаимодействуют. Например, катиону Na + соответствует сильное основание – гидроксид натрия. Поэтому ионы натрия с водой не реагируют и никак не влияют на pH раствора.
Таким образом, исходя из вышесказанного соли можно разделить на 4 типа, а именно, образованные:
1) сильным основанием и сильной кислотой,
Такие соли не содержат ни кислотных остатков, ни катионов металлов, взаимодействующих с водой, т.е. способных повлиять на pH водного раствора. Растворы таких солей имеют нейтральную реакцию среды. Про такие соли говорят, что они не подвергаются гидролизу.
2) сильным основанием и слабой кислотой
В растворах таких солей, с водой реагируют только кислотные остатки. Среда водных растворов таких солей щелочная, в отношении солей такого типа говорят, что они гидролизуются по аниону
Примеры: NaF, K2CO3, Li2S и т.д.
3) слабым основанием и сильной кислотой
У таких солей с водой реагируют катионы, а кислотные остатки не реагируют – гидролиз соли по катиону, среда кислая.
4) слабым основанием и слабой кислотой.
С водой реагируют как катионы, так и анионы кислотных остатков. Гидролиз солей такого рода идет и по катиону, и по аниону. Нередко такие соли подвергаются необратимому гидролизу.
Что же значит то, что они необратимо гидролизуются?
Поскольку в данном случае с водой реагируют и катионы металла (или NH4 + ) и анионы кислотного остатка, в раcтворе одновременно возникают и ионы H + , и ионы OH − , которые образуют крайне малодиссоциирующее вещество – воду (H2O).
Это, в свою очередь, приводит к тому, что соли образованные кислотными остатками слабых оснований и слабых кислот не могут быть получены обменными реакциями, а только твердофазным синтезом, либо и вовсе не могут быть получены. Например, при смешении раствора нитрата алюминия с раствором сульфида натрия, вместо ожидаемой реакции:
Наблюдается следующая реакция:
Тем не менее, сульфид алюминия без проблем может быть получен сплавлением порошка алюминия с серой:
При внесении сульфида алюминия в воду, он также как и при попытке его получения в водном растворе, подвергается необратимому гидролизу.
💡 Видео
Какие соли подвергаются гидролизу только по аниону? A) нитрат натрия, фосфат кальцияСкачать

Какие соли подвергаются гидролизу и по катиону и по аниону? A) нитрат алюминия, сульфат цинкаСкачать

Разбор заданий по гидролизу солейСкачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

СОЛИ ХИМИЯ 8 КЛАСС // Урок Химии 8 класс: Классификация солей, Формулы Солей, Кислотный ОстатокСкачать

ГИДРОЛИЗСкачать

Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

Гидролиз простыми словами | Решаю НОВЫЕ задачи в формате ЕГЭ 2022Скачать

Электролиз раствора нитрата калияСкачать