химические реакции Мы можем найти их в повседневной жизни в целом. Это ответ, который химик мог бы дать вам без ошибок, чтобы преувеличивать.
И это то, что кто-то стремится в этом вопросе будет пытаться увидеть вещи с молекулярной или атомной точки зрения, будет пытаться увидеть реакции повсюду, и молекулы постоянно превращаются.
Люди, разбирающиеся в химии, не могут не видеть вещи с этой точки зрения, точно так же, как физик мог видеть вещи с ядерной точки зрения или биолог с клеточной точки зрения..
Для обоснования комментария ниже я привожу 30 примеров химии, присутствующей в повседневной жизни..
Химические реакции, которые остаются незамеченными дома, на кухне, в саду, на улице или даже внутри нашего тела. Я надеюсь, что это поможет осветить обычную и рутинную химию в повседневной жизни..
- 30 химических реакций, которые вы видите каждый день в своей жизни
- Химия на кухне
- Химия в доме
- Химия в саду
- Химия на улице
- Химия в вашем теле
- Химический характер житейских ситуаций презентация к уроку по химии (10 класс) на тему
- Скачать:
- Предварительный просмотр:
- Подписи к слайдам:
- Презентация к уроку по химии на тему: Химический характер житейских ситуаций Викторина для учащихся 10-11 класса.
- Просмотр содержимого документа «Презентация к уроку по химии на тему: Химический характер житейских ситуаций Викторина для учащихся 10-11 класса.»
- 📽️ Видео
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

30 химических реакций, которые вы видите каждый день в своей жизни
Химия на кухне
1- сольватационные реакции: когда соль растворяется в воде, ионные связи разрушаются, что приводит к сольватации катионов и анионов.
Технически готовят раствор хлорида натрия в воде..
2- Фазовые изменения: При кипячении воды во время приготовления или приготовления кофе или чая происходит фазовое изменение между жидкой водой и газированной водой.
3- реакции горения: Газовые плиты используют пропан для производства пламени.
4- ХлорХлор, используемый в качестве моющего средства, на самом деле представляет собой хлорит натрия, который является восстановителем. Пятна от одежды называются хромофорами и имеют ненасыщенность. Хлор атакует эту ненасыщенность, удаляя цвет пятен. Технически это не удаляет пятно, но делает его невидимым.
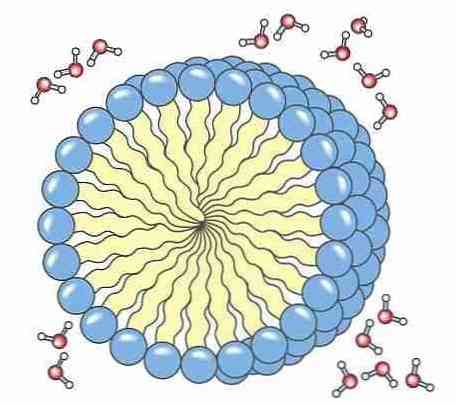
5- мылоМыла и моющие средства имеют полярную часть, обычно карбоновую кислоту, присоединенную к неполярной алифатической цепи, которая дает ей способность образовывать мицеллы. Эти мицеллы обладают способностью окружать грязь, поэтому ее можно удалить с одежды, посуды и нашего тела..
6- Пищевая сода: это слабое основание, которое при взаимодействии с кислотой, такой как уксус или вода (которая является слегка кислой), выделяет углекислый газ.
Это соединение является активным ингредиентом многих антацидов (C., 2015).
7- Среднесрочный: кухня — это химическое изменение, которое меняет пищу, делая ее вкуснее, убивает опасные микроорганизмы и делает их более усвояемыми.
Жар кулинарии может денатурировать белки, стимулировать химические реакции между ингредиентами, карамелизовать сахар и т. Д. (Helmenstine A.M., 10 примеров химических реакций в повседневной жизни, 2017).
8- Искусственный вкус и цвет: многие обработанные пищевые продукты содержат химические вещества, которые придают особый вкус или цвет и способствуют их сохранению.
9- Плачь о луке: лук содержит аминокислотные молекулы сульфоксидов. При разрезании луковых клеточных стенок происходит разрушение, выделяя эти сульфоксиды вместе с ферментами, которые разлагают его до сульфеновых кислот, сероорганического соединения формулы R-SOH, которое раздражает глаза (Reactions, 2016).
Химия в доме
10- АккумуляторыОни используют электродохимические или окислительно-восстановительные реакции для преобразования химической энергии в электрическую. Спонтанные окислительно-восстановительные реакции происходят в гальванических элементах, тогда как не спонтанные химические реакции происходят в электролитических ячейках (Helmenstine, 2017).
11- ЖК-экраны: ЖК-телевизоры содержат спиральные кристаллические молекулы, которые имеют свойство ориентироваться в соответствии с электрическим сигналом и путем изменения тона или цвета, обеспечиваемого светодиодной лампой. Каждая кристаллическая молекула представляет собой пиксель на телевизоре, и чем больше молекул, тем выше разрешение.
12- Старые книги, которые хорошо пахнут: разложение целлюлозы из бумаги книг, придает листьям желтоватый цвет и запах ванили. Если у вас есть старые книги, которые хорошо пахнут в вашей библиотеке, это происходит из-за молекул лигнина или ванилина в нем.
13- Наркотики и наркотикиНекоторые лекарственные средства представляют собой молекулы, которые частично блокируют гормональную активность, вызываемую определенным раздражителем (например, лекарственные средства для снятия напряжения или противоэпилектические средства), в то время как другие являются ферментативными ингибиторами, такими как, например, анальгетики..
14- ШампуньКак шампуни и мыло, шампуни удаляют жир с кожи головы, образуя мицеллы. Ингредиентом, который заботится об этом, обычно являются сульфаты, такие как додецилсульфат или лауриловый эфир сульфата натрия или аммония.
15- Дезодоранты и антиперспиранты: плохой запах подмышек, ног и дыхания вырабатывается бактериями, которые питаются белками и жирами в поте, который выделяет апокринные железы.
У дезодорантов есть химическое соединение, названное триклозаном, который является сильным антибактериальным и фунгицидным средством. С другой стороны, антиперспиранты содержат соли алюминия, которые проникают в поры и предотвращают потоотделение..
16- Косметика и макияжЭто химические вещества и пигменты, которые прилипают к коже. Обычно это неполярные соединения, такие как воски и масла..
Химия в саду
17- Фотосинтез: это процесс, при котором зеленые растения производят свою еду. Это происходит в присутствии солнечного света и другого сырья, а именно углекислого газа и воды. Пигмент хлорофилла собирает световую энергию солнечного света, которая превращается в глюкозу (Crystal, 2017).
18- реакции окисления: на неокрашенных железных поверхностях часто наблюдается оксидное покрытие, которое постепенно приводит к разрушению железа. Это химическое явление, называемое окислением.
В этом случае железо соединяется с кислородом в присутствии воды, что приводит к образованию оксидов железа (химические реакции в повседневной жизни, 2016 г.).
19- Органическое разложениеРазложение органических продуктов питания или даже живых существ — это реакции окисления, вызываемые бактериями, которые разлагают биохимические макромолекулы в простых молекулах, таких как нитриты, нитраты, СО2 и вода (Helmenstine, Примеры химических изменений, 2017).
20- Удобрения: калий, нитраты, фосфаты и сульфаты используются в почвах для обеспечения растений питательными веществами и могут расти.
21- ПестицидыЭто химические вещества, используемые для окуривания сельскохозяйственных культур или садов. Обычно это нейротоксины, которые поражают бактерии или насекомых, которые потребляют зерновые культуры..
Химия на улице
22- Сжигание бензина: автомобили используют бензин в качестве топлива за счет контролируемых взрывов, которые приводят в движение поршни двигателей.
23- Дым машин: вырабатывает свободные радикалы, которые являются очень реактивными соединениями и атакуют кожу или волосы, делая их сухими и ломкими, не говоря уже о том, что они канцерогенные.
24- кислотный дождь: избыток серы и оксидов азота в атмосфере, производимых заводами и автомобилями, растворяется в воде облаков с образованием серной, серной и азотной кислоты, которая выпадает в осадок в виде кислотных дождей.
25- Конструкции: цемент и другие материалы, используемые при строительстве домов, такие как картины, штукатурка и многие другие, являются продуктами химии. В частности, цемент сделан из молекул гидроксида кальция, также называемых негашеной известью.
Химия в вашем теле
26- Пищеварение: пищеварение основано на химических реакциях между пищевыми продуктами и кислотами и ферментами, которые расщепляют молекулы на питательные вещества, которые организм может усваивать и использовать.
27- Аэробное дыхание: основным процессом, который производит энергию в организме, является аэробный гликолиз. Здесь дыхание помогает расщеплять глюкозу (источник энергии) в воде, углекислый газ и энергию в форме АТФ. С6H12О6 + 6O2 → 6CO2 + 6H2O + Энергия (36 АТП)
28- Анаэробное дыхание: из-за перенапряжения, иногда клетки нашего организма истощаются и дышат анаэробно. Это вызывает синтез молочной кислоты. Анаэробное дыхание наблюдается у некоторых бактерий, дрожжей и других организмов. Уравнение анаэробного дыхания:
29- Мускульное движение: напряжение или расслабление мышц происходит из-за конформационных изменений белков скелетных мышц. Эти изменения происходят благодаря фосфокреатину, который при потере фосфата высвобождает энергию для процесса.
30- Мысль: это сложный биохимический процесс, в котором разность ионного потенциала создает электрические импульсы нейронов (Али, 2013).
Видео:ХИМИЧЕСКИЕ УРАВНЕНИЯ | Как составлять уравнения реакций | Химия 8 классСкачать

Химический характер житейских ситуаций
презентация к уроку по химии (10 класс) на тему
Викторина для учащихся 10-11 класса. Рекомендуется для использования в рамках предметной недели.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Скачать:
| Вложение | Размер |
|---|---|
| himicheskiy_harakter_zhiteyskih_situatsiy.pptx | 131.94 КБ |
Предварительный просмотр:
Видео:8 класс. Составление уравнений химических реакций.Скачать

Подписи к слайдам:
Химический характер житейских ситуаций
Почему при открывании бутылки с лимонадом происходит бурное выделение газа? Составьте уравнение химической реакции, происходящей при открывании бутылки с газированной водой. Растворимость газов увеличивается с увеличением давления. Углекислый газ растворяют в лимонаде под давлением, поэтому при открывании бутылки избыточный газ выделяется из раствора. Ответ : H 2 CO 3 =CO 2 + H 2 O
Почему лук «без боли и печали» доводит до слез ? Когда мы режем лук, происходит выделение летучего едкого вещества – тиопропиональдегид — S – оксида. Это соединение является лакриматором, именно оно вызывает слезы, когда мы режем сырой репчатый лук. Установите молекулярную формулу тиопропиональдегид — S – оксида, если массовые доли элементов в нем составляют: C – 40,0%; H -6,6%; O – 17,8%; S=35,6%; Mr =90,14. Ответ: C 3 H 6 OS ( CH 3 — CH 2 -CH=S=O)
Почему лук чистят, смачивая его или нож водой? Когда луковицу разрезают, лакриматор выделяется и растворяется в воде и слезах человека. Поэтому лук чистят, смачивая его или нож водой – лакриматор растворяется в воде и практически не выделяется в воздух. Если лук перед чисткой охладить, то активность лакриматора резко снижается. Вычислите массовую долю углерода в лакриматоре. Ответ: С-40%
Почему бобовые вызывают вздутие живота? Большинство растительных продуктов, содержащих крахмал, включая картофель, кукурузу, горох и пшеницу, усиливают газообразование в кишечнике. Микрофлора в норме расщепляет остатки пищи, которые попадают в толстый кишечник. При этом в кишечнике образуются газы – сероводород, углекислый газ. Составьте уравнение химической реакции, являющейся причиной вздутия кишечника. Ответ: ( C 6 H 10 O 5 ) n+6nO = 6n CO 2 + 5n H 2 O
Почему при приеме таблетки карбоната кальция у больного может возникнуть вздутие живота? Соду принимают при изжоге. Нежелательный побочный эффект – вздутие живота, что обусловлено образованием избытка CO 2 в кишечнике в результате взаимодействия карбоната кальция с соляной кислотой желудка. Составьте уравнение реакции нейтрализации, которая является причиной вздутия живота. Ответ: CaCO 3 +2HCl = CaCl 2 + H 2 O + CO 2
Почему потускневшие жемчужины давали склевать домашней птице? Известен способ реставрации жемчужин. Жемчуг на 86% состоит из карбоната кальция. Верхний потускневший или поцарапанный слой растворяется в соляной кислоте желудочного сока петуха или другой живности, открывается блестящий слой Составьте уравнение химической реакции карбоната кальция с соляной кислотой. Ответ: CaCO 3 +2HCl = CaCl 2 + H 2 CO 3
Почему йодированная соль всегда содержит тиосульфат натрия? Йодированная соль – обычная соль с добавлением йодида калия (25г на 1000кг). Йодид калия под действием влаги и света быстро разлагается, и свободный йод улетучивается из соли. Для увеличения стойкости йодида калия в качестве стабилизатора добавляется тиосульфат натрия (250г на 1000кг) Составьте уравнение химической реакции йода с тиосульфатом натрия и образованием NaI и Na s S 4 O 6 Ответ: 2Na 2 S 2 O 3 + I 2 = 2 NaI + Na s S 4 O 6
Почему в хлебе много дырочек? При замешивании «пекарного порошка» с тестом начинает идти реакция образования углекислого газа CO 2 , причем пузырьки выделяющегося CO 2 задерживаются в тесте. В процессе выпечки эти пузырьки от нагревания расширяются и сообщают хлебу пористость. Составьте уравнение реакции образования углекислого газа, которое соответствует образованию дырочек в хлебе. Ответ: NaH + Na H 2 PO 4 = Na 2 H PO 4 + CO 2 + H 2 O
Почему при выпечке печенья используют пищевую соду? При выпечке печенья в качестве разрыхлителя теста используют пищевую соду с добавкой уксусной кислоты. При нагревании эта смесь разлагается с выделением углекислого газа, что делает тесто пышным. Составьте уравнение реакции соды с уксусной кислотой, которая является причиной пышности теста Ответ: NaH CO 3 + CH 3 COOH = CH 4 COONa + CO 2 + H 2 O
Почему при выпечке хлеба добавляют сухие дрожжи? Сухие дрожжи – смесь солей гидрокарбоната аммония (NH 4 )HCO 3 , карбоната аммония (NH 4 ) 2 CO 3 и карбамата аммония (H 2 NCOO)NH 4 . Все эти соли при нагревании разлагаются с выделением NH 4 и CO 2 . Разлагаясь в тесте при выпечке хлеба, сухие дрожжи придают ему желаемую пористость. Составьте уравнение реакций разложения солей с выделением указанных газов, придающих тесту необходимую пористость. Ответ : (NH 4 )HCO 3 = NH 3 + H 2 O+ CO 2 , (NH 4 ) 2 CO 3 = 2NH 3 + H 2 O +CO 2 , (H 2 NCOO)NH 4 = 2NH 3 + CO 2
Почему именно свежий хлеб пахнет ? В свежем хлебе еще присутствуют молекулы пахучих веществ-гетероциклических альдегидов , в частности фурфурола , имеющего запах свежего ржаного хлеба Установите молекулярную формулу фурфурола , если массовые доли элементов в нем составляют: С-62 , 5% ; H-4,2% ; O-33, 3 % ;М R =96 Г / моль Ответ : С 5 H 4 O 2
Почему ржаной хлеб черствеет медленнее , чем белый ? Черствение хлеба при хранении связано со «старением» крахмала. Ржаной крахмал (С 6 H 10 O 5 ) n связывает почти вдвое больше воды , чем пшеничный , поэтому хлеб из ржаной муки черствеет медленнее Составьте уравнение химической реакции образования крахмала из глюкозы Ответ : nC6 H12 O6 = (C6 H10 O5)n + nH2O .)
Почему встречаются огурцы-»уродцы» ? В конце лета на грядках встречаются огурцы-»уродцы». Огурцы , похожие на скрюченные перцы , вырастают на грядках , когда растениям не хватает азота , а плоды , напоминающие грушу- если не хватает калия. Это объясняется тем , что к концу лета содержание необходимых для роста элементов в почве значительно уменьшается. Пополнять содержание азота в почве следует путем внесения удобрений. Составьте химические формулы веществ , используемых в качестве минеральных удобрений. Ответ : NH 4 NO 3 , N а NO 3 , KNO 3 , C A (NO 3 ) 2 .
Почему летом лучше поить кур и обычной и газированной водой ? У кур , в отличие от млекопитающих , нет потовых желез , поэтому в жаркую погоду теплообмен регулируется за счет повышения интенсивности дыхания , при этом из организма выделяется больше углекислого газа , чем в прохладную погоду.Содержание углекислого газа в крови снижается , а это сказывается на прочности скорлупы яиц ( CaCO3 ).Поение кур газированной водой позволяет повысить содержание углекислого газа в организме птиц , увеличить выработку карбоната кальция и повлиять на прочность скорлупы Ответ : Ca 2+ + H 2 O + С O 2 = CaCO 3 + 2H + . Составьте уравнение химической реакции , которая может повысить прочность скорлупы
Почему для выведения пятна от йода используется сульфит натрия Na 2 SO 3 ? Способ выведения пятен от йода основан на окислительно-восстановительной реакции взаимодействия его с Na 2 S0 3 . Ответ : I 2 + Na 2 SO 3 + 2NaOH= 2NaI + Na 2 SO 4 + H 2 0 Составьте уравнение окислительно-восстановительной реакции , которая лежит в основе способа выведения пятен от йода.
Почему зимой все время хочется спать ? Холодный зимний воздух более разрежен , в нем содержится меньше кислорода , чем требуется для активности нашему организму. Кровь становится более густой , кровоток -более медленным , увеличивается нагрузка на сердце и сосуды. Отсюда- усталость , головные боли , зевота (она является характерным признаком гипоксии (недостатка кислорода) тканей мозга. Ответ : Примерно в 5 раз. Больному с затрудненным дыханием предлагают сделать несколько вдохов из кислородной подушки. Во сколько раз примерно это облегчает его дыхание ?
Почему для удаления накипи используется уксус ? Накипь в чайнике образуется в результате отложения солей кальция и магния. Устранить ее можно , пользуясь уксусной кислотой. При этом нерастворимые соли кальция и магния превращаются в растворимые соли кальция и магния , углекислый газ и воду. Ответ : CaCO 3 +2CH 3 COOH= (CH 3 COO) 2 Ca +H 2 O+ CO 2 ; М gCO 3 + 2CH 3 COOH = (CH 3 COO ) 2 MG +H 2 O +CO 2 . Составьте уравнения химических реакции , которые лежат в основе метода удаления накипи уксусом.
Почему для удаления накипи используют соляную кислоту ? Накипь в чайнике образуется в результате отложения солей кальция и магния. Устранить ее можно , пользуясь соляной кислотой. При этом нерастворимые соли кальция и магния превращаются в растворимые соли кальция и магния , углекислый газ и воду. Ответ : CaCO 3 + 2 HCl = CaCl 2 + H 2 O+CO 2 ; MgCO 3 + 2HCl = MgCl 2 +H 2 O +CO 2 . Составьте уравнения химических реакции , которые лежат в основе метода удаления накипи.
Почему ржавеет железо ? На воздухе железо легко окисляется в присутствии влаги (ржавление) с образованием гидроксида железа ( III)- основной части ржавчины. Ответ : 4 Fe + 3O 2 + 6 H 2 0 = 4 Fe(OH) 3 . Составьте уравнение окислительно-восстановительной реакции , в результате которой ржавеет железо.
Почему брусника может храниться долго в свежем виде без сахара ? Ягоды брусники могут длительное время храниться в свежем виде без сахара. Этому способствует наличие в них прекрасного консерванта –бензойной кислоты. Ответ : C 7 H 6 0 2 Установите молекулярную формулу бензойной кислоты , которая не дает ягодам испортиться , если массовые доли элементов в ней составляют: С-68 , 85 % , H-4,92%,O-26,23%,M R =122
Почему от красного перца горит во рту ? Красный острый перец , попадая на язык , вызывает «пожар»во рту из-за содержащегося в этой специи алкалоида капсаицина ( винилалаламид 8-метил-6-ноненовой кислоты) , стимулирующего чувствительную систему рецепторов тройничного нерва , которые находятся в обонятельном эпителии. Соприкасаясь со слизистой оболочкой , даже мельчайшие дозы капсаицина воздействуют на нервные окончания на языке , называемые С-волокна , реагирующие на температуру или механические химические раздражители. Сильное жжение уходит лишь когда капсаицин достигает пищевода , в котором находится гораздо меньше С-волокон. Ответ : C 18 H 27 0 3 N Установите молекулярную формулу капсаицина , который вызывает «пожар»во рту , если массовые доли элементов в нем составляют : С-70 ,8%,H-8,9%,O-15,7%,N-4,6%,Mr=305 .
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Презентация к уроку по химии на тему: Химический характер житейских ситуаций Викторина для учащихся 10-11 класса.
Викторина для учащихся 10-11 класса. Почему при открывании бутылки с лимонадом происходит бурное выделение газа? Почему лук «без боли и печали» доводит до слез? Почему в хлебе много дырочек? И другие интересные вопросы.
Просмотр содержимого документа
«Презентация к уроку по химии на тему: Химический характер житейских ситуаций Викторина для учащихся 10-11 класса.»
Химический характер житейских ситуаций
Почему при открывании бутылки с лимонадом происходит бурное выделение газа?
Растворимость газов увеличивается с увеличением давления. Углекислый газ растворяют в лимонаде под давлением, поэтому при открывании бутылки избыточный газ выделяется из раствора.
Составьте уравнение химической реакции, происходящей при открывании бутылки с газированной водой.
Ответ: H 2 CO 3 =CO 2 + H 2 O
Почему лук «без боли и печали» доводит до слез ?
Когда мы режем лук, происходит выделение летучего едкого вещества – тиопропиональдегид — S – оксида. Это соединение является лакриматором, именно оно вызывает слезы, когда мы режем сырой репчатый лук.
Установите молекулярную формулу тиопропиональдегид — S – оксида, если массовые доли элементов в нем составляют: C – 40,0%; H -6,6%; O – 17,8%; S=35,6%; Mr=90,14.
Ответ: C 3 H 6 OS ( CH 3 — CH 2 -CH=S=O)
Почему лук чистят, смачивая его или нож водой?
- Когда луковицу разрезают, лакриматор выделяется и растворяется в воде и слезах человека. Поэтому лук чистят, смачивая его или нож водой – лакриматор растворяется в воде и практически не выделяется в воздух. Если лук перед чисткой охладить, то активность лакриматора резко снижается.
Вычислите массовую долю углерода в лакриматоре.
Почему бобовые вызывают вздутие живота?
- Большинство растительных продуктов, содержащих крахмал, включая картофель, кукурузу, горох и пшеницу, усиливают газообразование в кишечнике. Микрофлора в норме расщепляет остатки пищи, которые попадают в толстый кишечник. При этом в кишечнике образуются газы – сероводород, углекислый газ.
Составьте уравнение химической реакции, являющейся причиной вздутия кишечника.
Ответ: ( C 6 H 10 O 5 ) n+6nO = 6n CO 2 + 5n H 2 O
Почему при приеме таблетки карбоната кальция у больного может возникнуть вздутие живота?
- Соду принимают при изжоге. Нежелательный побочный эффект – вздутие живота, что обусловлено образованием избытка CO 2 в кишечнике в результате взаимодействия карбоната кальция с соляной кислотой желудка.
Составьте уравнение реакции нейтрализации, которая является причиной вздутия живота.
Ответ: CaCO 3 +2HCl = CaCl 2 + H 2 O + CO 2
Почему потускневшие жемчужины давали склевать домашней птице?
- Известен способ реставрации жемчужин. Жемчуг на 86% состоит из карбоната кальция. Верхний потускневший или поцарапанный слой растворяется в соляной кислоте желудочного сока петуха или другой живности, открывается блестящий слой
Составьте уравнение химической реакции карбоната кальция с соляной кислотой.
Ответ: CaCO 3 +2HCl = CaCl 2 + H 2 CO 3
Почему йодированная соль всегда содержит тиосульфат натрия?
- Йодированная соль – обычная соль с добавлением йодида калия (25г на 1000кг). Йодид калия под действием влаги и света быстро разлагается, и свободный йод улетучивается из соли. Для увеличения стойкости йодида калия в качестве стабилизатора добавляется тиосульфат натрия (250г на 1000кг)
Составьте уравнение химической реакции йода с тиосульфатом натрия и образованием NaI и Na s S 4 O 6
Ответ: 2Na 2 S 2 O 3 + I 2 = 2 NaI + Na s S 4 O 6
Почему в хлебе много дырочек?
- При замешивании «пекарного порошка» с тестом начинает идти реакция образования углекислого газа CO 2 , причем пузырьки выделяющегося CO 2 задерживаются в тесте. В процессе выпечки эти пузырьки от нагревания расширяются и сообщают хлебу пористость.
Составьте уравнение реакции образования углекислого газа, которое соответствует образованию дырочек в хлебе.
Na H 2 PO 4 = Na 2 H PO 4 + CO 2 + H 2 O
Почему при выпечке печенья используют пищевую соду?
- При выпечке печенья в качестве разрыхлителя теста используют пищевую соду с добавкой уксусной кислоты. При нагревании эта смесь разлагается с выделением углекислого газа, что делает тесто пышным.
Составьте уравнение реакции соды с уксусной кислотой, которая является причиной пышности теста
Ответ: NaH CO 3 + CH 3 COOH = CH 4 COONa + CO 2 + H 2 O
Почему при выпечке хлеба добавляют сухие дрожжи?
- Сухие дрожжи – смесь солей гидрокарбоната аммония (NH 4 )HCO 3 , карбоната аммония (NH 4 ) 2 CO 3 и карбамата аммония (H 2 NCOO)NH 4 . Все эти соли при нагревании разлагаются с выделением NH 4 и CO 2 . Разлагаясь в тесте при выпечке хлеба, сухие дрожжи придают ему желаемую пористость.
Составьте уравнение реакций разложения солей с выделением указанных газов, придающих тесту необходимую пористость.
Ответ : (NH 4 )HCO 3 = NH 3 + H 2 O+ CO 2 , (NH 4 ) 2 CO 3 = 2NH 3 + H 2 O +CO 2 , (H 2 NCOO)NH 4 = 2NH 3 + CO 2
Почему именно свежий хлеб пахнет ?
- В свежем хлебе еще присутствуют молекулы пахучих веществ-гетероциклических альдегидов , в частности фурфурола , имеющего запах свежего ржаного хлеба
Установите молекулярную формулу фурфурола,если массовые доли элементов в нем составляют: С-62,5% ; H-4,2% ; O-33,3 % ;М R =96 Г/моль
Ответ : С 5 H 4 O 2
Почему ржаной хлеб черствеет медленнее , чем белый ?
- Черствение хлеба при хранении связано со «старением» крахмала. Ржаной крахмал (С 6 H 10 O 5 ) n
связывает почти вдвое больше воды , чем пшеничный , поэтому хлеб из ржаной муки черствеет медленнее
Составьте уравнение химической реакции образования крахмала из глюкозы
Ответ : nC6 H12 O6 = (C6 H10 O5)n + nH2O .)
Почему встречаются огурцы-»уродцы» ?
- В конце лета на грядках встречаются огурцы-»уродцы». Огурцы , похожие на скрюченные перцы , вырастают на грядках , когда растениям не хватает азота , а плоды , напоминающие грушу- если не хватает калия. Это объясняется тем , что к концу лета содержание необходимых для роста элементов в почве значительно уменьшается.
Пополнять содержание азота в почве следует путем внесения удобрений. Составьте химические формулы веществ, используемых в качестве минеральных удобрений.
Ответ : NH 4 NO 3 , NаNO 3 , KNO 3 , C A (NO 3 ) 2 .
Почему летом лучше поить кур и обычной и газированной водой ?
- У кур , в отличие от млекопитающих , нет потовых желез , поэтому в жаркую погоду теплообмен регулируется за счет повышения интенсивности дыхания , при этом из организма выделяется больше углекислого газа , чем в прохладную погоду.Содержание углекислого газа в крови снижается , а это сказывается на прочности скорлупы яиц ( CaCO3 ).Поение кур газированной водой позволяет повысить содержание углекислого газа в организме птиц , увеличить выработку карбоната кальция и повлиять на прочность скорлупы
Составьте уравнение химической реакции, которая может повысить прочность скорлупы
Ответ : Ca 2+ + H 2 O + СO 2 = CaCO 3 + 2H + .
Почему для выведения пятна от йода используется сульфит натрия Na 2 SO 3 ?
- Способ выведения пятен от йода основан на окислительно-восстановительной реакции взаимодействия его с Na 2 S0 3 .
Составьте уравнение окислительно-восстановительной реакции, которая лежит в основе способа выведения пятен от йода.
Ответ : I 2 + Na 2 SO 3 + 2NaOH= 2NaI + Na 2 SO 4 + H 2 0
Почему зимой все время хочется спать ?
- Холодный зимний воздух более разрежен , в нем содержится меньше кислорода , чем требуется для активности нашему организму. Кровь становится более густой , кровоток -более медленным , увеличивается нагрузка на сердце и сосуды. Отсюда- усталость , головные боли , зевота (она является характерным признаком гипоксии (недостатка кислорода) тканей мозга.
Больному с затрудненным дыханием предлагают сделать несколько вдохов из кислородной подушки. Во сколько раз примерно это облегчает его дыхание?
Ответ : Примерно в 5 раз.
Почему для удаления накипи используется уксус ?
- Накипь в чайнике образуется в результате отложения солей кальция и магния. Устранить ее можно , пользуясь уксусной кислотой. При этом нерастворимые соли кальция и магния превращаются в растворимые соли кальция и магния , углекислый газ и воду.
Составьте уравнения химических реакции, которые лежат в основе метода удаления накипи уксусом.
Ответ : CaCO 3 +2CH 3 COOH= (CH 3 COO) 2 Ca +H 2 O+ CO 2 ; МgCO 3 + 2CH 3 COOH = (CH 3 COO ) 2 MG +H 2 O +CO 2 .
Почему для удаления накипи используют соляную кислоту ?
- Накипь в чайнике образуется в результате отложения солей кальция и магния. Устранить ее можно , пользуясь соляной кислотой. При этом нерастворимые соли кальция и магния превращаются в растворимые соли кальция и магния , углекислый газ и воду.
Составьте уравнения химических реакции, которые лежат в основе метода удаления накипи.
Ответ : CaCO 3 + 2HCl = CaCl 2 + H 2 O+CO 2 ;
MgCO 3 + 2HCl = MgCl 2 +H 2 O +CO 2 .
Почему ржавеет железо?
- На воздухе железо легко окисляется в присутствии влаги (ржавление) с образованием гидроксида железа (III)-основной части ржавчины.
Составьте уравнение окислительно-восстановительной реакции,в результате которой ржавеет железо.
Ответ : 4 Fe + 3O 2 + 6 H 2 0 = 4 Fe(OH) 3 .
Почему брусника может храниться долго в свежем виде без сахара?
- Ягоды брусники могут длительное время храниться в свежем виде без сахара. Этому способствует наличие в них прекрасного консерванта –бензойной кислоты.
Установите молекулярную формулу бензойной кислоты, которая не дает ягодам испортиться, если массовые доли элементов в ней составляют: С-68,85 %,H-4,92%,O-26,23%,M R =122
Ответ : C 7 H 6 0 2
Почему от красного перца горит во рту?
- Красный острый перец,попадая на язык,вызывает «пожар»во рту из-за содержащегося в этой специи алкалоида капсаицина (винилалаламид 8-метил-6-ноненовой кислоты),стимулирующего чувствительную систему рецепторов тройничного нерва,которые находятся в обонятельном эпителии. Соприкасаясь со слизистой оболочкой,даже мельчайшие дозы капсаицина воздействуют на нервные окончания на языке,называемые С-волокна,реагирующие на температуру или механические химические раздражители. Сильное жжение уходит лишь когда капсаицин достигает пищевода, в котором находится гораздо меньше С-волокон.
Установите молекулярную формулу капсаицина, который вызывает «пожар»во рту, если массовые доли элементов в нем составляют : С-70,8%,H-8,9%,O-15,7%,N-4,6%,Mr=305 .
📽️ Видео
Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Как ПРОЩЕ решать Уравнения Реакции? #shorts #youtubeshortsСкачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

ЧТО ТАКОЕ уравнение химической реакции? Все намного проще чем ты думал! #shorts #yotubeshortsСкачать

Как НА САМОМ ДЕЛЕ проходит уравнение реакции? #shorts #youtubeshortsСкачать

Как расставлять Коэффициенты в Химии? #shorts #youtubeshortsСкачать

Обратимость и необратимость химических реакций. Химическое равновесие. 1 часть. 9 класс.Скачать

КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Типы химических реакций #химия #химическиереакции #химияогэ #репетитор #репетиторпохимииСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Химические уравнения. Урок 15. Химия 7 классСкачать

ХИМИЧЕСКИЕ УРАВНЕНИЯ - Топ 5 Ошибок в уравнениях химических реакций // Подготовка к ЕГЭ по ХимииСкачать