Кислота и щелочь в растворе обмениваются ионами и взаимно нейтрализуют друг друга. В стакане раствор щелочи — гидроксида натрия. Индикатор фенолфталеин поможет следить за ходом реакции – добавим его к раствору гидроксида натрия. В щелочной среде фенолфталеин ‑ малиновый. Приливаем разбавленную соляную кислоту. Фенолфталеин обесцветился — среда стала нейтральной. Кислота содержат катионы водорода, а щелочь – гидроксид-ионы, которые объединяются в нейтральную малодиссоциированную молекулу воды.
В стакане образовался водный раствор поваренной соли — реакция нейтрализации завершилась.
Оборудование: химический стакан.
Техника безопасности . Следует соблюдать правила работы с растворами кислот и щелочей. Избегать попадания кислот и щелочей на кожу и слизистые оболочки.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
- Кислоты и щёлочи
- Что такое кислота
- Что такое щелочь?
- Кислоты и щёлочи – отличия
- pH продуктов
- Сильные кислоты и слабые кислоты
- Примеры сильных кислот
- Примеры слабых кислот
- Показатель кислотности растворов рН, механизм действия
- Работа с кислотами и щёлочами
- Реакция гидроксида натрия с соляной кислотой
- Гидроксид натрия
- Соляная кислота
- Определение вида химической реакции соляной кислоты с гидроксидом натрия.
- 📸 Видео
Видео:Соляная кислота. Свойства и особенности. То чего вы не знали.Скачать

Кислоты и щёлочи

И получается такое вещество, которое не относится ни к кислотам, ни к щелочам. Оно не способно вызывать ожоги. Но это будет только при правильной пропорции кислоты и щёлочи (иногда для верности пользуются фенолфталеином, он окрашивает щёлочь в слегка фиолетовый цвет).
Кислота и щёлочи — это как две противоположности. Но они очень важны при изготовлении таких вещей как: удобрения, пластик, мыла, моющие средства, красок, бумаги и даже взрывчаток. Это далеко не весь список.
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Что такое кислота
Кислота — это и есть что-то кислое, оно характеризуется кислым вкусом. Кислота содержится в уксусе – уксусная кислота, в лимоне – лимонная кислота, в молоке – молочная кислота, в желудке – соляная кислота и т.п. Но это всё так называемые слабые кислоты, помимо них существуют кислоты с большей концентрацией (серная, синильная кислоты и т.д. хотя этот учёный пробовал). Они гораздо опаснее для человека и пробовать их не рекомендуется никому. Они способны разъесть одежду, кожу, вызвать тяжёлый ожог на коже, разъесть бетон и другие вещества. Например, соляная кислота нам нужна для того, чтобы желудок быстрее переваривал пищу, а также для уничтожения большинства вредных бактерий, которые приходят вместе с пищей.
Видео:СОЛИ ХИМИЯ 8 КЛАСС: Химические Свойства Солей и Получение // Реакция Солей с Кислотами и МеталламиСкачать

Что такое щелочь?
Щелочь — это те вещества, которые хорошо растворяются в воде. При этом реакция сопровождается с выделением тепла, с увеличением температуры. Если щёлочь сравнивать с кислотой, то на ощупь она намного «мыльнее», то есть скользкая. Вообще, щёлочи не сильно отстают от кислот по разъеданию и по силе. Они также могут с лёгкостью разъесть древесину, пластик, одежду и тому подобное.
Кстати, из щёлочей делают мыло, стекло, бумагу, ткань и это не весь список. Щёлочь можно найти у себя на кухне, ну или в магазине под названием пищевая сода. Кстати, пищевая сода это очень хороший помощник всем домохозяйкам.
Видео:Серная кислота и ее соли. 9 класс.Скачать

Кислоты и щёлочи – отличия
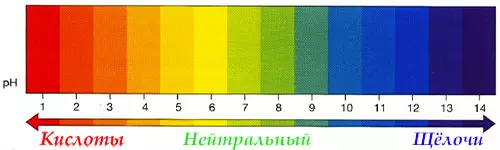
Кислоты и щёлочи отличают по показателям pH (шкала pH). Ниже Вы видите картинку – это специальная шкала, на которой имеются числа от 0 и до 14. Нулём обозначают самые сильные кислоты, а четырнадцатью – самую сильную щёлочь. Но какая же середина между этими числами? Может быть 5, может быть 7, а может быть 10? Серединой принято считать число 7 (нейтральное положение). То есть числа до 7 — это все кислоты, а больше 7 — это щёлочи.
Видео:8 класс. Составление уравнений химических реакций.Скачать

pH продуктов
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Сильные кислоты и слабые кислоты
Есть некоторые кислоты, которые мы можем употреблять, в то время как работа с другими предполагает строгие меры безопасности.
Сильные кислоты — это те, которые полностью диссоциируют или ионизируются в водных растворах.
Один из способов визуализировать, как отличить слабые и сильные кислоты, по аналогии с игроками в регби:
- сильная кислота является игроком, который бросает мяч, как только он его получает;
- слабая кислота, как игрок , который получает мяч и бежит с ним.
Примеры сильных кислот
Среди известных сильных кислот выделяют:
- HCl соляная кислота,
- серная кислота H 2 SO 4 ,
- азотная кислота HNO 3
- хлорная кислота HClO 4
- фторантимоновая кислота H [SbF 6 ]
Примеры слабых кислот
Обычно кислоты органических соединений известны как слабые:
- уксусная кислота H 3 CCOOH,
- масляная или бутановая кислота H 7 C 3 COOH (органическая кислота в масле),
- лимонная кислота или 2-гидрокси кислота 1,2,3-трикарбоксилпропан C 6 H 8 O 7,
- молочная кислота или 2-гидроксипропановая кислота H 6 C 3 O 3 .
Видео:Хлороводородная кислота. 9 класс.Скачать

Показатель кислотности растворов рН, механизм действия
Именно для этой шкалы разработаны специальные индикаторы — лакмусы. Это обычная полоска, которая реагирует на среду. В кислотной среде она окрашивается в красный цвет, а в щелочной среде – в синий цвет. Она необходима не только в химии, но и в быту.
Например, если у Вас есть аквариум, то немаловажную роль играет кислотность воды. От неё зависит вся жизнь аквариума. К примеру, показатель кислотности воды для аквариумных рыбок колеблется от 5 до 9 рН. Если будет больше или меньше, то рыбка будет чувствовать себя не комфортно, а может и вовсе умереть. Всё тоже самое и с растениями для аквариумов.
Работа с кислотами и щёлочами
Работа с кислотами и щёлочами требует большой внимательности и осторожности. Ведь при попадании на кожу они вызывают сильные ожоги. Старайтесь работать в проветриваемом помещении. Вдыхать пары щёлочей и кислот также не рекомендуется. Для личной безопасности стоит воспользоваться очками, перчатками и специальной одеждой, чтобы не повредить глаза, руки и любимую одёжку.
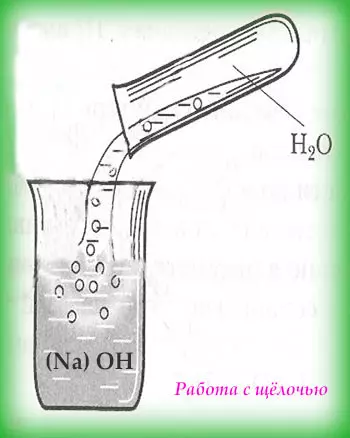
При работе с кислотами следует помнить, что сначала вливают кислоту в раствор (воду), а не наоборот. В противном случае произойдёт бурная реакция, которая сопровождается брызгами. А сам процесс добавления кислоты в раствор следует делать очень медленно, при этом контролировать степень нагрева сосуда и обязательно добавлять кислоту по стенкам сосуда.
При работе со щёлочами первым следует добавлять понемногу щёлочь. К тому же запрещено пользоваться стеклянной посудой, рекомендуют фарфоровую или специальную посуду.
При химической обработке металлов (оксидирование, анодирование, травление и др.) погружать в раствор и вынимать из раствора изделие следует с помощью специальных приспособлений или инструментов, но никак не руками, даже если они в резиновых перчатках. Кстати, щёлочь входит в состав некоторых батареек.
Запомните, что при химических ожогах кожи поражённое место нужно промыть сильной струёй проточной воды. И окончательно нейтрализовать: от кислот — 3%-ным раствором питьевой соды, а щёлочь — 1%-ным раствором уксусной кислоты.
Видео:Химия 9 класс (Урок№10 - Галогены. Хлор. Хлороводород. Соляная кислота и её соли.)Скачать

Реакция гидроксида натрия с соляной кислотой
Повесть о Ромео и Джульетте со счастливым финалом
Ни на одной карте мира вы не найдете страны под названием Химия. Но она существует, и жизнь в ней протекает не менее насыщенно (а иногда и более интересно), чем в любой другой стране. К примеру, самая известная история любви всех веков и народов там заканчивается очень счастливо. Но давайте по порядку, ведь нам предстоит очень многое: познакомиться с химическими Монтекки и Капулетти, выбрать лучшего свидетеля реакции гидроксида натрия и соляной кислоты, слетать в космос, посетить самый лучший ресторан мира, заглянуть на концерт ансамбля песни и пляски Черноморского флота и многое другое.
Для начала заглянем в химическую лабораторию.
Если здесь чтут технику безопасности, то щелочи и их растворы хранятся строго отдельно от кислот и их растворов. Это химические Монтекки и Капулетти: оба семейства агрессивны и находятся в непримиримой вражде. Если они столкнутся без присмотра Химика, жди беды! Да и ученого они не жалуют: так и норовят обжечь или отравить. Поэтому при общении с ними Химик защищается как может: работает в вытяжном шкафу, надевает халат, фартук, перчатки, спецобувь и даже очки или защитный щиток.
И надо же такому случиться, чтобы прекрасный юноша Гидроксид натрия из рода Щелочей влюбился в обворожительную девушку по имени Соляная Кислота из семейства Кислот! Чтобы понять полноту трагедии, давайте поближе познакомимся и узнаем характеры гидроксида натрия и соляной кислоты.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Гидроксид натрия
Химическая формула — NaOH. Является одной из самых распространенных щелочей, известен также как каустическая сода.
Физические свойства
Твердый белый или чуть желтоватый порошок. Гигроскопичен, разъедает многие материалы и органические вещества: бумагу, кожу и даже некоторые металлы, растворяется в воде, этиловом и метиловом спиртах.
Химические свойства
Это сильное химическое основание, взаимодействует с:
- кислотами;
- амфотерными оксидами;
- амфотерными гидроксидами;
- солями в растворе;
- неметаллами;
- галогенами;
- металлами;
- эфирами, амидами и алкилгалогенидами;
- многоатомными спиртами.
Области применения
Гидроксид натрия используется в самых различных отраслях:
- в химической промышленности;
- при нефтепереработке;
- в целлюлозно-бумажной промышленности;
- для устранения засора в трубах;
- в гражданской обороне (нейтрализующее вещество);
- в пищевой промышленности: для очистки овощей и фруктов от корочки; в производстве шоколада и какао; для размягчения маслин и окрашивания их в темный цвет;
- в косметологии (для удаления ороговевших участков кожи);
- в быту.
Теперь познакомимся поближе с соляной кислотой.
Видео:Решаем жгучий ПРОБНИК ЕГЭ ПО ХИМИИ 2024Скачать

Соляная кислота
Химическая формула — HCl. Сильная минеральная одноосновная бескислородная кислота.
Физические свойства
Бесцветная прозрачная едкая жидкость, дымящаяся на воздухе. Максимальная концентрация при 200 °С равна 38%, плотность такого раствора — 1,19 г/см³. Если высококонцентрированная кислота вызывает сильные ожоги кожи, слизистых оболочек и глаз, а вот в концентрации около 0,5 % она присутствует в желудке человека.
Химические свойства
Это сильная кислота, взаимодействует с:
• металлами; • гидроксидами металлов; • оксидами металлов; • солями металлов; • сильными окислителями; • аммиаком.
Качественная реакция на соляную кислоту и ее соли – взаимодействие с нитратом серебра.
Область применения
Соляная кислота используется в:
- в гидрометаллургии и гальванопластике;
- в химической промышленности;
- в пищевой промышленности (пищевая добавка Е507);
- в медицине (при пониженной кислотности в желудке).
И вот решил Химик подружить два непримиримых рода и повенчать влюбленных: сделать всё, чтоб состоялась реакция гидроксида натрия с соляной кислотой. В свидетели с невестой-кислотой пошел индикатор Фенолфталеин. Как только сбудется реакция с гидроксидом, бесцветный индикатор от радости станет малиновым. Несмотря на то что агрессивными были гидроксид натрия и соляная кислота, какая реакция получилась хорошая!
Напишем уравнение этой реакции:
HCl + NaOH = NaCl + H₂O + Q
Соляная кислота и гидроксид натрия> взаимодействуют, в результате чего образуются соль и вода и выделяется тепло.
Как видим, в результате взаимодействия двух агрессивнейших соединений получилась поваренная соль и вода — безобиднейшие и даже полезные для человека соединения. Примирились-таки два враждующих рода и перестали быть злыми и опасными.
А чтобы оценить по достоинству продукты реакции, давайте сядем в ракету и устремимся в космос. Взгляните на нашу Землю со стороны. Не зря ее называют голубой планетой, ведь 71% ее поверхности занимают моря и океаны, то есть вода, один из продуктов нашей реакции. Хотя отметим, справедливости ради, что только 1% от этого количества пригоден к употреблению.
А теперь заглянем в самый лучший ресторан, какой — вы решите сами. Не ограничивайте себя в фантазиях, ведь в пределах нашей истории возможно всё! Давайте пройдем на кухню и спросим шеф-повара, без каких двух продуктов он не смог бы обойтись. И поверьте, он назовет не икру, трюфели или пармезан — он выберет соль и воду, поскольку без этих простых компонентов не приготовишь ни одно блюдо.
Наши продукты реакции входят в состав соединения, которое вы найдете и дома в супе или рассоле, и в морской воде. Об этом соединении поет ансамбль песни и пляски Черноморского флота «Эх! Соленая вода, ветер на просторе, полюбили навсегда голубое море!» А теперь присмотримся повнимательней и определим, какая же это реакция гидроксида натрия и соляной кислоты с точки зрения классификации химических реакций.
Видео:Реакция нейтрализации. Урок 26. Химия 7 класс.Скачать

Определение вида химической реакции соляной кислоты с гидроксидом натрия.
1. По числу и состоянию исходных и образующихся веществ, это реакция обмена.
Другими словами, количество веществ, вступивших в реакцию, равно количеству веществ, получившихся в результате. Просто произошел обмен ионами. Чтобы увидеть это, напишем уравнение реакции в ионном виде:
H⁺ + Cl⁻ + Na⁺ + OH⁻ = Na⁺+Cl⁻ + H₂O
Следуя сюжету нашей повести, жених с невестой обменялись своим личным имуществом: бери, мол, мне для тебя ничего не жалко. Узнать больше об их «приданном» вы можете здесь.
2. По типу взаимодействующих веществ, это реакция нейтрализации:
3. По агрегатному состоянию веществ, эта реакция является гомогенной.
Вещества, вступающие в реакцию, находятся в одинаковом агрегатном состоянии — в растворе.
4. По направлению протекания реакции, она необратимая.
Реакция протекает до конца, то есть до полного расхода реагирующих веществ.
5. По тепловому эффекту — экзотермическая. Другими словами, церемония венчания прошла в теплой атмосфере. Реакция сопровождается тепловым эффектом, выделяется 57,3 кДж тепловой энергии.
6. Реакция не является окислительно-восстановительной: степени окисления атомов в ходе реакции не изменились.
H⁺Cl⁻ + Na⁺O₂⁻H⁺ = Na⁺Cl⁻ + H₂⁺ O₂⁻
Подведем итоги. У нашей любовной истории счастливый финал: любящие сердца из двух непримиримых семейств воссоединились.
Взаимодействовали агрессивные гидроксид натрия, соляная кислота, реакция же в результате дала нам очень полезные продукты, воспетые в искусстве.
Какая всё-таки замечательная наука − химия. Благодаря реакции кислоты со щелочью мы смогли изменить финал самой печальной трагедии и превратить ее в счастливый роман!
📸 Видео
Опыты по химии. Соляная кислота и металлыСкачать

ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Химия 9 класс (Урок№13 - Оксид серы (VI). Серная кислота и ее соли.)Скачать

Практическая работа №5. Разбавленная серная кислота и её соли. 9 класс.Скачать

ХЛОРОВОДОРОД | Соляная кислота | Химия 9 классСкачать

Опыты по химии. Реакция нейтрализацииСкачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать