В этой статьи мы рассмотрим вопросы химического взаимодействия серебра с различными кислотами. Содержание статьи является информативным, мы не рекомендуем производить химические реакции в домашних условиях, это может быть опасным.
- Как взаимодействуют кислоты с серебром?
- Взаимодействие серебра с соляной кислотой
- Взаимодействие серебра с серной кислотой
- Взаимодействие серебра с азотной кислотой
- Другие химические реакции серебра и кислот
- Хлорид серебра I
- Содержание
- Молекулярная и кристаллическая структура
- Физические свойства
- Получение
- Химические свойства
- Применение
- Безопасность
- Свойства серебра, его взаимодействие с соляной кислотой
- Происхождение элемента
- Физические и химические свойства серебра
- Растворение серебра в соляной кислоте
- 💡 Видео
Видео:СОЛЯНАЯ КИСЛОТА | HCl | Химические свойства СОЛЯНОЙ КИСЛОТЫ | Хлороводород | Нитрат серебра | ХимияСкачать

Как взаимодействуют кислоты с серебром?
Серебро – химически малоактивно, поэтому его относят к семейству благородных металлов. В воздухе серебро (как химическое вещество) практически не окисляется, с водой не взаимодействует, является инертным металлом. Серебро в обычных условиях слабо взаимодействует с различными кислотами. Объясняется это тем фактом, что в электрохимическом ряду оно стоит после водорода. Серебро не вступает в химическую реакцию с соляной и разбавленной серной кислотой.
Серебро окисляется в реакции с горячей концентрированной серной кислотой и соляной кислотой в присутствии свободного кислорода. Серебро может вступать в химическую реакцию с кислотами, которые проявляют свойства окислителей, то есть содержать кислород.
Свойства серебра слабого взаимодействия с кислотами активно используется при производстве:
- серебряной посуды,
- серебряных ложек и вилок,
- серебряных ювелирных изделий,
- серебряных монет, наград и значков.
Серебро устойчиво к действию многих холодных и горячих кислот, щелочах и растворах солей, а также в ряде органических соединений. Холодная соляная кислота медленно действует на серебро благодаря образованию нерастворимой пленки из хлорида серебра.
В этой статье мы рассмотрим следующие химические реакции:
- реакция серебра и соляной кислоты;
- реакция серебра и серной кислоты;
- реакция серебра и азотной кислоты.
Видео:Качественная реакция ионов серебра с соляной кислотойСкачать

Взаимодействие серебра с соляной кислотой
Серебро не растворяется в соляной кислоте из-за появления тонкого слоя хлорида серебра. При условии добавления к раствору свободного кислорода в виде перекиси водорода реакция приведет к окислению серебра в хлорид серебра.
Видео:Соляная кислота. Свойства и особенности. То чего вы не знали.Скачать

Взаимодействие серебра с серной кислотой
Серебро реагирует с концентрированными растворами серной кислоты с образованием соли.
Разбавленная серная кислота при комнатной температуре не взаимодействует с серебром, концентрированная кислота — взаимодействует.
Видео:Химия 9 класс (Урок№10 - Галогены. Хлор. Хлороводород. Соляная кислота и её соли.)Скачать

Взаимодействие серебра с азотной кислотой
Серебро реагирует с концентрированными растворами азотной кислот с образованием соли.
Химическая реакция — — > Ag +2HNO3 = AgNO3 + NO2 + H2O.
Химическая реакция — — > 3Ag + 4HNO3 = 3AgNO3 + NO + 2H2O.
Азотная кислота растворяет серебро при различных температурах и концентрациях, а царская водка образует на его поверхности нерастворимую пленку из хлорида серебра.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Другие химические реакции серебра и кислот
Уксусная кислота не действует на серебро при низкой и высокой температурах, но при добавлении в нее небольшого количества соляной кислоты начинается растворение серебра.
Серебро не вступает во взаимодействие с фосфорной кислотой любой концентрации.
Авторские ювелирные брелоки по выгодной цене
Видео:СОЛЯНАЯ КИСЛОТА ИЗ ВОДЫ И СОЛИ! ПРОЩЕ НЕ ПРИДУМАТЬ...Скачать

Хлорид серебра I
| Хлорид серебра I | ||
|---|---|---|
| ||
| Систематическое наименование | Хлорид серебра I | |
| Традиционные названия | Хлорид серебра | |
| Хим. формула | AgCl | |
| Рац. формула | AgCl | |
| Состояние | твёрдое | |
| Молярная масса | 143,32 г/моль | |
| Плотность | 5,56 | |
| Твёрдость | 2,5 | |
| Температура | ||
| • плавления | 455 | |
| • кипения | 1554 °C | |
| Мол. теплоёмк. | 50,79 Дж/(моль·К) | |
| Энтальпия | ||
| • образования | −127 кДж/моль | |
| Удельная теплота испарения | 1,28⋅10 6 | |
| Удельная теплота плавления | 9,2⋅10 4 | |
| Давление пара | 1 Па , 10 Па , 100 Па , 1 кПа , 10 кПа и 100 кПа | |
| Растворимость | ||
| • в воде | 1,91⋅10 −5 г/100 мл | |
| • в этаноле | 1,5·10 −5 г/л | |
| • в метаноле | 6·10 −5 г/л | |
| • в ацетоне | 1,3·10 −5 г/л | |
| • в пиридине | 19,5 г/л | |
| Показатель преломления | 2,071 | |
| Дипольный момент | 6,08 ± 0,06 Д | |
| Рег. номер CAS | 7783-90-6 | |
| PubChem | 24561 | |
| Рег. номер EINECS | 232-033-3 | |
| SMILES | ||
| RTECS | VW3563000 | |
| ChEBI | 30341 | |
| ChemSpider | 22967 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
Хлорид серебра I (хлористое серебро) — AgCl, неорганическое бинарное соединение серебра с хлором, серебряная соль хлороводородной (соляной) кислоты. В нормальных условиях представляет собой белый порошок или бесцветные кристаллы. Встречается в природе в виде минерала хлораргирита.
Видео:Как сделать соляную кислоту. Самый простой способ.Скачать

Содержание
- 1 Молекулярная и кристаллическая структура
- 2 Физические свойства
- 3 Получение
- 4 Химические свойства
- 5 Применение
- 6 Безопасность
Видео:Опыты по химии. Соляная кислота и металлыСкачать

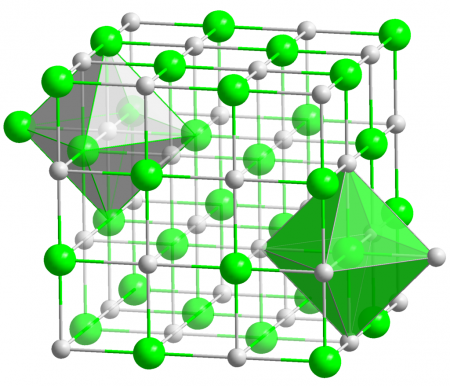
Молекулярная и кристаллическая структура
Хлорид серебра имеет следующий элементный состав: Ag (75,26 %), Cl (24,74 %). Атом серебра в молекуле находится в состоянии sp 3 d 2 -гибридизации. Энергия разрыва связи в соединении (Есв.): 313 кДж/моль, длина связи Ag—Cl: 0,228 нм.
Кристаллы AgCl принадлежат к кубической сингонии, структура типа NaCl, пространственная группа Fm3m, параметры элементарной ячейки a = 0,5549 нм, Z = 4. Центральный атом образует с соседями октаэдр, координационное число равно 6.
В газовой фазе хлорид серебра существует в форме мономера, димера и тримера.
Видео:Реакция НИТРАТА СЕРЕБРА и СОЛЯНОЙ КИСЛОТЫ. Химические опыты дома. Эксперимент. Chemistry experienceСкачать

Физические свойства
Хлорид серебра — белое или бесцветное вещество, плавящееся и кипящее без разложения. В расплавленном состоянии имеет жёлто-коричневый цвет. Застывая, расплав образует полупрозрачную массу, называемую в обиходе «роговое серебро».
Хлорид серебра чрезвычайно мало растворим в воде: при 25 °C произведение растворимости (ПР) составляет 1,77⋅10 −10 . С повышением температуры растворимость соединения повышается: при 100 °C ПР = 2,81⋅10 −8 . Нерастворим в минеральных кислотах, этиловом и метиловом спирте, ацетоне. Растворим в водных растворах аммиака, цианидов, роданидов и тиосульфатов щелочных металлов; пиридине и жидком аммиаке. Из-за образования комплексных соединений хлорид серебра заметно растворим в концентрированной соляной кислоте и растворах хлоридов.
- стандартная энтальпия образования, ΔH°298: −127 кДж/моль;
- стандартная энтропия, S°298: 96 Дж/(моль·K);
- стандартная энергия Гиббса, ΔG°298: −110 кДж/моль.
- стандартная мольная теплоемкость, Cp°298: 50,79 Дж/(моль·K);
- энтальпия плавления, ΔHпл: 13,2 кДж/моль;
- энтальпия кипения, ΔHкип: 184 кДж/моль.
Зависимость давления насыщенного пара (P, в барах) для соединения в диапазоне температур (T) от 1185 до 1837 K выражается следующим уравнением:
log10 P = 4,95155 − 8775,980/T−62,718
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Получение
Хлорид серебра образуется в виде белого осадка при взаимодействии растворимых солей серебра, обычно — нитрата, с хлоридами (данная реакция является качественной на хлорид-анионы):
Видео:Получение хлороводорода и соляной кислотыСкачать

Химические свойства
- Разлагается при комнатной температуре под действием света:
2 AgCl = 2 Ag + Cl2
- Образует с гидратом аммиака, тиосульфатами и цианидами щелочных металлов растворимые комплексные соединения:
AgCl + 2 NH3 ⋅ H2O = [Ag(NH3)2]Cl + 2 H2O AgCl + 2 Na2SO3S = Na3[Ag(SO3S)2] + NaCl AgCl + 2 KCN = K[Ag(CN)2] + KCl
- Вступает в окислительно-восстановительные реакции, восстанавливаясь до металлического серебра:
4 AgCl + 2 BaO → >324oC 2 BaCl2 + 4 Ag + O2 2 AgCl + Zn = ZnCl2 + 2 Ag ↓ 2 AgCl + 2 KOH + H2O2 = 2 KCl + 2 Ag ↓ + O2 ↑ + 2 H2O Окислительные свойства хлорида серебра используется для извлечения металла из серебросодержащих отходов: 4 AgCl + 2 Na2CO3 → 850−900oC 4 NaCl + 4 Ag + 2 CO2 + O2 4 AgCl + CH2O + 6 NaOH = 4 Ag ↓ + Na2CO3 + 4 NaCl + 4 H2O
- Растворяется в концентрированных растворах хлоридов и соляной кислоты, образуя комплексы:
AgCl + Cl − = [AgCl2] −
- Медленно реагирует с концентрированной серной кислотой при кипячении:
2 AgCl + H2SO4 = Ag2SO4 + 2 HCl ↑
- В растворах жидкого аммиака из-за растворимости в нём соли можно провести обменные реакции, недоступные в водных растворах:
2 AgCl + Ba(NO3)2 → NH 3 BaCl2 ↓ + 2 AgNO3
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Применение
- Светочувствительный компонент фотографических эмульсий различных фотографических материалов;
- Компонент электродов химических источников тока на основе систем Ag/AgCl/Cl − ;
- Компонент электропроводящих стёкол;
- Материал для линз в ИК-спектроскопии;
- Промежуточный продукт, образующийся при извлечении серебра из сульфидной руды:
Ag2S + 2 NaCl + 2 O2 → 600∘C 2 AgCl + Na2SO4
- Реагент для получения сереброорганических соединений:
AgCl + R−MgBr = R−Ag + MgBrCl
- Входит в состав антимикробных композиций на основе ионов серебра.
Видео:AgNO3 + HCl → AgCl + HNO3 | Реакция нитрата серебра(I) и хлороводородаСкачать

Безопасность
Соединение может вызвать раздражающий эффект при контакте с кожей и слизистыми оболочками.
Видео:Хлороводородная кислота. 9 класс.Скачать

Свойства серебра, его взаимодействие с соляной кислотой
В Древнем Египте этот металл был ценнее золота
Серебро — это металл, расположенный в первой группе периодической системы Менделеева. Атомный номер химического элемента — 47, атомная масса — 107,8682. Металл состоит из двух изотопов — ¹⁰⁷Ag и ¹⁰⁹Ag. Ученые открыли более 35-ти радиоактивных изомеров и изотопов серебра, массовые числа которых составляют от 99 до 123.
Видео:Неметаллы. Тема 11. Хлороводород. Соляная кислота. ХлоридыСкачать

Происхождение элемента
Серебро знакомо человечеству с давних времен, и назвать точную дату открытия металла сложно. Многие письменные источники подтверждают, что серебряные украшения изготавливались в древнем Египте, когда серебро было более редким металлом, чем золото, и ценилось значительно больше.
Первые рудники, на которых добывали серебро, были основаны финикийцами до нашей эры. В Европе также велись разработки драгоценного металла, который использовался преимущественно для изготовления ювелирных украшений.
Люди неспроста так высоко ценили серебро. В то время людям был знаком только самородный металл, поиск и добыча которого были очень сложными. Разработке элемента мешал сульфид, который темным налетом покрывал серебряные самородки. Поворотной вехой в истории добычи серебра стали проводимые средневековыми алхимиками эксперименты. Цель проводимых опытов была одна — получение золота из любого другого металла. Именно благодаря алхимикам европейцы научились извлекать серебро из соединений металла с другими химическими элементами (хлором, мышьяком и т.д.).
Значительную роль в истории получения серебра сыграли Шееле, Парацельс и другие древние ученые. Они подтвердили факт, что серебро обладает дезинфицирующими свойствами, обнаруженными в древности. Еще врачеватели Египта использовали пластины из этого драгоценного металла для обработки язв: бактерицидные свойства серебра не позволяли ранам гноиться.
Уникальные качества драгоценного металла оценила аристократия, использовавшая дорогостоящее столовое серебро. К тому времени удалось усовершенствовать способы добычи металла, что привело к его удешевлению. Серебро стали применять в качестве расчетного средства, изготавливая из него монеты. Серебру обязаны названием государственной денежной единицы россияне: для расчетов использовали серебряные слитки, отрубая от них нужную часть. Так в обиходе появилось слово «рубль».
Видео:Химические свойства соляной кислотыСкачать

Физические и химические свойства серебра
Серебро — мягкий и пластичный металл, из одного грамма которого вытягивается тончайшая проволочка длиной до двух километров. Серебро — тяжелый металл с плотностью в 10,5 грамма на 1 кубический сантиметр. Хороший электро- и теплопроводник (поэтому серебряная ложка быстро нагревается в стакане горячей воды). Серебро имеет температуру плавления 962 °С, легко сплавляется с другими металлами, что изменяет характеристики элемента. Например, медь увеличивает твердость серебра и делает элемент пригодным для изготовления разных предметов.
Серебряные предметы со временем тускнеют и чернеют из-за воздействия на металл сероводорода. Это вещество выделяется резиной и некоторыми полимерами.
Химическая реакция серебра с сероводородом протекает в условиях влажности. При этом на серебряных предметах образуется тонкая сульфидная пленка, которая постепенно утолщается. Она меняет цвет на коричневый, темнеет и становится черной. Сульфид серебра не разрушается при сильном нагреве, не растворяется в щелочах и кислотах. Тонкую сульфидную пленку можно удалить механическим путем: серебро снова заблестит, если просто отполировать изделие зубной пастой с мыльной водой.
Серебро не взаимодействует с водородом и азотом. Драгоценный металл не вступает в реакцию и с углеродом. Фосфор воздействует на серебро при достижении температуры красного каления, при которой образуются фосфиды, а реакция серебра с соляной кислотой протекает довольно легко. При нагревании обоих элементов образуется сульфид.
Сульфид образуется при воздействии газообразной серы на нагретый металл. С кислородом серебро в реакцию не вступает, но способно растворить значительное количество этого газа. При нагревании металла возникает красивое, но опасное явление — разбрызгивание серебра.
Свойства серебра позволяют ему легко взаимодействовать с царской водкой и с соляной кислотой, насыщенной хлором. Реакция серебра и соляной кислоты приводит к выпаданию ионов металла в нерастворимый осадок из-за образования малорастворимого хлорида. Нажмите здесь, чтобы узнать, как другие металлы взаимодействуют с сильными кислотами.
Серебро можно растворить в водных растворах щелочноземельных и щелочных металлов, цианидов, если они достаточно насыщены воздухом. Схожая реакция наблюдается при контакте драгоценного металла с водным раствором тиомочевины, в котором присутствуют соли железа.
Видео:АФФИНАЖ СЕРЕБРА НОВЫМ МЕТОДОМ! Минуя ХЛОРИД СЕРЕБРА.. АЛЮМИНИЙ, МЕДЬ и ПРОЧЕЕ..!Скачать

Растворение серебра в соляной кислоте
Этот металл не растворяется в соляной кислоте из-за тонкого слоя хлорида серебра. Если добавить к раствору свободный кислород в виде перекиси водорода, то реакция приведет к окислению серебра в хлорид серебра.
Этот процесс протекает при содержании серебра в материале не более 5% от массы. Чтобы растворить серебро, металл расплавляют с другим металлом, который хорошо растворяется в соляной кислоте (например, с медью). Если нужно отделить золото от серебра, то расплавленный сплав выливают в воду, в результате реакции образуются мельчайшие частички сплава. После этого сплав растворяют в соляной кислоте средней концентрации, и высокое содержание соляной кислоты приводит к потери золота.
💡 Видео
50 грамм чистого Серебра. Простая очистка. Хороший способ!Скачать

Реакция МАГНИЯ и СОЛЯНОЙ КИСЛОТЫ. Получение ХЛОРИДА МАГНИЯ MgCI2. Опыты по химии дома. ЭкспериментыСкачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать