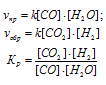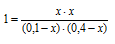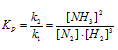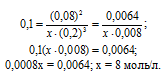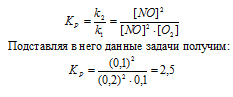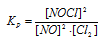При некоторой температуре энтальпийный и энтропийный факторы уравниваются, две противоположные тенденции уравновешивают друг друга, т.е. ΔΗ = ΤΔS. В этом случае соблюдается условие DGх.р=0, которое является термодинамическим условием химического равновесия.
Химическое равновесие имеет динамический характер. Скорость реакции (число частиц, образующихся в единицу времени в единице объема) в прямом направлении равна скорости реакции в обратном направлении. В условиях химического равновесия концентрации (или парциальные давления в случае газов) исходных веществ и продуктов реакции не изменяются во времени и называются равновесными концентрациями (или парциальными давлениями) веществ. В дальнейшем, равновесные концентрации обозначены символом вещества в квадратных скобках, например, [А]¸ [В], моль/дм 3 . Равновесное парциальное давление обозначено индексом р, например, ррА.
Для реакции, протекающей по уравнению:
математическое выражение закона действующих масс может быть представлено в двух вариантах:
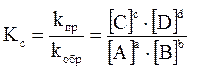
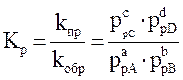
Если все реагенты газообразны и их поведение подчиняется законам идеальных газов, то связь между Кр и Кс можно выразить уравнением
где Δν – изменение числа молей газов в результате реакции
Термодинамическая константа может быть рассчитана, если известно стандартное значение энергии Гиббса:
lgКр = -DG 0 /(2,303RT).
Как следует из вышесказанного, константа равновесия зависит от температуры. С учетом сущности понятия DG 0 уравнение принимает вид
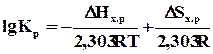
Если нет фазовых превращений компонентов реакции, то при увеличении температуры слагаемое 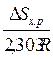
Каждое химическое равновесие устанавливается при определенном значении трех параметров, которые его характеризуют: 1) концентрация реагирующих веществ и продуктов реакции; 2) температура; 3) давление (для газов). При изменении любого из этих параметров равновесие может смещаться. Смещение равновесия определяется принципом Ле-Шателье: при всяком внешнем воздействии на систему, находящуюся в состоянии химического равновесия, в ней протекают процессы, приводящие к уменьшению оказанного воздействия.
Принцип Ле-Шателье следует из закона действующих масс. Если система находится при постоянной температуре, то константа равновесия при внешних воздействиях остается постоянной. Поэтому любое изменение равновесных концентраций одного или нескольких веществ должно приводить к такому изменению равновесных концентраций других веществ, чтобы соблюдалось постоянство константы равновесия.
Пример 3.Рассмотреть принцип Ле-Шателье на примере реакции получения водорода конверсией метана:
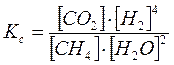
Решение.
1. Влияние концентраций (парциальных давлений) компонентов системы. Если, например, в систему добавить метан, т.е. увеличить его концентрацию, то равновесие системы нарушится. При этом ускорится прямая реакция, что приведет к увеличению концентрации продуктов реакции СО2 и Н2 и уменьшению концентрации водяного пара, т.е. равновесие смещается вправо. Процесс будет протекать до тех пор, пока не установится новое равновесие, характеризующееся тем же значением Кс. Если в систему ввести дополнительное количество СО2 или Н2, то в соответствии с принципом Ле-Шателье равновесие сместится влево.
2. Влияние общего давления в системе. Если в результате реакции изменяется число молей газообразных веществ, то изменение общего давления в системе вызывает смещение равновесия. В соответствии с принципом Ле-Шателье увеличение общего давления в системе вызывает смещение равновесия в сторону уменьшения числа молей газообразных веществ, т.е. в сторону уменьшения давления. Для рассматриваемой реакции увеличение давления должно смещать равновесие влево (слева Σνi = 3, справа Σνi = 5).
3. Влияние температуры. С увеличением температуры равновесие смещается в сторону эндотермических реакций, т.е. реакций, протекающих с поглощением теплоты. Как указывалось ранее, повышение температуры вызывает увеличение константы равновесия эндотермической реакции, а соответственно возрастают отношения концентраций продуктов реакции к концентрациям исходных веществ, т.е. равновесие смещается в сторону эндотермических реакций. Например, увеличение температуры вызывает смещение равновесия рассматриваемой реакции получения водорода (ΔΗ>0) в правую сторону, а для экзотермической реакции
| Задачи | |||||
| g | 2,0 | 2,4 | 2,2 | 3,0 | 3,8 |
| Δt, 0 С |
171-175. Равновесие в гомогенной газовой системе установилось в момент, когда прореагировало 50% вещества А. Вычислите константу равновесия, если концентрации исходных веществ равны СоА и СоВ. В какую сторону сместится равновесие при повышении давления?
| Задачи | Система | СоА,моль/л | СоВ, моль/л |
| 2А+2В=С+2D | 1,1 | 2,5 | |
| А+4В =2С+2D | 0,8 | 2,6 | |
| 3А+ В =С+3D | 1,2 | 0,8 | |
| 2А+3В=С+3D | 0,3 | 0,7 | |
| А +2В =2С+D | 1,0 | 1,6 |
Й уровень
176-180. Вгомогенной химической реакции установилось состояние равновесия с константой равновесия, равной k. Рассчитайте равновесные концентрации всех веществ, если начальная концентрация исходного вещества равна Со :
| Задачи | Реакция | k | Со, моль/л |
| 2HCl(г) =H2(г)+Cl2(г) | 0,5 | 0,20 | |
| 2NO(г)=O2(г)+N2(г) | 0,29 | 0,80 | |
| 2HBr(г)=H2(г)+Br2(г) | 0,36 | 0,10 | |
| PCl5(г)=PCl3(г)+Cl2(г) | 1,23 | 0,05 | |
| 2HI(г)=H2(г)+I2(г) | 0,65 | 0,20 |
181.Определите энергию активации реакции, константа скорости которой увеличилась в 10 5 раз при повышении температуры с 330 до 400 К.
182. Протекают две реакции. Энергия активации первой из них на 10 кДж меньше, чем у второй. Во сколько раз скорость первой реакции больше скорости второй при 100 и при 700 °С, если их предэкспоненциальные множители одинаковы?
183. Скорость реакции удваивается при увеличении температуры на 10 °С. При каком значении энергии активации это утверждается в интервале 295-305 °С?
184. Энергия активации разложения диоксида азота на оксид азота (II) и кислород равна 111 кДж/моль. Во сколько раз увеличится константа скорости реакции при повышении температуры с 330 до 400 К?
185. В сосуд объемом 0,5 л было помещено 0,5 моль Н2 и 0,5 моль N2. При некоторой температуре к моменту равновесия образовалось 0,02 моль NН3. Вычислите константу равновесия.
186-190. Определить константу скорости химической реакции при температуре Т и энергию активации, если при Т1 константа скорости реакции равна К1, а при температуре Т2 – К2.
| Задачи | T, °С | T 1, °С | T 2, °С | К1, с -1 | К2, с -1 |
| 1,08·10 -4 | 5,48·10 -4 | ||||
| 4,08·10 -4 | 19,83·10 -4 | ||||
| 5,1·10 -5 | 4,76·10 -4 | ||||
| 3,3·10 -3 | 4,65·10 -2 | ||||
| 8,47·10 -3 | 9,41·10 -2 |
191. Вычислить температуру, при которой константа равновесия реакции
2NO2 (г)↔N2O4(г) равна единице. Изменениями ΔΗº и ΔSºс температурой пренебречь. В каком направлении сместится равновесие при температуре более низкой, чем найденная?
192. Величина ΔGº для реакции А + В↔АВ при 298 К равна – 8 кДж/моль. Начальные концентрации веществ А и В равны 1 моль/л. Найти константу равновесия реакции и равновесные концентрации веществ А, В и АВ.
193. Металлы можно получит прямым восстановлением водородом, например, железо по реакции
Рассчитайте температуру, при которой установится равновесие? Рассчитайте равновесную концентрацию водорода и паров воды в системе, если начальная концентрация водорода была равна 5 моль/л.
194. Один из вредных компонентов выхлопных газов автомобиля – оксид углерода СО. Его можно нейтрализовать окислением: СО + ½ О2 = СО2.
Если в системе установится равновесие, то какие внешние воздействия будут способствовать нейтрализации СО?
195. Углекислота Н2СО3 способствует химическому разрушению (коррозии) металла. Она может быть удалена из воды путем разложения по реакции: Н2СО3(р) = СО2 + Н2О(ж) (ΔΗ>0). Если система находится в равновесии, то какие внешние воздействия будут способствовать разложению Н2СО3?
Й уровень
196. В водоем со сточными водами попал гербицид, начальная его концентрация в водоеме составила 10 -4 моль/л. Определите период полупревращения гербицида при взаимодействии его с компонентами среды, и изменение его концентрации через 100 ч, если реакция имеет первый порядок, а константа скорости равна 10 -6 с -1 .
197. Для удаления сероводорода из промышленных сточных вод предложена реакция его неполного окисления до серы и воды. Если концентрации О2 и Н2S равны 10 -4 моль/л, а константа скорости составляет 10 -4 моль·л·с -1 , то каковы начальная скорость реакции и период полупревращения?
198. Константы скоростей прямой и обратной реакций при 298 К равны соответственно 10 -5 и 10 -9 с -1 . Рассчитайте стандартную энергию Гиббса реакции. В реакции первого порядка энергия активации Е = 104,5 кДж/моль и в уравнении Аррениуса предэкспоненциальный множитель А = 5·10 -13 с -1 . При какой температуре период полупревращения сократится в 10 раз?
199. Период полураспада радиоактивного 11 С равен 20,5 мин. Рассчитайте константу скорости. Сколько позитронов излучит 10 -6 г изотопа 
200.Скорость некоторой реакции изучали, измеряя объем V газообразного продукта, выделяющегося через различные промежутки времени t:
| V, см 3 | 6,3 | 11,4 | 15,53 | 18,9 | 34,75 |
| t, с | ∞ |
Установить графически порядок реакции, рассчитать константу скорости k и период полупревращения.
201 – 205. Железный стержень погружен в Х –молярный раствор соляной кислоты. Через время t от начала реакции при постоянном перемешивании концентрация оказалась равной Y. Определить время, по истечении которого концентрация раствора станет равной Z. Какие предположения и допущения необходимо использовать при решении этой задачи?
Видео:Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

Равновесие в реакции, уравнение которой
СН4(г) + 4S(ж) ↔ СS2(г) + 2Н2S(г), ΔH 0 298 = 14 кДж/моль
1) в обратном 2) в прямом
3) состояние химического равновесия 4) реакция не протекает
49) Согласно уравнению гомогенной химической реакции С2Н2 + Н2« С2Н4; DН 0 0 =-52,3 кДж, стандартная энтальпия образования этилена равна____кДж/моль
52) Повышение давления смещает равновесие в сторону продуктов для реакции…
53) Для увеличения выхода продуктов реакции FeO(т) + H2(г)↔Fe(т) + H2O(г), ∆Н>0 необходимо…
1) понизить давление
2) понизить температуру
3) повысить давление
4) повысить температуру
54) Согласно первому началу термодинамики, справедливо выражение…
4) ∆U=Q-A
55) Для нахождения ∆Н 0 298 реакции 4HCN(г) + 5О2(г) = 2Н2О(ж) + 4СО2(г) + 2N2(г) ,
следует воспользоваться формулой…
1) ∆Н 0 298 = 2∆Н 0 298, Н2О (ж) + 4∆Н 0 298, СО2 (г) — 4∆Н 0 298, НСN (г)
2) ∆Н 0 298 = ∆Н 0 298, Н2О (ж) + ∆Н 0 298, СО2 (г) — ∆Н 0 298, НСN (г)
3) ∆Н 0 298 = 4∆Н 0 298, НСN (г) + 2∆Н 0 298, Н2О (ж) — 4∆Н 0 298, СО2 (г)
4) ∆Н 0 298 = ∆Н 0 298, НСN (г) + ∆Н 0 298, Н2О (ж) — ∆Н 0 298, СО2 (г)
56) Неверно, что согласно 2 началу термодинамики…
1) теплота самопроизвольно переходит от более нагретого тела к менее нагретому
2) тепловой эффект обратной реакции больше теплового эффекта прямойреакции
3) КПД тепловой машины всегда меньше единицы (100%)
4) в изолированной системе самопроизвольно идут процессы, сопровождающиеся увеличением энтропии
57) Если прямая экзотермическая реакция протекает с уменьшением количества газообразных веществ, то согласно принципу Ле-Шателье , чтобы сместить равновесие в сторону продуктов, следует…
Повысить давление
2) понизить давление
3) повысить температуру
4) добавить катализатор
58) Наибольшему значению энтропии соответствует состояние воды…
Количественное соотношение между изменением внутренней энергии, теплотой и работой устанавливает______ закон термодинамики
1) третий 2) первый 3) второй 4) нулевой
60) Реакция CaCO3= CaO + CO2, для которой ∆Н=178кДж, ∆S=160Дж/моль×К, при стандартных условиях:
1) протекает в прямом направлении
2) протекает в обратном направлении
3) находится в равновесии
4) находится в колебательном режиме
Для экзотермического процесса синтеза аммиака одновременное понижение температуры и увеличение давления_________выход аммиака
2) сначала увеличивает, а затем уменьшает
62) Уравнение реакции, проходящей с увеличением энтропии, имеет вид…
63) Выберите соединения с макроэргическими связями:
2) Окислительно-восстановительные реакции. Электролиз.
1) Перманганат ион MnO4 — в кислой среде восстанавливается до …
2) Оксид марганца (IV) MnO2 может проявлять в окислительно-восстановительных реакциях свойстваи окислителя, и восстановителя
1) только окислителя
2) ни окислителя, ни восстановителя
3) только восстановителя
3) При электролизе водного раствора KCl на катоде выделяется …
4) В качестве восстановителей в промышленных условиях используют…
5) Согласно уравнению Нернста потенциал электрода…
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Вычисление константы равновесия системы
Видео:Скорость химических реакций. 9 класс.Скачать

Константа равновесия для гомогенной реакции
Задание 135.
Вычислите константу равновесия для гомогенной системы:
СО (г) + Н2О (г) ↔ СО2 (г) + Н2 (г)
если равновесные концентрации реагирующих веществ (молы/л):
[СО]р = 0,004; [Н2О]р = 0,064; [СО2]р = 0,016; [Н2]р = 0,016,
Чему равны исходные концентрации воды и СО? Ответ: Кр = 1; [H2O]исх = 0,08 моль/л; [СО]исх = 0, 02 моль/л.
Решение:
Уравнение реакции имеет вид:
Подставляя в выражение данные задачи получим:
Кр = (0,016 . 0,016)/(0,004 . 0,064) = 1.
Для нахождения исходных концентраций веществ Н2О и СО учтём, что согласно уравнению реакции из 1 моль СО и 1 моль Н2О образуется 1 моль СО2 и 1 моль Н2. Поскольку по условию задачи в каждом литре системы образовалось 0,016 моль СО2 и 0,016 моль Н2, то при этом было израсходовано по 0,016 моль СО и Н2О. Таким образом, искомые исходные концентрации равны:
Ответ: Кp = 1; [H2O]исх = 0,08 моль/л; [СО]исх =0, 02 моль/л.
Задание 136.
Константа равновесия гомогенной системы:
СО (г) + Н2О (г) ⇔ СО2 (г) + Н2 (г)
при некоторой температуре равна 1,00. Вычислите равновесные концентрации всех реагирующих веществ, если исходные концентрации равны (молы/л): [СО]исх = 0,10; [Н2О]исх = 0,40.
Ответ: [СО2]Р = [Н2]Р = 0,08; [СO]P = 0,02; [Н2O]P = 0,32.
Решение:
Уравнение реакции имеет вид:
При равновесии скорости прямой и обратной реакций равны, а отношение констант этих скоростей постоянно и называется константой равновесия данной системы:
Обозначаем за «х» моль/л равновесную концентрацию одного из продуктов реакции, тогда равновесная концентрация другого будет также х моль/л так как они оба образуются в одинаковом количестве. Равновесные концентрации исходных веществ будут:
[СО]исх = 0,10 – х моль/л; [Н2О]исх = 0,40 — х моль/л. (так как на образование х моль/л продукта реакции расходуется соответственно по х моль/л СО и Н2О. В момент равновесия концентрация всех веществ будет (моль/л): [СО2]Р = [Н2]Р = х; [СO]P= 0,10 — х; [Н2O]P = 0,4 – х.
Подставляем эти значения в выражение константы равновесия:
Решая уравнение, находим х = 0,08. Отсюда равновесные концентрации (моль/л):
Задание 137.
Константа равновесия гомогенной системы N2 + ЗН2 = 2NH3 при некоторой температуре равна 0,1. Равновесные концентрации водорода и аммиака соответственно равны 0,2 и 0,08 моль/л. Вычислите равновесную и исходную концентрации азота. Ответ: [N2]P = 8 молы/л; [N2]исх = 8,04 моль/л.
Решение:
Уравнение реакции имеет вид:
Обозначим равновесную концентрацию N2 через х моль/л. Выражение константы равновесия данной реакции имеет вид:
Подставим в выражение константы равновесия данные задачи и найдём концентрацию N2
Для нахождения исходной концентрации N2, учтём, что, согласно уравнению реакции на образование 1 моль NH3 затрачивается ½ моль N2. Поскольку по условию задачи в каждом литре системы образовалось 0,08 моль NH3, то при этом было израсходовано 0,08 . 1/2 = 0,04 моль N2. Таким образом, искомая исходная концентрация N2 равна:
Задание 138.
При некоторой температуре равновесие гомогенной системы
2NО + O2 ↔ 2NO2 установилось при следующих концентрациях реагирующих веществ (молы/л): [NО]p = 0,2; [О2]р = 0,1; [NO2]р = 0,1. Вычислите константу равновесия и исходную концентрацию NO и O2. Ответ: К = 2,5; [NО]исх = 0,3 молы/л; [О2]исх = 0,15 моль/л.
Решение:
Уравнение реакции:
Для нахождения исходных концентраций NO и O2 учтём, что согласно уравнению реакции, из 2 моль NO и 1 моль О2 образуется 2 моль NO2, то при этом было затрачено 0,1 моль NO и 0,05 моль О2. Таким образом, исходные концентрации NO и О2 равны:
Ответ: Кp = 2,5; [NО]исх = 0,3 молы/л; [О2]исх = 0,15 моль/л.
Видео:Влияние концентрации на скорость химических реакций. 10 класс.Скачать

Смещение равновесия схимической системы
Задание 139.
Почему при изменении давления смещается равновесие системы:
N2 + 3Н2 ↔ 2NH3 и, не смещается равновесие системы N2 + O2 ↔ 2NO? Ответ мотивируйте на основании расчета скорости прямой и обратной реакций в этих системах до и после изменения давления. Напишите выражения для констант равновесия каждой из данных систем.
Решение:
а) Уравнение реакции:
Из уравнения реакции следует, что реакция протекает с уменьшением объёма в системе (из 4 моль газообразных веществ образуется 2 моль газообразного вещества). Поэтому при изменении давления в системе будут наблюдаться смещение равновесия. Если повысить давление в данной системе, то, согласно принципу Ле Шателье, равновесие сместится вправо, в сторону уменьшения объёма. При смещении равновесия в системе вправо скорость прямой реакции будет больше скорости обратной реакции:




Если же давление в системе уменьшить, то равновесие системы сместится влево, в сторону увеличения объёма, то при смещении равновесия влево скорость прямой реакции будет меньше, чем скорость прямой:

б) Уравнение реакции:
Из уравнения реакции следует, что при протекании реакции не сопровождается изменением объёма, реакция протекает без изменения числа молей газообразных веществ. Поэ му изменение давления в системе не приведёт к смещению равновесия, поэтому скорости прямой и обратной реакции будут равны:




Задание 140.
Исходные концентрации [NО]исх и [С12]исх в гомогенной системе
2NO + Сl2 ↔ 2NOС1 составляют соответственно 0,5 и 0,2 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20% NО. Ответ: 0,417.
Решение:
Уравнение реакции имеет вид: 2NO + Сl2 ↔ 2NOС1
Согласно условию задачи в реакцию вступило 20% NO, что составляет 0,5 . 0,2 = 0,1 моль, а не прореагировало 0,5 – 0,1 = 0,4 моль NO. Из уравнения реакции следует, что на каждые 2 моль NO расходуется 1 моль Cl2, при этом образуется 2 моль NOCl. Следовательно, c 0,1 моль NO в реакцию вступило 0,05 моль Cl2 и образовалось 0,1 моль NOCl. Осталось не израсходованным 0,15 моль Cl2 (0,2 – 0,05 = 0,15). Таким образом, равновесные концентрации, участвующих веществ равны (моль/л):
Подставляя в данное выражение равновесные концентрации веществ, получим:
🎥 Видео
Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

8 класс - Химия - Гомогенные и гетерогенные химические реакции. Скорость химической реакции. Часть 2Скачать

Скорость химической реакции. Гомо- и гетерогенные реакции. Механизм реакции.Скачать

Все о скорости химической реакции | Химия ЕГЭ 10 класс | УмскулСкачать

Химия | Cкорость химической реакцииСкачать

Задачи на скорость реакции в зависимости от концентрации реагентовСкачать

Влияние температуры на скорость химических реакций. 10 класс.Скачать

Скорость химической реакции. Практическая часть. 10 класс.Скачать

Химическая кинетика. Скорость химической реакции | ХимияСкачать

Влияние концентрации реагирующих веществ на скорость химической реакции. Опыт 1Скачать

Скорость химических реакций. Гомогенные и гетерогенные реакции. Химия 8 классСкачать

123. Решение задач на нахождение скорости хим. реакции по известным концентрациям и времени.Скачать

Обратимость и необратимость химических реакций. Химическое равновесие. 1 часть. 9 класс.Скачать

Скорость химической реакцииСкачать

Объемные отношения газов при химических реакциях. 8 класс.Скачать

Всё о скорости химической реакции | Химия ЕГЭ 2022 | УмскулСкачать