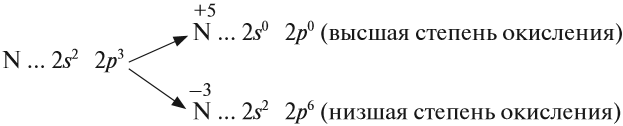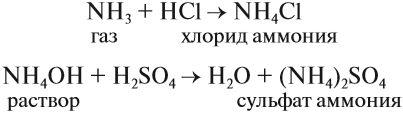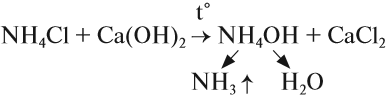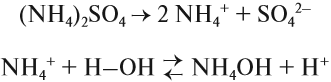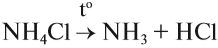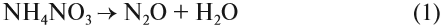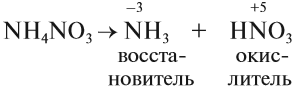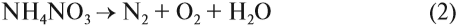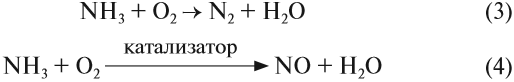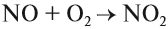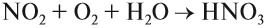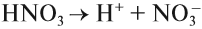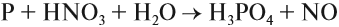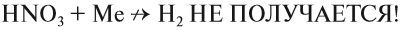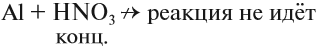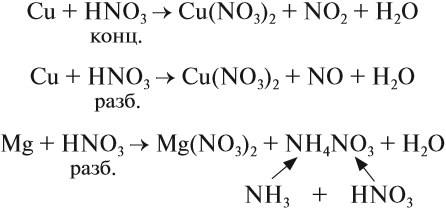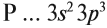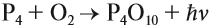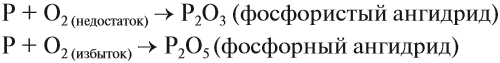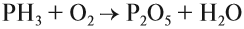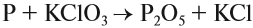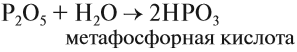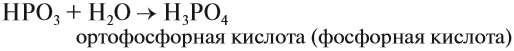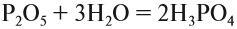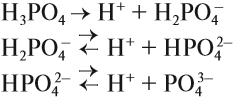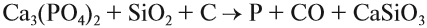План урока:
- Азот и фосфор
- Аллотропия фосфора
- Основные соединения азота и фосфора
- Основные соединения азота
- Взаимодействие азотной кислоты с металлами и неметаллами
- Основные соединения фосфора
- Химические свойства азота и фосфора
- Химические свойства азота
- Химические свойства фосфор
- Урок 14. Азот и фосфор
- Строение атома и свойства азота
- Аммиак и соли аммония
- Азотная кислота и её соли
- Строение атома и свойства фосфора
- Свойства и значение соединений фосфора
- Выводы
- 2.3.3. Химические свойства азота и фосфора.
- Химические свойства азота
- Взаимодействие азота с металлами
- Взаимодействие азота с неметаллами
- Взаимодействие азота со сложными веществами
- Химические свойства фосфора
- Взаимодействие фосфора с неметаллами
- Взаимодействие фосфора с металлами
- Взаимодействие фосфора со сложными веществами
- 🔍 Видео
Видео:Химия 9 класс (Урок№16 - Фосфор. Аллотропия фосфора. Свойства фосфора. Оксид фосфора(V).)Скачать

Азот и фосфор
Заслуга обнаружения азота принадлежит шотландскому химику Д. Резерфорду. Химик поставил эксперимент в 1772 году, в ходе которого и был обнаружен элемент. Свободная форма элемента — газ, входящий в основу поглощаемого нами воздуха. Физические и химические свойства элемента мы изучим ниже.
Азот находится под номером 7 в периодической системе, соответственно и заряд ядра его равен +7. Атомный вес равен 14,007 а.е.м. Неметалл, второй период, V группа A подгруппа.
Азот — простое вещество. В природе азот – двухатомная молекула N2 (представлена ниже). Отличительная черта молекулы этого элемента — это связь ее атомов через очень прочную ковалентную связь.
Строение атома азота Источник
Последующий после азота представитель семейства пниктидов – фосфор. Пятнадцатый элемент периодической системы элементов с относительной атомной массой 30,937 а.е.м.. Фосфор — неметалл со степенями окисления от -3 до +5. Для данного элемента более характерно +5, а вот -3 гораздо реже встречается, чем у его предшественника. По сравнению с азотом он менее электроотрицателен и больше проявляет восстановительные свойства. Это связано с тем, что атомы данного элемента имеют радиус атома больше, чем у азота.
Строение атома фосфора Источник
Простое вещество фосфор в чистом виде встречается редко, в силу своей высокой активности быстро вступает в реакции. При обычных условиях фосфор — вещество твердокристаллическое, в воде не растворяется.
На данный момент известно, что данное вещество способно на аллотропию 11 раз, именно столько модификаций есть в природе данного элемента. Наиболее распространены три (или можно объединить их в три группы): черный, белый и красный. О них будет речь ниже.
Видео:Фосфор. 9 класс.Скачать

Аллотропия фосфора
Наибольшее распространение получил фосфор белый, из-за примесей иногда бывает желтого цвета. Молекулярная решетка, составлена четырьмя атомами фосфора.
Вещество быстро вступает в реакции, пластилинообразное на ощупь, неприятное на запах, с нотками чеснока. Цвета бледновато желтого. Растворим в сероуглероде и бензоле, но не в воде. В реакции с паром H2O получаем смесь из газов. Токсично, возгорается в процессе трения. Светится в темноте. Плавится при 44 градусах. Особые условия хранения, ввиду активности вещества хранят под слоем воды.
Красный фосфор — разновидность фосфора, цветовая гамма которых расположилась от оранжевого до фиолетового спектра. Плотность так же различна, как и окрас. За образование красного фосфора ответственен белый фосфор, но нагретый порядком до 320 °С без кислорода. Дальнейшее нагревание до 560 °С кристаллизует и увеличивает температуру, при которой красный фосфор будет плавиться, попутно уменьшая реакционную способность. Исходя из выше написанного мы можем считать, что эта модификация фосфора менее активна белого фосфора. Не растворимо в воде и в сероуглероде. Безвредно, но и в темноте не светится.
Следующая модификация фосфора (черная) добывают из белого, нагревая последний до 230 °С и повышая давление. Наиболее стабильная форма. Имеет три разновидности: ромбическую, кубическую и гексагональную. Отличие разновидностей в строении молекулярной решетки.
Эта разновидность фосфора по внешним особенностям больше похожа на металл, об этом говорит его блеск и наличие свойств электро- и теплопроводности. Почти инертен, не вступает в реакцию даже с растворителями органического рода, твердый на ощупь.
Видео:Химия 9 класс (Урок№14 - Азот: свойства и применение. Аммиак. Физические и химические свойства.)Скачать

Основные соединения азота и фосфора
Основные соединения азота
Как видно из формулы, аммиак одно из соединений азота. Важное соединение, как для жизни человека, так и для природы. Восстановительные свойства преобладают. Получают путем соединения азота из воздуха с водородом. Способ достаточно оптимизированный. Необходимость оптимального соединения и синтеза возникает ввиду важности самого элемента, входящего в состав жизненно важных элементов организма человека. Азот — важнейший компонент белка и нуклеиновых кислот.
Получение аммиака:
3H2 + N2 → 2NH3 + Q, необходимы условия для стабилизации реакции и для наибольшего выхода: давление от 15 до 100 Мпа и катализаторы.
Аммиак. Водный раствор (нашатырный спирт)
Получение аммиака в лаборатории возможно путем взаимодействия гашеной извести и твердого хлорида аммония (NH4Cl). При этом необходимо смесь нагревать.
Свойства аммиака
В обычном состоянии аммиак — это ядовитый, неприятный на запах газ. Раствор аммиака с водой называют аммиачной водой. Из-за хорошей растворимости в воде, поэтому аммиак не хранят в воде.
У атомов азота в данном веществе характерная для азота степень окисления -3. При этом окислении азот ведет себя как восстановитель. Аммиак легко сжигается при пониженной температуре. При испарении жидкого аммиака поглощается много тепла, что позволяет использовать это свойство при изготовлении холодильников.
Оксиды азота
Азот выделяется среди других элементов большим количеством оксидов. Его оксиды термодинамически неустойчивы к распаду на простые вещества. Но при 700 °С реакция разложения оксидов кинетически заторможена. О них будет идти речь ниже.
Азотистая кислота. Формула HNO2
Кислота одноосновная и слабая. Существует в виде разбавленных водных растворов или же в газовой фазе. Соли этой кислоты — нитриты (или азотистокислые соли). А вот соли кислоты гораздо устойчивее самой кислоты, и они все токсичны.
Нитрат аммония (аммонийная селитра) NH4NO3. Продукт взаимодействия азотной кислоты с NH4OH (гидрат аммиака). Первооткрывателем вещества является Иоганн Глаубер. Открыто вещество в 1659 году. Применяется как компонент взрывчатых веществ и удобрение.
Нитрат калия, азотнокислый калий (калиевая селитра, калийная селитра, индийская селитра и др.) — соединение неорганического класса, формула которой: KNO3. Не имеет ни запаха, ни цвета, нелетучее в кристаллическом состоянии. Обладает способностью впитывать воду из окружающей среды. Растворимость в воде хорошая. Можно считать неядовитым для животных и людей.
Минеральные удобрения — это группа неорганических соединений, питающие растения элементами в виде минеральных солей различного рода. Активно применяется в Агро промышленности.
Взаимодействие азотной кислоты с металлами и неметаллами
Взаимодействие с металлами
Поскольку азот с наибольшим окислением атома +5 является более сильным окислителем, чем H +1 , то в качестве продуктов могут образовываться оксиды азота с различными степенями окисления, молекулярный азот, аммиак и соли аммония. Благородные металлы, такие как платина, тантал и золото не взаимодействуют с азотной кислотой совсем. Для других металлов азот реакционноспособен, и продукты реакции определяются концентрацией азотной кислоты.
При этом есть одна закономерность в реакциях азотной кислоты и металлов: чем менее концентрирована азотная кислота и более активен метал, тем больше происходит восстановление азота:
Реакции с металлами протекают по окислительно-восстановительному механизму, коэффициенты в уравнениях реакций могут быть определены методом электронного баланса.
Пример
Взаимодействие концентрированной азотной кислоты с медью.
Обобщенные особенности взаимодействия азотной кислоты с металлами можно выделить следующие:
Краткая схема протекания реакции азотной кислоты с металлами: Металл + НNO3 ↔ вода + нитрат + газ
Основные соединения фосфора
Фосфор достаточно активный элемент и образует большое количество оксидов, среди них можно выделить два. Наиболее важные: оксид фосфора (III) P2O3 и оксид фосфора (V) P2O5.
Первый оксид называют иначе фосфористым ангидридом (P2O3). Получают при медленном сжигании фосфора в бескислородной среде.
В нормальном состоянии представляет собой белую массу, состоящую из хлопьев или кристаллов. Токсичен. Очень летучий. На свету сначала желтеет, потом краснеет. Хорошая растворимость в органических растворителях (в бензоле и сероуглероде). По своей природе оксид кислотный.
Подвергается окислению кислородом, образуя наш следующий оксид (Р2О5):
Оксид фосфора (V) – фосфорный ангидрид. При нормальных условиях представлен в виде белого влагопоглощающего порошка. Из-за влагопоглощающих свойств, хранение осуществляется в плотно закрытых сосудах. Наиболее часто применяют свойство влагопоглощения при осушении газов и жидкостей. Получают, как указано в предыдущей реакции, окислением оксида выше или же сжиганием фосфора в избытке кислорода:
Оксид по своей природе кислотный, и соответственно осуществляет взаимодействие с водой, оксидами основной природы и щелочами:
- Реакции с водой, с образованием различных кислот:
Р2О5 + Н2О →2HPO3 при температуре 0°С образуется метафосфорная кислота
Р2О5 + 2Н2О →Н4Р2О7 при комнатной температуре — пирофосфорная (дифосфорная)
- Реакция с основными оксидами, с образованием фосфатов
- Реакции с щелочами, с образованием средних и кислых солей
Р2О5 + 6NaOH →ЗН2О + 2Na3PO4(ортофосфат натрия, средняя соль)
Р2О5 + 4NaOH →Н2О + 2Na2HPO4(гидрофосфа́т на́трия, кислая соль)
Р2О5 + 2NaOH →Н2О + 2NaH2PO4(дигидрофосфат натрия, кислая соль)
Фосфорные кислоты
Фосфорная (ортофосфорная) кислота H3PO4 в обычном состоянии — твердокристаллическое прозрачное вещество. Хорошо растворимо в воде, наиболее активно используется в растворенном виде.
Получение фосфорной кислоты:
Видео:Кислородсодержащие соединения азота. Видеоурок 31. Химия 9 классСкачать

Химические свойства азота и фосфора
Химические свойства азота
Тройная связь влияет на активность азота. Соединения азота разлагаются легко, при нагревании образуются свободный азот.
Химические свойства фосфор
Реакционная способность наивысшая у белого фосфора и наименьшая у черного, почти инертен. Ясно иллюстрируется градация активности, зависящая от модификации.
При этом фосфор имеет большую реакционную способность. Это распространяется как на простые, так и на сложные вещества.
Соединения фосфора с кислородом прочнее таковых соединений с азотом. Это происходит из-за того, что неметаллические свойства фосфора слабее, чем неметаллические свойства азота.
Видео:Химия 9 класс : АзотСкачать

Урок 14. Азот и фосфор
Видео:Азот и фосфор VA группа | Химия ЕГЭ, ЦТСкачать

Строение атома и свойства азота
Азот — элемент пятой группы второго периода Периодической системы Менделеева.
Задание 14.1. Опишите строение атома этого элемента.
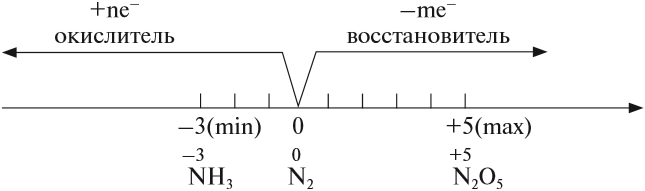
Имея на внешнем энергетическом уровне пять электронов, азот является типичным неметаллом, т. е. способен и принимать и отдавать электроны:
Задание 14.2. Составьте формулы простейших соединений азота с высшей (+5) и низшей (–3) степенями окисления (в случае затруднений см. урок 3).
Задание 14.3. Определите степени окисления азота в соединениях:
В своих соединениях атом азота может проявлять любые степени окисления от –3 до +5. Свойства некоторых из этих соединений будут рассмотрены ниже.
Простое вещество — азот N2 — составляет 4/5 Земной атмосферы. Азот в виде соединений (белков) входит в состав всех живых существ. Неорганических соединений азота в земной коре очень мало: 0,002 % по массе.
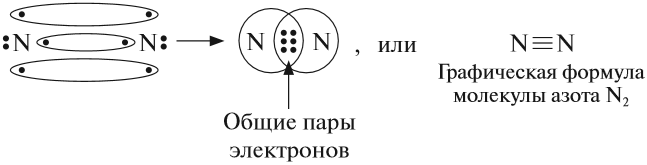
Вопрос. Какой тип химической связи соединяет атомы азота в его молекуле N2?
Поскольку в этой молекуле объединяются одинаковые атомы — связь ковалентная неполярная:
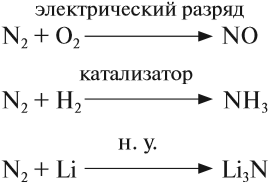
Кроме того, это — тройная связь, на разрыв которой требуется затратить очень много энергии. Поэтому при нормальных условиях азот не реагирует ни с одним веществом, кроме лития. При определённых условиях (нагревание, присутствие катализатора) азот реагирует с некоторыми металлами и неметаллами:
Задание 14.4. Расставьте коэффициенты. Определите, какие свойства (окислителя или восстановителя) проявляет азот в этих реакциях.
Поскольку атом азота в молекуле азота N2 имеет промежуточную степень окисления 0, в химических реакциях он может быть и окислителем и восстановителем:
Так как азот с трудом вступает в химические реакции, он относится к инертным газам и используется там, где нужно изолировать что-либо от окислительного действия кислорода: внутри баллона лампочки накаливания, атмосфера нефтехранилища и т. д.
Очень низкая температура кипения жидкого азота (–195,8 °C) позволяет быстро замораживать пищевые продукты и сохранять их в таком виде длительное время.
Важнейшими органическими соединениями азота являются белки, которые входят в состав любого живого организма. Но большинство живых существ не могут получать белки из атмосферного азота (связывать азот). Для этого нужны его соединения. Важнейшими неорганическими соединениями азота являются аммиак, азотная кислота и их соли.
Видео:АЗОТ И ФОСФОРСкачать

Аммиак и соли аммония
Аммиак NH3 — бесцветный газ с резким запахом, ядовит.
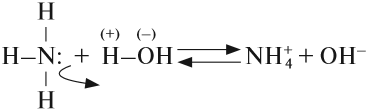
Задание 14.5. Составьте электронную и графическую формулы аммиака и определите тип химической связи в этой молекуле.
Поскольку связь N-Н сильно полярна, аммиак очень хорошо растворяется в полярном растворителе (воде) и реагирует с нею:
Вопрос. Какую реакцию среды имеет полученный раствор?
В результате этой реакции в растворе появляется избыток ионов ОН – , поэтому раствор аммиака в воде (аммиачная вода, нашатырный спирт) имеет щелочную среду и проявляет свойства слабого основания. Называется это основание «гидроксид аммония», и ему приписывают формулу NH4OH. Поскольку это щёлочь (растворимое основание), получаемая из летучего вещества (газа), её называют «летучей щёлочью».
Вопрос. Будет ли аммиак, а также его водный раствор реагировать с кислотами? щелочами?
Проявляя основные свойства, аммиак реагирует только с кислотами и не реагирует со щелочами:
В результате таких реакций образуются соли аммония, в которых вместо катиона металла имеется одновалентный катион аммония NH4 + . Соли аммония имеют ряд особенностей:
1. Соли аммония, как соли слабого основания, реагируют со щелочами:
Задание 14.6. Составьте уравнение этой реакции в ионномолекулярном виде. Не забудьте, что гидроксид аммония — слабое основание.
Если такая реакция идёт при нагревании, то получается аммиак в виде газа. Это лабораторный способ получения аммиака:
Кроме того, появляется характерный запах — качественный признак присутствия солей аммония в смеси. Эту реакцию используют для получения аммиака в лаборатории.
Вопрос. Будут ли соли аммония подвергаться гидролизу?
2. Соли аммония, как соли слабого основания, подвергаются гидролизу:
Вопрос. Какая реакция среды получается в результате данного процесса?
Задание 14.7. Составьте уравнение реакции гидролиза нитрата аммония. Какой цвет имеет лакмус в этом растворе?
3. Соли аммония, как соли летучего основания, разлагаются при нагревании. При этом может выделяться аммиак:
Но если соль образована кислотой, анион которой является сильным окислителем, аммиак не выделяется:
Почему в этом случае не выделяется аммиак? Возможно, что сначала процесс идёт как обычно:
Но поскольку азотная кислота — окислитель, а аммиак — восстановитель, они тут же реагируют друг с другом. При разложении нитрата аммония возможны и другие продукты реакции:
Задание 14.8. Составьте электронный баланс для реакций (1) и (2), укажите окислитель и восстановитель.
Вопрос. Почему атом азота в аммиаке проявляет восстановительные свойства? Может ли этот атом принимать электроны?
Атом азота в молекуле аммиака имеет низшую степень окисления –3 и поэтому способен только отдавать электроны и проявлять восстановительные свойства. Поэтому аммиак легко реагирует с окислителями, например с кислородом, и горит:
Реакция (3) практического смысла не имеет: зачем возвращать в атмосферу азот, который только что с таким трудом был превращён в аммиак? Зато реакция (4) каталитического окисления аммиака используется при получении азотной кислоты. Кроме того, аммиак и его соли применяются как азотные удобрения, а нитрат аммония входит в состав взрывчатых смесей.
Видео:Особенности строения и свойства молекулы азота. 11 класс.Скачать

Азотная кислота и её соли
Азотную кислоту получают в три стадии. Первая — каталитическое окисление аммиака. Полученный бесцветный газ NO окисляют в бурый газ NO2:
Эта реакция идёт даже при нормальных условиях. Полученный бурый газ NO2 очень ядовит, имеет резкий запах. Растворением его в воде в присутствии кислорода получают азотную кислоту:
Азотная кислота — очень сильный электролит, в растворе полностью диссоциирует на ионы:
Вопрос. Какие свойства проявляет атом азота азотной кислоты в окислительно-восстановительных реакциях?
Поскольку атом азота в азотной кислоте находится в высшей степени окисления +5, азотная кислота — сильный окислитель. Она окисляет и простые и сложные вещества:
Органические вещества, входящие в состав бумаги, хлопка, скипидара, могут загореться при соприкосновении с концентрированной азотной кислотой. Не удивительно поэтому, что при взаимодействии металлов с азотной кислотой не удаётся получить водород в качестве продукта реакции:
Действительно, водород — восстановитель, а азотная кислота — окислитель, и они легко реагируют друг с другом в момент выделения водорода. В результате таких реакций образуются оксиды азота или аммиак, который образует с азотной кислотой соль аммония:
Обратите внимание.
- Концентрированная азотная кислота не реагирует с алюминием, хромом и железом, так как образует на их поверхности прочную оксидную плёнку, которая предохраняет металл от дальнейшего окисления (пассивирует его).
- Азотная кислота реагирует даже с теми металлами, которые стоят в ряду напряжений после водорода (водород и здесь НЕ выделяется!).
- Продукт реакции зависит и от активности металла и от разбавления кислоты: чем активнее металл и чем разбавленнее кислота, тем сильнее восстанавливается кислота, т. е. сильнее изменяется степень окисления атома азота (вплоть до –3).
Задание 14.9. Расставьте коэффициенты в этих уравнениях реакций, пользуясь методом электронного баланса.
В любой из этих реакций образуется соль азотной кислоты — нитрат. Нитраты — это хорошо растворимые соли, применяемые часто в качестве удобрений (KNO3, NH4NO3). Соединения азота используются в качестве удобрений, поскольку растения, как и человек, не способны усваивать азот воздуха, т. е. не способны превращать N2 в органические соединения азота. А без этих соединений — аминокислот, белков, нуклеиновых кислот — жизнь в принципе невозможна.
При использовании таких удобрений следует помнить, что избыток нитратов в почве и растениях опасен для жизни, так как нитраты ядовиты!
Нитраты легко разлагаются при нагревании, причём продукты разложения зависят от активности металла. Так, нитраты очень активных металлов — селитры — разлагаются по схеме:
Задание 14.10. Составьте уравнение реакции разложения нитрата натрия.
Селитры входят в состав взрывчатых веществ. Так, нитрат калия входит в состав чёрного пороха. Действием на сухие нитраты концентрированной серной кислотой можно получить азотную кислоту.
Видео:Элементы 15 (VA) группы. Азот. 9 класс.Скачать

Строение атома и свойства фосфора
Фосфор был получен и назван алхимиком Брандом*, который пытался найти философский камень.
* БРАНД Хённинг (ок. 1630–после 1710) — немецкий алхимик без специального образования, профессиональный военный.
Этот камень, по убеждению алхимиков, мог превращать металлы в золото, обладал магическими свойствами. В 1669 году Бранд из остатков прозаической мочи выделил вещество, которое светилось в темноте. Безусловно, такими свойствами мог обладать только философский камень! Увы, никакими чудодейственными свойствами это вещество не обладало, но способность свечения в темноте подарило веществу и химическому элементу имя: его назвали фосфор, что означает «несущий свет».
Задание 14.11. Составьте электронную схему строения атома фосфора, укажите распределение валентных электронов, возможные степени окисления.
Распределение валентных электронов атома фосфора:
Поэтому фосфор проявляет в соединениях степени окисления –3, +3 и +5.
Задание 14.12. Составьте формулы водородных соединений, оксидов и гидроксидов фосфора, которые соответствуют этим степеням окисления.
Ниже мы рассмотрим свойства этих соединений, но вначале следует описать свойства простого вещества.
Как и для углерода, для фосфора характерно несколько аллотропных модификаций. В природе они не встречаются ввиду высокой активности этого неметалла. Почему, собственно, светился фосфор, полученный алхимиком? Потому что это был белый фосфор. Он имеет состав Р4. Это неполярное вещество, легко испаряется (возгоняется), причём пары белого фосфора окисляются на воздухе. При этом энергия химической реакции переходит в световую:
Полученный оксид проявляет ярко выраженный кислотные свойства, так как фосфор — активный неметалл, а степень окисления атома фосфора — высшая. Поэтому при попадании на кожу белого фосфора появляются глубокие, плохо заживающие ожоги. Кроме того, белый фосфор, его пары — токсичное вещество. Белый фосфор — желтоватое мягкое вещество, растворимое в неполярных растворителях.
В противоположность ему — красный фосфор достаточно инертное вещество, безвредное для человека, но при условии, что оно — абсолютно чистое. Примеси белого фосфора, которые довольно часто встречаются, делают его ядовитым. В чём причина такого разительного изменения свойств? В том, что красный фосфор и другие аллотропные модификации фосфора — являются неорганическими полимерами. И чем выше степень полимеризации, тем инертнее вещество, тем темнее цвет. В настоящее время кроме чёрного фосфора описаны свойства жёлтого, алого, фиолетового, коричневого и даже стеклообразного.
Чаще всего встречаются и используются белый, красный и чёрный фосфор. Рассмотрим свойства красного фосфора.
Красный фосфор — это красно-бурый аморфный порошок практически нерастворимый в воде и неполярных растворителях, поскольку это полимер. Степень полимеризации установить невозможно, поэтому химическая формула Р. В зависимости от того, происходит ли горение в избытке или недостатке кислорода, образуются разные оксиды:
Кроме того, фосфор реагирует с активными металлами и неметаллами:
Задание 14.13. Составить уравнение реакции фосфора с кальцием. Назвать полученное вещество.
Фосфиды, как и нитриды, силициды, разлагаются водой и кислотами. В результате образуется фосфин — ядовитый газ с неприятным чесночным запахом. Он способен самовоспламеняться на воздухе:
Именно огоньки-вспышки этого газа пугают прохожих на кладбищах, поскольку фосфин образуется при гниении белковых тел. А это означает, что фосфор, как и азот, — биогенный элемент. Биологические свойства соединений фосфора будут рассмотрены ниже.
Вышеперечисленные реакции подтверждают ранее установленное правило: атомы с промежуточной степенью окисления проявляют свойства и окислителя, и восстановителя. Восстановительные свойства фосфора проявляются при взаимодействии с бертолетовой солью KClO3:
Эта реакция начинается при лёгком нагревании, трении, а иногда и без причин. В результате может произойти сильная вспышка. Мы её наблюдаем всякий раз, как только чиркаем спичкой о спичечный коробок. В состав спичечной головки входит бертолетова соль KClO3 и сера, а в состав намазки — красный фосфор и толчёное стекло.
Видео:ОГЭ/Характеристика азота и фосфора/9 класс химияСкачать

Свойства и значение соединений фосфора
Как уже было показано выше, фосфор образует два вида оксидов Р2О3 и Р2О5. Это кислотные оксиды, образующие с водой фосфористую кислоту Н3РО3 и несколько фосфорных кислот. Состав фосфорных кислот отражает формула х Р2О5 · у Н2О:
Метафосфорная кислота неустойчива и, присоединяя воду, превращается в более устойчивую кислоту:
Или в суммарном виде:
Ортофосфорная кислота диссоциирует в три стадии:
Поэтому она образует три вида солей: КН2РО4 — дигидрофосфат, К2НРО4 — гидрофосфат, К3РО4 — фосфат. Эти соли, их растворы имеют разные свойства. Так, если большинство фосфатов нерастворимы в воде, кислые фосфаты имеют бОльшую растворимость.
Поскольку фосфор химически активен, в природе встречаются только нерастворимые соединения фосфора, в основном фосфаты. Они составляют основу таких минералов как апатиты и фосфориты. Основу фосфоритов составляет фосфат кальция, а в состав апатитов кроме него входят хлориды и фториды кальция.
Аналогичный состав имеют наши кости (фосфориты) и зубы (фторапатиты). В теле взрослого человека до 1,5 кг этого химического элемента. Таким образом, фосфор — биогенный элемент. Атомы фосфора входят в состав ДНК и РНК (нуклеиновых кислот), которые хранят и воспроизводят генетическую информацию. Кроме того, атомы фосфора входят в состав АТФ (аденозинтрифосфорной кислоты), при гидролизе которой выделяется аккумулированная в этой молекуле энергия.
Фосфор в чистом виде получают при нагревании измельчённых фосфоритов с песком и коксом:
Полученный фосфор используется при изготовлении спичек и пиротехнических составов, ядохимикатов, СМС (синтетических моющих средств) и многого другого.
Видео:§31, 9 кл. Кислородные соединения азотаСкачать

Выводы
Азот — это элемент жизни, поскольку он входит в состав любого живого организма в виде белков, нуклеиновых кислот. С другой стороны, газ азот обладает инертными свойствами, с трудом вступает в химические реакции, составляет основу атмосферы Земли. Фосфор совместно с азотом входит в состав ДНК, РНК, АТФ. Многочисленные соединения фосфора незаменимы в быту.
Видео:9 класс. Химия. Азот и его соединенияСкачать

2.3.3. Химические свойства азота и фосфора.
Видео:Соединения азотаСкачать
Химические свойства азота
Химический элемент азот образует только одно простое вещество. Данное вещество является газообразным и образовано двухатомными молекулами, т.е. имеет формулу N2. Не смотря то, что химический элемент азот имеет высокую электроотрицательность, молекулярный азот N2 является крайне инертным веществом. Обусловлен данный факт тем, что в молекуле азота имеет место крайне прочная тройная связь (N≡N). По этой причине практически все реакции с азотом протекают только при повышенных температурах.
Взаимодействие азота с металлами
Единственное вещество, которое реагирует с азотом в обычных условиях – литий:
Интересным является тот факт, что с остальными активными металлами, т.е. щелочными и щелочноземельными, азот реагирует только при нагревании:
Взаимодействие азота с металлами средней и низкой активности (кроме Pt и Au) также возможно, однако требует несравнимо более высоких температур.
Нитриды активных металлов легко гидролизуются водой:
А также растворами кислот, например:
Взаимодействие азота с неметаллами
Азот реагирует с водородом при нагревании в присутствии катализаторов. Реакция является обратимой, поэтому для повышения выхода аммиака в промышленности процесс ведут при высоком давлении:
Как восстановитель азот реагирует со фтором и кислородом. Со фтором реакция идет при действии электрического разряда:
С кислородом реакция идет под действием электрического разряда или при температуре более 2000 о С и является обратимой:
Из неметаллов азот не реагирует с галогенами и серой.
Взаимодействие азота со сложными веществами
В рамках школьного курса ЕГЭ можно считать, что азот не реагирует ни с какими сложными веществами кроме гидридов активных металлов:
Видео:9 класс § 32 "Фосфор и его соединения".Скачать

Химические свойства фосфора
Существует несколько аллотропных модификаций фосфора., в частности белый фосфор, красный фосфор и черный фосфор.
Белый фосфор образован четырехатомными молекулами P4, не является устойчивой модификацией фосфора. Ядовит. При комнатной температуре мягкий и подобно воску легко режется ножом. На воздухе медленно окисляется, и из-за особенностей механизма такого окисления светится в темноте (явление хемилюминесценции). Даже при слабом нагревании возможно самопроизвольное воспламенение белого фосфора.
Из всех аллотропных модификаций белый фосфор наиболее активен.
Красный фосфор состоит из длинных молекул переменного состава Pn. В некоторых источниках указывается то, что он имеет атомное строение, но корректнее все-таки считать его строение молекулярным. Вследствие особенностей строения является менее активным веществом по сравнению с белым фосфором, в частности в отличие от белого фосфора на воздухе окисляется значительно медленнее и для его воспламенения требуется поджиг.
Черный фосфор состоит из непрерывных цепей Pn и имеет слоистую структуру схожую со структурой графита, из-за чего и внешне похож на него. Данная аллотропная модификация имеет атомное строение. Самый устойчивый из всех аллотропных модификаций фосфора, наиболее химически пассивен. По этой причине, рассмотренные ниже химические свойства фосфора следует относить прежде всего к белому и красному фосфору.
Взаимодействие фосфора с неметаллами
Реакционная способность фосфора является более высокой, чем у азота. Так, фосфор способен гореть после поджига при обычных условиях, образуя кислотный оксид Р2O5:
а при недостатке кислорода оксид фосфора (III):
Реакция с галогенами также протекает интенсивно. Так, при хлорировании и бромировании фосфора в зависимости от пропорций реагентов образуются тригалогениды или пентагалогениды фосфора:
Ввиду существенно более слабых окислительных свойства йода по сравнению с остальными галогенами, возможно окисление фосфора йодом только до степени окисления +3:
В отличие от азота фосфор с водородом не реагирует.
Взаимодействие фосфора с металлами
Фосфор реагирует при нагревании с активными металлами и металлами средней активности образуя фосфиды:
Фосфиды активных металлов подобно нитридам гидролизуются водой:
А также водными растворами кислот-неокислителей:
Взаимодействие фосфора со сложными веществами
Фосфор окисляется кислотами окислителями, в частности, концентрированными азотной и серной кислотами:
Следует знать, что белый фосфор реагирует с водными растворами щелочей. Однако, ввиду специфичности умение записывать уравнения таких взаимодействий на ЕГЭ по химии пока еще не требовалось.
Тем не менее, тем, кто претендует на 100 баллов, для собственного спокойствия, можно запомнить следующие особенности взаимодействия фосфора с растворами щелочей на холоду и при нагревании.
На холоду взаимодействие белого фосфора с растворами щелочей протекает медленно. Реакция сопровождается образованием газа с запахом тухлой рыбы — фосфина и соединения с редкой степенью окисления фосфора +1:
При взаимодействии белого фосфора с концентрированным раствором щелочи при кипячении выделяется водород и образуется фосфит:
🔍 Видео
Составление формул соединений. 8 класс.Скачать

Соединения фосфораСкачать

Фосфор и его соединения. Видеоурок 32. Химия 9 классСкачать

ЕГЭ2020. ХИМИЯ. «N – значит азот» (Химия элементов. Азот и фосфор)Скачать

Химия. 9 класс. Фосфор. Соединения фосфора /03.03.2021/Скачать

5-4 Свойства солей азота и фосфора 0Скачать