Спецификой многих ОВР является то, что при составлении их уравнений подбор коэффициентов вызывает затруднение.
Для облегчения подбора коэффициентов чаще всего используют метод электронного баланса и ионно-электронный метод (метод полуреакций). Рассмотрим применение каждого из этих методов на примерах.
- Метод электронного баланса
- Ионно-электронный метод (метод полуреакций)
- Сера и её оксиды: решение задач методом электронного баланса
- Уравнения окислительно-восстановительных реакций серы
- Химия
- Основные термины
- Характеристика окислителей
- ОВР кислот
- H2SO4
- Зависимость окисления от реакционной среды
- Особенности KMnO4 как окислителя
- Особенности K2Cr2O7 как окислителя
- Запись ОВР процесса
- Уравнивание ОВР-реакций
- Метод электронного баланса
- Метод полуреакций
- Виды уравнений окислительно-восстановительных реакций
- 📺 Видео
Видео:Учимся составлять электронный баланс/овр/8классСкачать

Метод электронного баланса
В его основе метода электронного баланса лежит следующее правило: общее число электронов, отдаваемое атомами-восстановителями, должно совпадать с общим числом электронов, которые принимают атомы-окислители .
В качестве примера составления ОВР рассмотрим процесс взаимодействия сульфита натрия с перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции, учитывая, что в кислой среде MnO4 — восстанавливается до Mn 2+ (см. схему):
Найдем степень окисления элементов:
Из приведенной схемы понятно, что в процессе реакции происходит увеличение степени окисления серы с +4 до +6. S +4 отдает 2 электрона и является восстановителем. Степень окисления марганца уменьшилась от +7 до +2, т.е. Mn +7 принимает 5 электронов и является окислителем.
3) Составить электронные уравнения и найти коэффициенты при окислителе и восстановителе.
S +4 – 2e — = S +6 | 5 восстановитель, процесс окисления
Mn +7 +5e — = Mn +2 | 2 окислитель, процесс восстановления
Чтобы число электронов, отданных восстановителем, было равно числу электронов, принятых восстановителем, необходимо:
- Число электронов, отданных восстановителем, поставить коэффициентом перед окислителем.
- Число электронов, принятых окислителем, поставить коэффициентом перед восстановителем.
Таким образом, 5 электронов, принимаемых окислителем Mn +7 , ставим коэффициентом перед восстановителем, а 2 электрона, отдаваемых восстановителем S +4 коэффициентом перед окислителем:
4) Уравнять количества атомов элементов, не изменяющих степень окисления
Соблюдаем последовательность: число атомов металлов, кислотных остатков, количество молекул среды (кислоты или щелочи). В последнюю очередь подсчитывают количество молекул образовавшейся воды.
Итак, в нашем случае число атомов металлов в правой и левой частях совпадают.
По числу кислотных остатков в правой части уравнения найдем коэффициент для кислоты.
В результате реакции образуется 8 кислотных остатков SO4 2- , из которых 5 – за счет превращения 5SO3 2- → 5SO4 2- , а 3 – за счет молекул серной кислоты 8SO4 2- — 5SO4 2- = 3SO4 2- .
Таким образом, серной кислоты надо взять 3 молекулы:
Аналогично, находим коэффициент для воды по числу ионов водорода, во взятом количестве кислоты
6H + + 3O -2 = 3H2O
Окончательный вид уравнения следующий:
Признаком того, что коэффициенты расставлены правильно является равное количество атомов каждого из элементов в обеих частях уравнения.
Видео:ЭТОТ метод поможет на уроках ХИМИИ / Химия 9 классСкачать

Ионно-электронный метод (метод полуреакций)
Реакции окисления-восстановления, также как и реакции обмена, в растворах электролитов происходят с участием ионов. Именно поэтому ионно-молекулярные уравнения ОВР более наглядно отражают сущность реакций окисления-восстановления.
При написании ионно-молекулярных уравнений, сильные электролиты записывают в виде ионов, а слабые электролиты, осадки и газы записывают в виде молекул (в недиссоциированном виде).
При написании полуреакций в ионной схеме указывают частицы, подвергающиеся изменению их степеней окисления, а также характеризующие среду, частицы:
H + — кислая среда, OH — — щелочная среда и H2O – нейтральная среда.
Пример 1.
Рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции:
2) Записать уравнение в ионном виде
В уравнении сократим те ионы, которые не принимают участие в процессе окисления-восстановления:
SO3 2- + MnO4 — + 2H + = Mn 2+ + SO4 2- + H2O
3) Определить окислитель и восстановитель и составить полуреакции процессов восстановления и окисления.
В приведенной реакции окислитель — MnO4 — принимает 5 электронов восстанавливаясь в кислой среде до Mn 2+ . При этом освобождается кислород, входящий в состав MnO4 — , который, соединяясь с H + образует воду:
MnO4 — + 8H + + 5e — = Mn 2+ + 4H2O
Восстановитель SO3 2- — окисляется до SO4 2- , отдав 2 электрона. Как видно образовавшийся ион SO4 2- содержит больше кислорода, чем исходный SO3 2- . Недостаток кислорода восполняется за счет молекул воды и в результате этого происходит выделение 2H + :
SO3 2- + H2O — 2e — = SO4 2- + 2H +
4) Найти коэффициенты для окислителя и восстановителя
Необходимо учесть, что окислитель присоединяет столько электронов, сколько отдает восстановитель в процессе окисления-восстановления:
MnO4 — + 8H + + 5e — = Mn 2+ + 4H2O |2 окислитель, процесс восстановления
SO3 2- + H2O — 2e — = SO4 2- + 2H + |5 восстановитель, процесс окисления
5) Просуммировать обе полуреакции
Предварительно умножая на найденные коэффициенты, получаем:
2MnO4 — + 16H + + 5SO3 2- + 5H2O = 2Mn 2+ + 8H2O + 5SO4 2- + 10H +
Сократив подобные члены, находим ионное уравнение:
2MnO4 — + 5SO3 2- + 6H + = 2Mn 2+ + 5SO4 2- + 3H2O
6) Записать молекулярное уравнение
Молекулярное уравнение имеет следующий вид:
Пример 2.
Далее рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в нейтральной среде.
В ионном виде уравнение принимает вид:
Также, как и предыдущем примере, окислителем является MnO4 — , а восстановителем SO3 2- .
В нейтральной и слабощелочной среде MnO4 — принимает 3 электрона и восстанавливается до MnО2. SO3 2- — окисляется до SO4 2- , отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4 — + 2H2O + 3e — = MnО2 + 4OH — |2 окислитель, процесс восстановления
SO3 2- + 2OH — — 2e — = SO4 2- + H2O |3 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
Пример 3.
Составление уравнения реакции между сульфитом натрия и перманганатом калия в щелочной среде.
В ионном виде уравнение принимает вид:
В щелочной среде окислитель MnO4 — принимает 1 электрон и восстанавливается до MnО4 2- . Восстановитель SO3 2- — окисляется до SO4 2- , отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4 — + e — = MnО2 |2 окислитель, процесс восстановления
SO3 2- + 2OH — — 2e — = SO4 2- + H2O |1 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
Необходимо отметить, что не всегда при наличии окислителя и восстановителя, возможно самопроизвольное протекание ОВР. Поэтому для количественной характеристики силы окислителя и восстановителя и для определения направления реакции пользуются значениями окислительно-восстановительных потенциалов.
Еще больше примеров составления окислительно-восстановительных реакций приведены в разделе Задачи к разделу Окислительно-восстановительные реакции. Также в разделе тест Окислительно-восстановительные реакции
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Сера и её оксиды: решение задач методом электронного баланса
Подробно решение уравнений окислительно-восстановительных реакций (ОВР) методом электронного баланса разобраны на странице «Метод электронного баланса».
Ниже приведены примеры уравнений окислительно-восстановительных реакций серы и её оксидов (См. сера и её соединения).
Если в окислительно-восстановительной реакции принимают участие простые вещества, молекулы которых состоят из двух или более атомов элементов, то в электронном балансе кол-во отданных и полученных электронов определяют с учётом кол-ва атомов в молекуле: H2 0 -2e — → 2H +1 .
Видео:Окислительно-восстановительные реакции. 1 часть. 9 класс.Скачать

Уравнения окислительно-восстановительных реакций серы
1. Уравнение реакции серы с кислородом (S+O2) — получение сернистого ангидрида (SO2):
2. Уравнение реакции получения серной кислоты H2SO4:
3. Уравнение реакции серы с водородом (S+H2) — получение сероводорода (H2S):
4. Уравнение реакции серы с алюминием (S+Al) — получение сульфида алюминия Al2S3:
5. Уравнение реакции серы с натрием (S+Na) — получение сульфида натрия Na2S:
6. Уравнение реакции серы с железом (S+Fe) — получение сульфида железа FeS:
7. Уравнение реакции серы с хлоратом калия:
8. Уравнение реакции серы с серной кислотой:
Три молекулы оксида серы получаются в результате суммирования катионов серы из первой и второй схем электронного баланса: S +4 +2S +4 =3S +4 .
9. Уравнение реакции серы с оксидом азота:
10. Уравнение термической реакции серы с концентрироанной азотной кислотой:
11. Уравнение реакции серы с нитратом калия:
12. Уравнение реакции серы с оксидом хрома (III):
13. Уравнение реакции серы с дихроматом калия:
14. Уравнение реакции серы с перманганатом калия:
15. Уравнение реакции серы с надпероксидом калия:
16. Уравнение реакции серы с пероксидом натрия:
17. Уравнение термической реакции серы с гидроксидом натрия:
18. Уравнение реакции оксида серы (IV) с хлорной кислотой:
19. Уравнение реакции оксида серы (IV) с перманганатом калия в щелочной среде:
20. Уравнение реакции оксида серы (IV) с перманганатом калия в нейтральной среде:
21. Уравнение реакции оксида серы (IV) с диоксидом селена:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Видео:Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 1ч. 10 класс.Скачать

Химия
План урока:
Видео:8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Основные термины
Если реакция рассматривается как ОВР-процесс, в ней обязательно присутствует окислитель и восстановитель.
- восстановитель – атом в составе простой или сложной молекулы, отдающий электроны. Степень окисления становится меньше.
- окислитель – атом в составе простой или сложной молекулы, принимающий электроны.
Видео:ОВР для чайников — Как определить Окислитель и Восстановитель #shorts #youtubeshortsСкачать

Характеристика окислителей
Это все неметаллы, кислоты, пероксиды и некоторые соли. Способность отщеплять электроны изменяется в зависимости от положения элемента в таблице Менделеева: в периоде увеличивается слева направо, в группе – с низу вверх. Самым сильным окислителем считается фтор. Так же, к этой группе относятся высшие оксиды элементов. Сила способности отнять электроны сложных веществ зависят от степени окисления нужного атома и от концентрации.
Такие свойства выражаются стандартным электродным потенциалом. Чем он выше, тем выше окислительные свойства. Все окислители делятся на четыре группы.
Таблица. Группы окислителей и их характеристика
Видео:Химия 9 класс — Как определять Степень Окисления?Скачать

ОВР кислот
От растворимости зависят свойства азотной и серной кислот.
Чем ближе концентрация HNO3 к 100%, тем больше электронов получит азот.
Продукты реакции, также, зависят от положения металла в ряду активности.
Таблица. Продукты реакции разбавленной и концентрированной азотной кислоты с металлами с различной активностью.
- Благородны металлы не реагируют с этой кислотой ни при каких условиях.
- Al, Cr и Fe реагируют с безводным окислителем только при нагревании.
H2SO4
Серная кислота одно из сильных веществ, отнимающих электроны. Продукт реакции, так же, как и с азотной, зависят от концентрации кислоты и активности первоначального металла. Растворимая серная кислота не дает специфических продуктов и реагирует только с металлами до водорода в ряду активности. При этом, образуется соль металла и водород:
Продукты H2SO4(конц.) с металлами перечислены в таблице.
Таблица. Продукты реакции концентрированной серной кислоты с металлами с различной активностью.
Зависимость окисления от реакционной среды
ОВР может проходить в щелочной, нейтральной или кислой среде. При этом, один и тот же атом может проявлять разные свойства. Ярким примером являются реакции KMnO4и K2Cr2O7
Особенности KMnO4 как окислителя
Перманганат калия или натрия способен проявлять только окислительные свойства за счет иона Mn +7 . В реакциях с ним всегда используется вещество, определяющее кислотность среды, не участвующее в ОВР-процессе. Им может быть:
- H2SO4 (формирует кислую среду)
- H2O (нейтральная)
- NaOH или KOH (щелочная среда).
Таблица. Продукты реакции перманганата калия в зависимости от реакционной среды.
Особенности K2Cr2O7 как окислителя
Бихромат калия – один из распространенных веществ с указанными свойствами, продукты восстановления которого, так же, зависят от среды.
Таблица. Продукты реакции перманганата калия в зависимости от кислотности среды.
Видео:Окислительно-восстановительные реакции. Метод электронно-ионного баланса.Скачать

Запись ОВР процесса
При отображении такого процесса записывают не только реакцию, но и преобразования окислителя и восстановителя. Так, первая строчка – само уравнение c расставленными степенями окисления:
H + 2S 2- + Cl 0 2 = S 0 + 2H + Cl —
Если у элемента н изменилась степень окисления, он не является участником ОВР (у нас это водород)
Далее записывается процесс его восстановления:
S 2- – 2е → S 0 (окислитель, восстановление)
Cl 0 2 + 2е →2 Cl — (восстановитель, окисление)
Видео:89. Как расставить коэффициенты реакции методом электронного баланса (закрепление)Скачать

Уравнивание ОВР-реакций
Одним из самых сложных действий в написании ОВР является уравнивание молекул. Существует два способа: метод электронного баланса и метод электронно-ионного баланса (полуреакций).
Метод электронного баланса
Метод основан на определении баланса между количеством отданных и принятых электронов:
Al 0 + Cu +2 S +6 O4 -2 → Al +3 2(S +6 O4 -2 )3 + Cu 0
В ходе процесса изменяются степени окисления двух элементов – Alи Cu, с которыми работаем в первую очередь. Алюминий отдает электроны и превращается в ион Al +3 . Он окисляется в ходе реакции. Ион меди, принимая два электрона, восстанавливается, степень окисления меди изменяется от +2 до 0. Изменения степеней окисления можно выразить электронными уравнениями:
Al 0 – 3e → Al +3 (окисление)
Cu +2 + 2e → Cu 0 (восстановление)
Количество принятых и переданных электронов должно быть одинаковым. Поэтому: умножаем цифры между собой (находим общее кратное): 3×2=6.
Если разделить общее кратное на число переданных алюминием электронов(6/3=2), то найдем коэффициент перед этой молекулой в уравнении (ставим перед Al).
То же действие позволит найти коэффициент для второго реагента: 6/2=3 (ставим перед Cu).
В результате получаем основные цифры в записи реакции:
Если в уравнении больше реагентов и продуктов, остальные находятся математическим уравниванием.
Проверку правильности коэффициентов всегда осуществляем по кислороду.
Метод полуреакций
Чтобы уравнять и написать уравнение методом полуреакций, нужно использовать определенный алгоритм:
- Записать реагенты: K2Cr2O7+ H2SO4+ H2S
- Определить окислитель и восстановителя
- Записывают процесс окисления и восстановления с учетов преобразования всех атомов молекул: Cr2O7 2− + 14H + + 6e − = 2Cr 3+ + 7H2O * 1
- Записывают продуты образования окислителя и восстановителя с учетов коэффициентов (из формул): 2Cr 3+ и S
- Сгруппировать остальные атомы в продукты (дополнительное ионное взаимодействие между средообразующей молекулой и реагентом. Чаще всего – соль): K2SO4
- Собирать полный процесс: K2Cr2O7+ 4H2SO4+ 3H2S = Cr2(SO4)3 + 7H2O + 3S(т) + K2SO4
- Проверить правильность коэффициентов по кислороду.
Видео:Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Виды уравнений окислительно-восстановительных реакций
Окислитель и восстановитель не всегда находятся в разных молекулах. Иногда это один атом, участвующий сразу в двух процессах или разные молекулы с одним и тем же элементом и т.д. в зависимости от этого выделяют несколько вариантов ОВР:
- Межмолекулярные
Окислитель и восстановитель являются разными молекулами.
Mn +7 + 5 ē → Mn +2 – 5 – 2 (окислитель восстанавливается)
2 I -1 – 2 ē → I2 0 – 2 – 5 (восстановитель окисляется)
- Внутримолекулярные
Внутримолекулярные– взаимодействия, в которых окислитель и восстановитель находятся в одной молекуле.
2 Cr +6 +6 ē → 2 Cr +3 – 6 – 1 (окислитель восстанавливается)
2 N -3 – 6 ē → N2 0 – 6 – 1 (восстановитель окисляется)
Атомы с противоположными свойствами находятся в одной молекуле
- Реакция диспропорционирования
Диспропорционирование – ОВР, в котором и оба свойства проявляет один и тот же атом, образуя несколько продуктов с разными степенями окисления.
Cl2 0 + 2 NaOH → NaCl — + NaCl + O + Н2О
Cl2 0 + 2 ē → 2 Cl — — 2 – 1 (окислитель восстанавливается)
Cl2 0 — 2 ē →2 Cl + — 2 – 1 (восстановитель окисляется)
- Реакция репропорционирования
Репропорционирование – противоположный процесс, когда один элемент из разных состояний переходит в одно.
S -2 + 4 ē → S 0 – 4 – 1 (окислитель восстанавливается)
S +4 — 2 ē → S 0 – 2 – 2 (восстановитель окисляется)
Общее кратное коэффициентов – 2. т.о., у соединений первой серы (S -2 ) коэффициент 1, а у соединений второй серы (S +4 ) – коэффициент 2.
При кажущейся сложности, ОВР-процессы одни из самых распространенных в природе. Например – ржавление железа, скисание молока и даже дыхание являются примерами этих процессов.
📺 Видео
ОВР и метод электронного баланса | Химия ОГЭ 2023 | УмскулСкачать

Окислительно-восстановительные реакции. 3 часть. 9 класс.Скачать

Как расставлять коэффициенты в химических реакциях | ОВР | Метод электронного баланса, Химия ЕГЭ, ЦТСкачать

Химия, 9 класс, тема "Окислительно-восстановительные реакции" (учитель Швецова Елена Евгеньевна)Скачать

Задание 20. ОВР и метод электронного баланса - пойми, как это работает | Химия ОГЭ 2023Скачать

Расстановка коэффициентов в окислительно-восстановительных реакцияхСкачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Метод электронного баланса. Окислительно-восстановительные реакции. 1 часть. 11 класс.Скачать
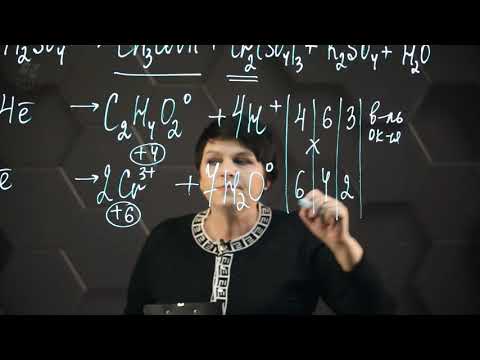
Окислительно-восстановительные реакции с нуля!| Екатерина Строганова | 100балльный репетиторСкачать
