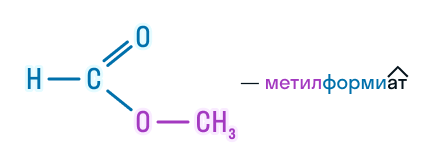Сложные эфиры: способы получения, химические и физические свойства, строение.
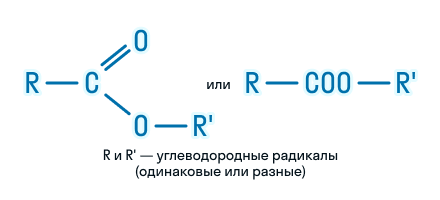
| Сложные эфиры – это органические вещества, в молекулах которых углеводородные радикалы соединены через карбоксильную группу -СОО-, а именно R1-COOH-R2. |
Общая формула предельных сложных эфиров: СnH2nO2
- Классификация сложных эфиров
- По числу карбоксильных групп:
- Номенклатура сложных эфиров
- Химические свойства сложных эфиров
- 2. Переэтерификация
- 3.Восстановление сложных эфиров
- Получение сложных эфиров
- 1. Этерификация карбоновых кислот спиртами
- 2. Соли карбоновых кислот с галогеналканами
- Органическая химия в уравнениях реакций
- Просмотр содержимого документа «Органическая химия в уравнениях реакций»
- Сложные эфиры
- Номенклатура сложных эфиров
- Изомерия сложных эфиров
- Физические свойства сложных эфиров
- Химические свойства сложных эфиров
- Способы получения сложных эфиров
- Нахождение сложных эфиров в природе и применение
- 💡 Видео
Видео:Составление уравнений реакций. 1 часть. 10 класс.Скачать
Классификация сложных эфиров
Видео:Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 1ч. 10 класс.Скачать

По числу карбоксильных групп:
- сложные эфиры одноосновных карбоновых кислот — содержат одну карбоксильную группу -СОО-. Общая формула CnH2nO2.
| Например, метилформиат |
- сложные эфиры многоатомных спиртов — содержат две и более карбоксильные группы -СОО-.
| Например, тристеарат глицерина |
- Сложные эфиры многоосновных органических кислот.
Например, общая формула сложных эфиров двухосновных карбоновых кислот CnH2n-2O4
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Номенклатура сложных эфиров
В названии сложного эфира сначала указывают алкильную группу, связанную с кислородом, затем кислоту, заменяя суффикс в названии кислоты (-овая кислота) на суффикс -оат.
| Название сложного эфира | Тривиальное название | Формула эфира |
| Метилметаноат | Метилформиат | HCOOCH3 |
| Этилметаноат | Этилформиат | HCOOC2H5 |
| Метилэтаноат | Метилацетат | CH3COOCH3 |
| Этилэтаноат | Этилацетат | CH3COOC2H5 |
| Пропилэтаноат | Пропилацетат | CH3COOCH2CH2CH3 |
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Химические свойства сложных эфиров
| Сложные эфиры устойчивы в нейтральной среде, но легко разлагаются при нагревании в присутствии кислот или в присутствии щелочей. |
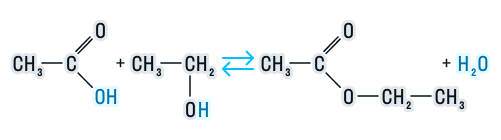
В присутствии кислот гидролиз сложных эфиров протекает как реакция, обратная этерификации. при гидролизе сложных эфиров образуются спирты и карбоновые кислоты.
R-COO-R’ + H2O = R-COOH + R’-OH
Например , при гидролизе метилацетата образуются уксусная кислота и метанол.
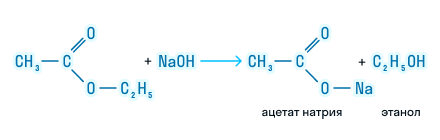
При щелочном гидролизе сложных эфиров образуются соли карбоновых кислот и спирты.
Например , при щелочном гидролизе этилформиата образуются этанол и формиат натрия:
При щелочном гидролизе этилацетата образуются ацетат и этанол:
Щелочной гидролиз сложных эфиров — реакция, имеющая промышленное значение. Гидролиз жиров в присутствии оснований — древнейший способ получения мыла. Первые способы получения мыла связаны со смешиванием жира с золой. Один из основных компонентов животного жира — тристеарат глицерина. В щелочной среде тристеарат глицерина разлагается на глицерин и соль стеариновой кислоты:
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

2. Переэтерификация
Переэтерификация — это реакция превращения одного сложного эфира в другой под действием соответствующих спиртов в присутствии катализатора (кислоты или основания)
R-COO-CH3 + R’-OH = R-COOR’ + CH3-OH
Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

3.Восстановление сложных эфиров
Сложные эфиры восстанавливаются с разрывом связи С-О карбоксильной группы. При этом образуется смесь спиртов.
| Например, этилбензоат восстанавливается литийалюминийгидридом до бензилового спирта и этанола |
Видео:Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

Получение сложных эфиров
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

1. Этерификация карбоновых кислот спиртами
Карбоновые кислоты вступают в реакции с одноатомными и многоатомными спиртами с образованием сложных эфиров.
| Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты): |
Видео:ВСЯ ХИМИЯ 10 КЛАСС ОВР в нейтральной среде / Метод полуреакций WannaBeTeacher Усенов УланСкачать

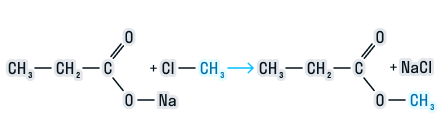
2. Соли карбоновых кислот с галогеналканами
При взаимодействии солей карбоновых кислот с галогеналканами образуются сложные эфиры.
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Органическая химия в уравнениях реакций
«Шпаргалки. Химия» — это краткие изложения основных вопросов по курсу органической химии за 10 класс , которые можно использовать для повторения и закрепления пройденного материала по органической химии при подготовке к ЕГЭ Весь материал можно распечатать в виде шпаргалок.
Просмотр содержимого документа
«Органическая химия в уравнениях реакций»
Реакции к основным темам курса 10 класса (для запоминания), проф. класс.
2. р. нитрования – р. Коновалова (р. замещения, радик. мех-зм): R-Н +НО – NО2(разб) −→R—NО2 +Н2 внимание: замещение атомов водорода у третичного атома (—с—) проходит легче, чем у вторичного атома(—с—) и тем более первичного атома (с—).
. р. окисления метана ( +[О]) даёт продукты, в зависимости от условий:
2. р. замещения – аналогично алканам (циклы с 6 и атомами углерода);
5. Алкины (непредельные). Общая формула – СпН2п-2. М (СпН2п-2)= (14п-2) г/моль, σ- и 2π-связи, SP-гибридизация, линейное строение обладают слабыми кислотными свойствами
только ацетилен СН≡СН + НОН →СН3-СНО — альдегид
при нагревании, в присутствии катализатора – Pt, Pd продолжение см дальше
5.слабые кислотные свойства у алкинов с «концевой» кратной связью:
6
в) алкилирование — р. Фриделя-Крафтса – удлинение цепи атомов углерода
помнить: у гомологов бензола замещение в цикле атомов водорода происходит с равной вероятностью в положении 2, 4, 6 относительно имеющегося радикала в присутствии катализаторов FeBr3 и H2SO4.
б
в
Наличие гидроксогруппы — ОН в молекулах спиртов проявляется в слабых кислотных и основных свойств.
2. слабые основные свойства, возрастающие от первичных к третичным спиртам:
3. р. этерификации – взаимодействие с кислотами и образование сложных эфиров:
а) при t 150 0 С – внутримолекулярная (Н2О отрывается от 1 молекулы):
б) при t 0 С – межмолекулярная (Н2О отрывается от 2 молекул):
Различные классы спиртов дегидратируются при различных условиях:
7. качественные реакции на: а) предельные одноатомные спирты – CuO, t
1. подвижность атома водорода и выраженные кислотные свойства –
3. р. электрофильного замещения протекают легче, чем у аренов:
а) реакция с раствором бромной воды – 1-я качественная реакция на фенолы
в) получение фенолформальдегидной смолы – р. поликонденсации
4. реакция с раствором FeCl3 – 2-я качественная реакция на фенолы
Внимание: водород легко присоединяется по связи С=С и очень трудно – по связи С=О. LiAlH4 восстанавливает связи С=О до С – ОН, не затрагивая связь С=С.
1. Химические свойства отличаются от свойств альдегидов:
а) менее активны в реакциях нуклеофильного присоединения, чем альдегиды (с цианидом водорода в присутствии цианида калия) R – С=О + НСN − KCN → R – C (OH) – C ≡ N;
б) присоединение реактива Гриньяра – R – MqBr с образованием третичного спирта
г) окисление с трудом, не взаимодействуют с соединениями серебра и меди
2. Иодоформный тест – если карбонильная группа связана со 2-ым атомом углерода от конца углеродной цепи (со щелочным раствором иода)
1. Диссоциируют, т.е. являются донором катиона водорода – слабые электролиты, самая сильная из них – муравьиная НСООН
R – СООН ↔ R – СОО — + Н +, сл-но, характерны свойства, типичные для кислот – взаимодействие с Ме, основными оксидами, основаниями и солями слабых кислот.
2. р.замещения группы ОН на хлор, взаимодействие с хлоридом Р(V)
R – СООН + Н – О – СО – R — Р2О5 → R – СО – О – СО — R + Н2О (ангидрид к-ты),
остаток кислоты ↓ остаток спирта
5. получение амидов в реакциях с раствором аммиака, при нагревании
6. р. замещения атома водорода у α–атома (С) на атом брома, в присутствии Ркр
7. р. дегидратации и гидрирование, в присутствии LiAlH4 (см. «альдегиды»)
8.Внимание: муравьиная кислота – самая сильная из органических кислот и сильный восстановитель,
9. Получение: а) из спиртов (окисление, т.е. + [О])
R – СН2 – ОН + [О] → R – СНО (альдегид) и дальше + [О] → R – СООН (кислота);
б) из альдегидов – р. «серебряного и медного зеркала»
6. Сложные эфиры карбоновых кислот. Общая формула – R-С = О
р. гидролиза с Н2О идёт медленно, её катализируют (ускоряют) кислоты и щёлочи
2. р. восстановления, в присутствии LiAlH4 с образованием 2-х спиртов:
особенность: медленная реакция, обратимая, с низким выходом.
Хлорангидриды и ангидриды кислот
Эти два вида производных карбоновых кислот химически очень активны. Хлорангидриды даже более активны, чем ангидриды, и более летучи, что делает обращение с ними очень трудным. Они вступают в быструю реакцию на холоде с водой, аммиаком и с их производными, спиртами и аминами. В каждом случае атом водорода реагирующей молекулы замещается ацильной группой – это реакции ацилирования, а хлорангидриды и ангидриды кислот-ацилирующие агенты. С хлорангидридами:
↑ этот атом водорода замещается на ацильную группу.
С ангидридами кислот:
2. р. восстановления до многоатомных спиртов:
3. синее окрашивание с Си(ОН)2, как у многоатомных спиртов;
4. р. межмолекулярной дегидратации со спиртами: → простые эфиры;
5. р. этерификации с альдегидами → сложные эфиры;
1. Амины обладают основными свойствами, поэтому, как основания,
3. Р. нитрирования (с НО – NО) проходит по-разному:
9. Азотсодержащие соединения – аминокислоты …β α Мr (к-ты) = (14п+75)
Общая формула – R – СН — СООН
1.Аминокислоты обладают амфотерными свойствами, поэтому реагируют:
4. Получение: α- аминокислоты из α-хлорзамещенных карбоновых кислот
Окислительно – восстановительные реакции в органической химии.
Видео:Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Сложные эфиры
О чем эта статья:
Для начала дадим определение и разберемся, почему эти эфиры — сложные.
Сложные эфиры или эсте́ры (от древнегреческого αἰθήρ — «эфир») — это класс соединений на основе неорганических (минеральных) или органических (карбоновых) одно- или многоосновных кислот, у которых атом водорода в гидроксогруппе замещен на радикал. Эпитет «сложные» они получили для того, чтобы их не путали с простыми эфирами — производными спиртов.
Общая формула сложных эфиров выглядит так:
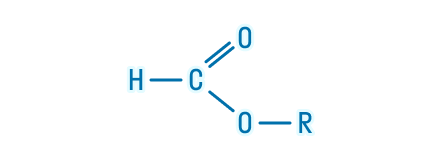
Однако представители сложных эфиров муравьиной кислоты выглядят иначе. Для них общая формула приобретает такой вид:
Видео:Получение алканов. Реакция Вюрца (механизм + сложные случаи). ЕГЭ по химии.Скачать

Номенклатура сложных эфиров
Теперь поговорим о том, как называть представителей данного класса. Различают два способа, позволяющие назвать сложные эфиры: по систематической номенклатуре (ИЮПАК) или по рациональной номенклатуре. Рассмотрим оба варианта.
По номенклатуре ИЮПАК название строится следующим образом:
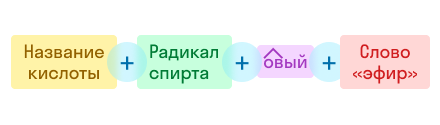
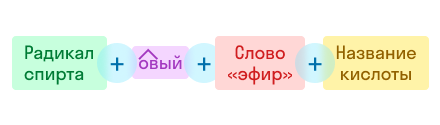
По рациональной номенклатуре название строится так:
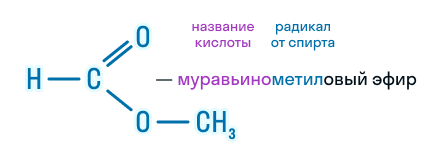
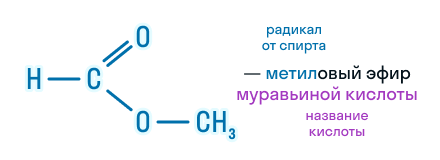
По этой же номенклатуре эфиры можно называть, используя четыре слова: радикал спирта + слово «эфир» + название кислоты + слово «кислота». Например, муравьинометиловый эфир можно иначе назвать метиловый эфир муравьиной кислоты:
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

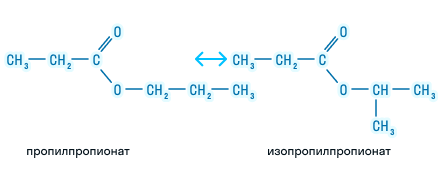
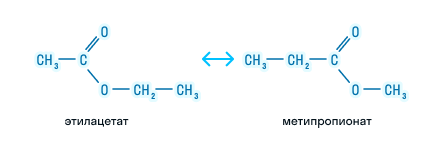
Изомерия сложных эфиров
Возможна ли изомерия для сложных эфиров? Давайте разбираться.
Возможна изомерия углеродного скелета у радикала кислоты и радикала спирта при наличии трех и более углеродных атомов.
Изомерия положения функциональной группы:
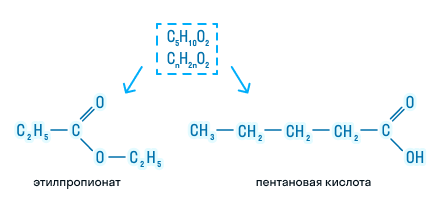
Межклассовая изомерия также определяется общей формулой органических соединений. Например:
Видео:Урок 10. Сложные уравнения и неравенства. Решение уравнений высоких степеней. Вебинар | МатематикаСкачать

Физические свойства сложных эфиров
Агрегатное состояние сложного эфира напрямую зависит от молекулярной массы образующих его кислоты и спирта. Так, например, сложные эфиры низших и средних гомологов являются летучими жидкостями с характерным запахом. Чаще всего у них фруктовые или плодовые ароматы. Сложные эфиры хуже растворяются в воде, чем образующие их кислоты и спирты. Чем больше атомов углерода в составе сложного эфира, тем хуже его растворимость в воде.
Эфиры высших карбоновых кислот и высших одноатомных первичных спиртов — основа природного воска. Например, известный пчелиный воск — это сложный эфир пальмитиновой кислоты (C15H31COOH) и мирицилового спирта (С31H63OH).
Видео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Химические свойства сложных эфиров
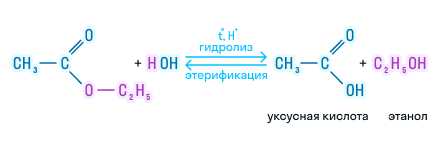
Сложные эфиры подвергаются гидролизу (разложению под действием воды), который бывает двух видов: в кислой среде и в щелочной. Рассмотрим каждый из этих видов.
В кислой среде реакция протекает следующим образом:
Эта реакция обратима, так как образующиеся в процессе кислота и спирт подвергаются взаимодействию с образованием этого же сложного эфира. Обратная реакция имеет название реакция этерификации.
Щелочной гидролиз или реакция омыления:
Этот вид гидролиза протекает необратимо, так как образовавшаяся в ходе реакции соль не может реагировать со спиртом.
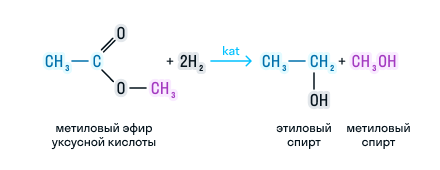
Сложные эфиры можно восстановить водородом в присутствии катализатора до двух спиртов. Причем один из спиртов будет иметь в составе столько атомов углерода, сколько было в кислоте, а во втором спирте количество углерода будет соответствовать исходному спирту. Рассмотрим на примере:
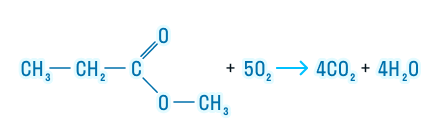
Эфиры подвергаются полному окислению, то есть горят с образованием углекислого газа и воды:
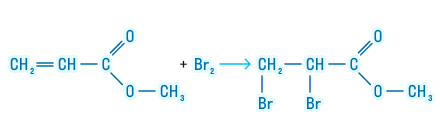
Следующее химическое свойство относится только к тем сложным эфирам, которые образованы непредельной карбоновой кислотой. Сложные эфиры таких кислот могут подвергаться галогенированию. Посмотрим, как происходит эта реакция:
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Способы получения сложных эфиров
Реакция обратимая, поэтому требуется либо избыток одного из реагентов, либо отгонка образующегося сложного эфира, чтобы предотвратить обратную реакцию гидролиза.
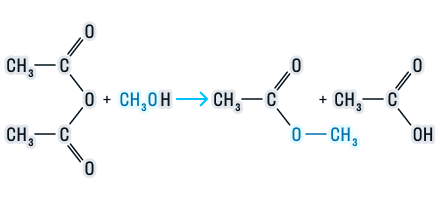
Взаимодействие ангидрида карбоновой кислоты со спиртом с образованием сложного эфира и карбоновой кислоты.
Взаимодействие солей карбоновых кислот с галогеналканами.
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Нахождение сложных эфиров в природе и применение
Сложные эфиры широко представлены в природе, но их количество минимально. Они участвуют в процессах, которые протекают в живых организмах, а также являются компонентами аромата ряда растений.
Некоторые эфиры получают искусственным способом. Например, за грушевый вкус в лимонаде отвечает уксусноизоамиловый эфир, а за яблочный — изовалерианоэтиловый эфир.
Помимо пищевой промышленности, сложные эфиры применяют в качестве растворителей для приготовления лаков, а также как пластификаторы для приготовления пластических масс.
Сложные эфиры на основе ароматических спиртов нашли применение в парфюмерной промышленности.
💡 Видео
Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Уравнивание реакций горения углеводородовСкачать