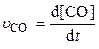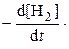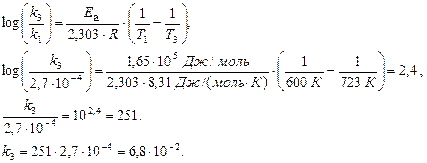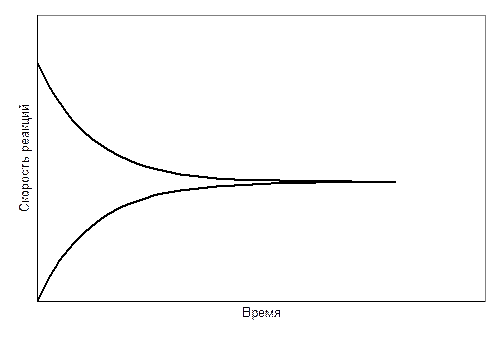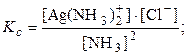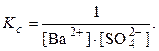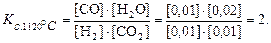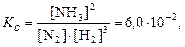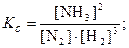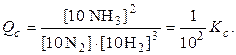Скорость и равновесие
Химических реакций
Скорость химических реакций. Общие понятия.
Кинетика гомогенных реакций
Химические реакции очень сильно различаются по скорости. Одни из них протекают за доли секунды (реакции при взрыве), а другие – в течение многих лет (процессы в недрах Земли). Это связано с разным механизмом химических реакций. Раздел химии, который изучает скорость и механизм химических реакций, называется химической кинетикой.
При изучении кинетики химических реакций учитывают фазовый состав систем, в которых они протекают. По агрегатному состоянию реагентов различают газофазные, жидкофазные и твердофазные реакции. Реакции могут протекать в одной фазе или на границе фаз. Соответственно выделяют гомогенные и гетерогенные реакции.
Гомогенные химические реакции протекают в пределах одной фазы. Примерами гомогенных реакций могут быть любые реакции в смесях газов или в растворах.
Гетерогенные химические реакции протекают на границе раздела фаз. Например, реакции на границе твердое–газ, твердое–жидкое, твердое–твердое, жидкое–газ, жидкое–жидкое. Так, реакция растворения металла в кислоте является гетерогенной.
Знакомство с кинетикой химических реакций начнем с гомогенных реакций. В данном разделе будем рассматривать преимущественно химические реакции, протекающие в газовой фазе.
Одними из основных понятий кинетики химических реакций в газах и растворах являются их скорость и зависимость скорости от концентраций реагирующих веществ.
Скорость химической реакции (u) выражается изменением концентрации какого-либо из участвующих в ней веществ в единицу времени.
Допустим, задана реакция
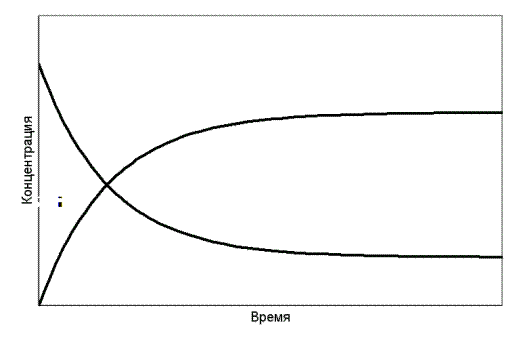
Вещества взаимосвязаны уравнением реакции. Поэтому скорость реакции можно измерить по изменению концентрации любого реагента, включая исходные вещества или продукты реакции. На рис. 7.1 схематически показано изменение концентраций исходных веществ и продуктов конкретной реакции. Концентрации обозначены химическими формулами веществ в квадратных скобках.
Допустим, скорость реакции выражается через изменение концентрации СО, D[CO], за интервал времени Dt:
Величина 
Поскольку зависимость [CO] от t не является прямолинейной, то таким путём можно определить только среднюю скорость для ограниченного интервала времени Dt . Графически это означает, что кривую линию на некотором участке принимаем в качестве прямой, проводя касательную к точке а, расположенной на середине выбранного участка кривой. Если интервалDt ® 0, то получаем истинную скорость реакции в точке а, она выражается производной концентрации по времени:

Рис. 7.1. Изменение концентраций реагентов и продуктов реакции
во времени(реагенты взяты в эквимолярных количествах)
Отрицательный знак в выражении для uH2необходим для сохранения положительного знака у скорости реакции в условиях, когда концентрация реагента уменьшается в ходе реакции. Таким образом, при одинаковом времени с начала реакции

Однако такая зависимость выполняется, по меньшей мере, в том случае, когда в уравнении реакции эти вещества имеют равные коэффициенты, в соответствии с которыми они вступают во взаимодействие. Допустим, химическая реакция выражается в общем виде уравнением
В этом случае вероятно соотношение

Анализ приведенных зависимостей показывает, что скорость реакции зависит от концентраций реагирующих веществ. Именно градиент концентраций является движущей силой для химических реакций (рис. 7.1). Количественно эти зависимости определяются кинетическим уравнением.
Если химическую реакцию представить в общем виде уравнением
то кинетическое уравнение для неё имеет вид
где k – константа скорости реакции; [A] и [B] – концентрации реагентов;, n и m – коэффициенты, устанавливаемые экспериментальным путем, они определяют порядок реакции.
Коэффициенты n и m в общем случае не равны стехиометрическим коэффициентам реакции. Совпадение между ними встречается весьма редко. Порядок реакции определяется ее механизмом. Константа k равна скорости химической реакции при условии, что все концентрации или парциальные давления газов (для реакций в газовой фазе) равны единице. Можно подобрать также равным единице их произведение.
С учетом сказанного кинетическое уравнение выражает зависимость скорости реакции от концентраций реагентов, взятых в степенях, значения которых определяются механизмом реакции.
Приведенное кинетической уравнение (7.2) выражает зависимость скорости реакции от концентрации реагентов для гомогенных реакций. Реагенты гомогенных реакций находятся в одной фазе, т.е. все они газы или растворенные вещества. Гетерогенные реакции протекают на поверхности раздела между фазами реагентов, например на поверхности твердого тела, выступающего в качестве одного из реагентов, а другие реагенты находятся в газовой фазе или в растворе. Кинетическое уравнение гетерогенной реакции включает в себя площадь поверхности твердого тела S и концентрацию реагента в поверхностном слое сS.
Так, для реакции
кинетическое уравнение имеет вид
где k – константа скорости гетерогенной реакции; n – порядок реакции по газообразному (или растворенному) компоненту.
Иным механизмам гетерогенных реакций соответствуют другие уравнения.
Температурная зависимость константы скорости.Проиллюстрируем ее конкретным примером.
Исследовали скорость разложения N2О5, растворенного в CCl4(ж), при различных температурах. При разложении идёт реакция
Получили следующие экспериментальные данные:
| Температура, °С | Константа скорости, с -1 |
| 3,44×10 5 | |
| 13,5×10 5 | |
| 49,8×10 5 | |
| 150×10 5 |
О б щ и й в ы в о д: каждое повышение температуры на 10 °С приводит к возрастанию величины k и соответственно uN2O5в 3–4 раза. Эту величину называют температурным коэффициентом скорости реакции.
Согласно правилу Вант-Гоффа
u2 = u1×g 
где u1 = u2 – скорости реакции при температурах соответственно t1 и t2 (при t2 > t1); g – температурный коэффициент скорости реакции. Для большинства реакций g находится в интервале от 2 до 4.
Казалось бы, скорость реакции должна быть прямо пропорциональна числу соударений реагирующих частиц. Но в действительности эта зависимость имеет более сложный характер. Не каждое соударение частиц приводит к их взаимодействию. Эффективными являются лишь те соударения, при которых частицы благоприятно ориентированы относительно друг друга и имеют энергию, превышающую некоторый минимальный уровень.
Минимальная энергия, которая необходима частицам для их активного соударения, приводящего к взаимодействию, называется энергией активации.
Количественная зависимость константы скорости реакции от температуры выражается уравнением Аррениуса:
где R – универсальная газовая постоянная; А – предэкспонентный множитель; Т – абсолютная температура (К).
В логарифмической форме уравнение Аррениуса становится уравнением прямой линии:
ln k = ln A – 
Наклон прямой, выражающей зависимость ln k от 1/Т, равен –Еа/ R, что позволяет вычислить величину Еа.
Комбинируя уравнения Аррениуса для двух температур: Т1 и Т2, можно привести их к форме, более удобной для практических расчетов:

Решение. Вычислим значение Еа, используя уравнение Аррениуса (7.7).
Химическое равновесие
Химические реакции подразделяют на необратимые и обратимые.
Необратимые реакции протекают только в одном направлении до полного взаимодействия взятых в стехиометрическом соотношении исходных веществ или до израсходования одного из реагирующих веществ, взятом в недостатке. Обычно в ходе необратимых реакций образуется малорастворимое соединение, которое выпадает в осадок, или малодиссоциирующее вещество, например Н2О, или выделяется продукт реакции в газообразном состоянии.
Примером может служить реакция нейтрализации сильного основания сильной кислотой:
Такую реакцию нельзя провести в обратном направлении без использования новых реагентов и без затрат энергии.
Однако известно множество обратимых реакций.
Обратимые реакции проявляют способность одновременно протекать в двух взаимно противоположных направлениях, т.е. в прямом и в обратном согласно
Возвратимся к рис. 7.1. Обратим внимание на ход зависимостей при больших значениях времени прохождения реакции. Концентрации реагентов и продуктов реакции становятся постоянными. Наступает химическое равновесие.
Природа химического равновесия требует специального обсуждения. Но первые представления о равновесном состоянии системы даёт сопоставление скоростей прямой и обратной реакций.
Ещё раз обратимся к уравнению реакции
Сразу же после смешения реагентов начинается реакция. Скорость реакции в начальный момент времени максимальная, а затем понижается по мере уменьшения концентрации исходных веществ. Концентрация же продуктов реакции в начальный момент времени нулевая. Затем их концентрация начинает повышаться, что приводит к взаимодействию между ними, т.е. к реакции в обратном направлении.
Скорость обратной реакции постепенно возрастает. В конечном итоге скорости прямой и обратной реакций становятся равными и наступает химическое равновесие.Изменение скоростей прямой и обратной реакции во времени схематически показано на рис. 7.7.
Следовательно, химическое равновесие – это состояние, которое достигает реакционная смесь, когда скорости прямой и обратной реакций становятся равными.
Состояние химического равновесия обозначают в уравнении химической реакции знаком 
Н2О(г) + СО(г) 
Химическое равновесие имеет динамический характер. Прямая и обратная реакции при равновесии не прекращаются, но идут с равными скоростями, что сохраняет на постоянном уровне концентрации реагентов и продуктов.
Норвежские исследователи К. Гульдберг и П. Вааге в 1864 г. сформулировали закон действующих масс, который даёт общее описание условий равновесия. Под термином «действующие массы» авторы закона понимали «концентрации».
Рассмотрим закон действующих масс на примере реакции
aА + вВ 
Допустим, что стехиометрические коэффициенты в уравнении реакции равны порядкам реакции по соответствующим веществам, тогда уравнения скорости прямой и обратной реакции будут иметь вид
k1и k–1– константы скорости прямой и обратной реакции соответственно.
В условиях химического равновесия
Соответственно приходим к выражению константы равновесия
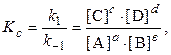
где Kс– концентрационная константа равновесия, т.к. она выражена через равновесные концентрации реагирующих веществ; подстрочный индекс с образован от англ. concentration.
Полученное выражение показывает также, что константа равновесия равна отношению констант скоростей прямой и обратной реакций.
Для состояния равновесия порядок реакций не имеет значения. Несмотря на то, совпадают ли стехиометрические коэффициенты с порядком реакции или нет, в выражении константы равновесия концентрации веществ приводятся в степенях, равных стехиометрическим коэффициентам.
Таким образом, константа равновесия равна отношению, в числитель которого входит произведение равновесных концентраций продуктов реакции, а в знаменатель – произведение концентраций исходных веществ, при этом все значения концентраций берутся в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
С учетом введенных понятий возвратимся к обсуждению закона действующих масс.
Закон действующих массутверждает, что константа равновесия реакции есть величина постоянная при определенной температуре и не изменяется, если в её выражение подставляются любые равновесные концентрации реагирующих веществ.
Смешивая реагенты, можно задать любое их соотношение и любые концентрации. Соответственно равновесные концентрации веществ также будут разные. Но отношение, выражающее константу равновесия, для данной реакции останется постоянным (при постоянной температуре).
Физические состояния веществ при химических реакциях могут быть самые разнообразные. Если все реагирующие вещества находятся в одной фазе, например все они газы или все растворенные вещества, то такие системы относятся к гомогенным.
Равновесие в гомогенных системах называютгомогенным равновесием.
Выражение константы гомогенного равновесия записывают именно так, как было рекомендовано ранее (уравнения (7.18) и (7.19)).
П р и м е р: для реакции
Н2(г) + СО2(г) 
выражение константы равновесия записывается следующим образом:
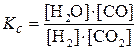
N2(г) + 3Н2(г) 
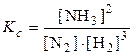
Ag + (р) + 2NH3(р) 
В том случае, когда реагирующие вещества образуют более чем одну фазу, устанавливается гетерогенное равновесие.
СО2(г) + С(к) 
С – углерод (графит) – находится в твердом состоянии, а остальные вещества – в газообразном. Уравнение выражает гетерогенное равновесие. Концентрация графита, как чистого вещества, остаётся в объеме твердого тела постоянной вплоть до его полного израсходования в химической реакции. Как постоянную её целесообразно включить непосредственно в величину Kс. Отсюда выражение константы гетерогенного равновесия для данной реакции имеет вид
Так же поступают при описании гетерогенных равновесий в водных растворах. При этом не имеет значения, является ли твердое вещество исходным веществом или продуктом реакции.
AgCl(к) + 2NH3(р) 
Ba 2+ (р) + SO4 2– (р) 
При протекании химических реакций в водных растворах вода нередко является одним из реагирующих веществ. Обычно вода как растворитель находится в большом избытке по отношению к другим реагирующим веществам. В этих условиях изменением концентрации воды в растворе при прохождении химической реакции можно пренебречь. Если принять концентрацию воды постоянной, то её целесообразно включить в величину Kс.
С учетом сказанного для реакции
NH3(р) + H2O(ж) 
Концентрация воды не входит в выражение константы равновесия.
Представление о состоянии химического равновесия и понятие константы равновесия играют исключительно важную роль в химии. Если фактическое отношение концентраций продуктов реакции и исходных веществ в их смеси (Qс) не равно константе равновесия (Kс), то между веществами может произойти взаимодействие (т.е. химическая реакция в прямом или обратном направлении), которое будет продолжаться до тех пор, пока не наступит состояние химического равновесия. Равновесие – это предел, до которого может идти химическая реакция. Если оказалось так, что концентрации продуктов и исходных веществ в смеси изначально соответствуют их равновесным значениям, то в системе сразу же установится состояние динамического равновесия, при котором скорости прямой и обратной реакций будут равны друг другу.
Значения констант равновесия используют также при вычислении равновесных концентраций реагирующих веществ. Поскольку состояние равновесия – предел для прохождения реакции, то равновесные концентрации продуктов реакции характеризуют предельный выход реакции.
Рассмотрим некоторые простые примеры расчетов, связанные с химическим равновесием.
Пример 7.4. Рассмотрим химическую реакцию
Н2(г) + СО2(г) 
При 1120 °С установилось равновесие реакционной смеси. Значения равновесных концентраций веществ следующие:
Решение. Система гомогенная. Составим выражение константы равновесия, подставим в него известные величины и произведём вычисление.
Комментарий. Bысокие значения Kс свидетельствуют о том, что равновесие реакционной смеси устанавливается при избытке продуктов по сравнению с реагентами и, следовательно, реакция более полно идёт в прямом направлении. Именно при высоких значениях Kс числитель отношения больше знаменателя.
В данном примере Kс = 2, т.е. величина небольшая, но в условиях равновесия при 1120 °С некоторый избыток продуктов реакции по сравнению с исходными веществами достигается. При другой температуре результат может быть иным, т.к. Kс будет иметь другое значение.
Пример 7.5. Рассмотрим реакцию
Fe(к) + Cu 2+ (р) 
Для неё известна величина Kс,25°С= 3×10 26 . Определим, пойдет ли реакция, если исходные концентрации следующие: [Cu 2+ ] = 1×10 –10 M и [Fe 2+ ] = 0,1 M.
Решение.Вычислим величину Qси сравним её с величиной Kс.
Вывод: Qс Kc, то реакция идет в обратном направлении;
если Qc = Kc, то реакционная смесь находится в состоянии химического равновесия.
Величина Kc характеризует полноту прохождения химической реакции до достижения ею химического равновесия. Если Kc не очень сильно отличается от единицы, то химическое равновесие устанавливается при низком выходе продуктов реакции. Для повышения их выхода приходится целенаправленно изменять условия: концентрации веществ, давление, температуру. Выбор этих условий проводится в соответствии с принципом Ле Шателье.
Общая формулировка принципа Ле Шателье следующая: если на систему, находящуюся в состоянии химического равновесия, воздействовать извне, изменяя какой-либо из параметров (концентрацию, давление или температуру), определяющих положение равновесия, то в системе усилится то из направлений процесса, которое ослабляет влияние произведенного воздействия. Положение равновесия также сместится в направлении ослабления эффекта внешнего воздействия.
Далее рассмотрим на конкретных примерах применение принципа Ле Шателье для определения направления сдвига химического равновесия.
Роль концентрации веществ можно проанализировать, руководствуясь соотношением между Qc и Kc.
N2(г) + 3H2(г) 
Для нее концентрационная константа равновесия
Поскольку Kc Kс и химическое равновесие сдвигается в сторону обратной реакции.
Пример 7.6.Рассмотрим химическое равновесие
N2(г) + 3H2(г) 
Определим равновесные концентрации NH3 для двух равновесных смесей:
Во втором варианте концентрация N2 в равновесной смеси увеличена. Kс = 6,0×10 ‑2 при 525 °С.
Решение. Составим выражение для Kс, подставим в него известные величины, и произведем вычисления.
Первый вариант химического равновесия:
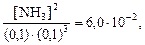
Второй вариант химического равновесия:

Вывод. При увеличении в равновесной смеси концентрации N2 (реагента) повышается концентрация NH3 (продукта реакции).
Роль давления. Влияние давления на химическое равновесие может проявляться в том случае, когда хотя бы один из участников реакции является газообразным веществом. Конечно, сказанное относится и к системам, где весь набор реагирующих веществ – газы. Для веществ в конденсированном состоянии (жидкости, твердые вещества) влиянием давления пренебрегают.
Изменение давления можно связать с изменением концентрации вещества. Согласно законам идеальных газов (раздел 8.2) соблюдается пропорциональность
P µ 

где Р – давление газа; V – объем газа; n – число молей газа; µ – знак пропорциональности.
Применим эти зависимости для предсказания направления сдвига химического равновесия под влиянием изменения давления при синтезе аммиака:
N2(г) + 3H2(г) 
При сжатии реакционной смеси газов в 10 раз (например в сосуде с поршнем) её объем уменьшается в 10 раз, а давление возрастает во столько же раз. Отразим эти изменения в выражении Qc.
Ранее было показано, что в условиях, когда Qc Kс и химическое равновесие сдвинется в сторону обратной реакции.
Если в уравнении химической реакции число молей газов одинаково в обеих частях, то изменение давления не скажется на состоянии химического равновесия.
П р и м е р такой ситуации:
N2(г)+ О2(г) 
Если все реагирующие вещества находятся в конденсированном состоянии, то изменение давления также не скажется на составе реакционной смеси.
Упрощенно можно сказать, что увеличение общего давления приводит к сдвигу химического равновесия в том направлении по уравнению реакции, где меньше молей газообразных веществ. Таким путём система при уменьшении своего объема стремится ограничиться меньшим количеством газа. При уменьшении общего давления обнаруживается противоположный эффект.
Температура широко используется для управления скоростью реакций и химическим равновесием. Прежде всего, достигается повышение скорости реакций с увеличением температуры, что сокращает время, необходимое для достижения химического равновесия. Далее, температура влияет на величину константы равновесия. Принцип Ле Шателье позволяет предсказывать направление сдвига равновесия в зависимости от знака теплового эффекта реакции.
Если в результате реакции происходит выделение теплоты q, то реакцию называют экзотермической, а если при реакции идет поглощение теплоты, то её называют эндотермической.
Согласно принципу Ле Шателье, при повышении температуры химическое равновесие сдвигается в сторону той реакции, прямой или обратной, которая происходит с поглощением теплоты, т.е. в сторону эндотермической реакции, а при понижении температуры – в сторону экзотермической реакции.
Так, реакция синтеза аммиака является экзотермической:
N2(г) + 3H2(г) 
Поэтому повышение температуры приведёт к сдвигу равновесия в сторону обратной реакции, которая будет эндотермической.
Несмотря на отрицательное влияние температуры на полноту прохождения экзотермической реакции, синтез аммиака производят при температурах около 450 °С. Именно при этой температуре лучше работает катализатор.
* Существует различие понятий «химически обратимые реакции» и «термодинамически обратимые реакции» (раздел 6.1).
Видео:Влияние концентрации на скорость химических реакций. 10 класс.Скачать

Химическая кинетика. Скорость химических реакций
Темы кодификатора ЕГЭ: Скорость реакции. Ее зависимость от разных факторов.
Скорость химической реакции показывает, как быстро происходит та или иная реакция. Взаимодействие происходит при столкновении частиц в пространстве. При этом реакция происходит не при каждом столкновении, а только когда частица обладают соответствующей энергией.
Скорость реакции – количество элементарных соударений взаимодействующих частиц, заканчивающихся химическим превращением, за единицу времени.
Определение скорости химической реакции связано с условиями ее проведения. Если реакция гомогенная – т.е. продукты и реагенты находятся в одной фазе – то скорость химической реакции определяется, как изменение концентрации вещества в единицу времени:
υ = ΔC / Δt
Если реагенты, или продукты находятся в разных фазах, и столкновение частиц происходит только на границе раздела фаз, то реакция называется гетерогенной, и скорость ее определяется изменением количества вещества в единицу времени на единицу реакционной поверхности:
υ = Δν / (S·Δt)
Видео:Химическая кинетика. Скорость химической реакции | ХимияСкачать

Факторы, влияющие на скорость химической реакции
Видео:Скорость химических реакций. 9 класс.Скачать

1. Температура
Самый простой способ изменить скорость реакции – изменить температуру . Как вам, должно быть, известно из курса физики, температура – это мера средней кинетической энергии движения частиц вещества. Если мы повышаем температуру, то частицы любого вещества начинают двигаться быстрее, а следовательно, сталкиваться чаще.
Однако при повышении температуры скорость химических реакций увеличивается в основном благодаря тому, что увеличивается число эффективных соударений. При повышении температуры резко увеличивается число активных частиц, которые могут преодолеть энергетический барьер реакции. Если понижаем температуру – частицы начинают двигаться медленнее, число активных частиц уменьшается, и количество эффективных соударений в секунду уменьшается. Таким образом, при повышении температуры скорость химической реакции повышается, а при понижении температуры — уменьшается .
Обратите внимание! Это правило работает одинаково для всех химических реакций (в том числе для экзотермических и эндотермических). Скорость реакции не зависит от теплового эффекта. Скорость экзотермических реакций при повышении температуры возрастает, а при понижении температуры – уменьшается. Скорость эндотермических реакций также возрастает при повышении температуры, и уменьшается при понижении температуры.
Более того, еще в XIX веке голландский физик Вант-Гофф экспериментально установил, что скорость большинства реакций примерно одинаково изменяется (примерно в 2-4 раза) при изменении температуры на 10 о С.
Правило Вант-Гоффа звучит так: повышение температуры на 10 о С приводит к увеличению скорости химической реакции в 2-4 раза (эту величину называют температурный коэффициент скорости химической реакции γ).
Точное значение температурного коэффициента определяется для каждой реакции.
здесь v2 — скорость реакции при температуре T2,
v1 — скорость реакции при температуре T1,
γ — температурный коэффициент скорости реакции, коэффициент Вант-Гоффа.
В некоторых ситуациях повысить скорость реакции с помощью температуры не всегда удается, т.к. некоторые вещества разлагаются при повышении температуры, некоторые вещества или растворители испаряются при повышенной температуре, т.е. нарушаются условия проведения процесса.
Видео:Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

2. Концентрация
Также изменить число эффективных соударений можно, изменив концентрацию реагирующих веществ . Понятие концентрации, как правило, используется для газов и жидкостей, т.к. в газах и жидкостях частицы быстро двигаются и активно перемешиваются. Чем больше концентрация реагирующих веществ (жидкостей, газов), тем больше число эффективных соударений, и тем выше скорость химической реакции.
На основании большого числа экспериментов в 1867 году в работах норвежских ученых П. Гульденберга и П. Вааге и, независимо от них, в 1865 году русским ученым Н.И. Бекетовым был выведен основной закон химической кинетики, устанавливающий зависимость скорости химической реакции от концентрации реагирующих веществ:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных их коэффициентам в уравнении химической реакции.
Для химической реакции вида: aA + bB = cC + dD закон действующих масс записывается так:
здесь v — скорость химической реакции,
CA и CB — концентрации веществ А и В, соответственно, моль/л
k – коэффициент пропорциональности, константа скорости реакции.
Например , для реакции образования аммиака:
закон действующих масс выглядит так:
Константа скорости реакции k показывает, с какой скоростью будут реагировать вещества, если их концентрации равны 1 моль/л, или их произведение равно 1. Константа скорости химической реакции зависит от температуры и не зависит от концентрации реагирующих веществ.
В законе действующих масс не учитываются концентрации твердых веществ, т.к. они реагируют, как правило, на поверхности, и количество реагирующих частиц на единицу поверхности при этом не меняется.
В большинстве случаев химическая реакция состоит из нескольких простых этапов, в таком случае уравнение химической реакции показывает лишь суммарное или итоговое уравнение происходящих процессов. При этом скорость химической реакции сложным образом зависит (или не зависит) от концентрации реагирующих веществ, полупродуктов или катализатора, поэтому точная форма кинетического уравнения определяется экспериментально, или на основании анализа предполагаемого механизма реакции. Как правило, скорость сложной химической реакции определяется скоростью его самого медленного этапа (лимитирующей стадии).
Видео:Химическая кинетика. Формальная кинетика простых гомогенных реакций в закрытых системахСкачать

3. Давление
Концентрация газов напрямую зависит от давления . При повышении давления повышается концентрация газов. Математическое выражение этой зависимости (для идеального газа) — уравнение Менделеева-Клапейрона:
pV = νRT
Таким образом, если среди реагентов есть газообразное вещество, то при повышении давления скорость химической реакции увеличивается, при понижении давления — уменьшается .
Например. Как изменится скорость реакции сплавления извести с оксидом кремния:
при повышении давления?
Правильным ответом будет – никак, т.к. среди реагентов нет газов, а карбонат кальция – твердая соль, нерастворимая в воде, оксид кремния – твердое вещество. Газом будет продукт – углекислый газ. Но продукты не влияют на скорость прямой реакции.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

4. Катализатор
Еще один способ увеличить скорость химической реакции – направить ее по другому пути, заменив прямое взаимодействие, например, веществ А и В серией последовательных реакций с третьим веществом К, которые требуют гораздо меньших затрат энергии (имеют более низкий активационный энергетический барьер) и протекают при данных условиях быстрее, чем прямая реакция. Это третье вещество называют катализатором .
Катализаторы – это химические вещества, участвующие в химической реакции, изменяющие ее скорость и направление, но не расходующиеся в ходе реакции (по окончании реакции не изменяющиеся ни по количеству, ни по составу). Примерный механизм работы катализатора для реакции вида А + В можно представить так:
A + K = AK
AK + B = AB + K
Процесс изменения скорости реакции при взаимодействии с катализатором называют катализом. Катализаторы широко применяют в промышленности, когда необходимо увеличить скорость реакции, либо направить ее по определенному пути.
По фазовому состоянию катализатора различают гомогенный и гетерогенный катализ.
Гомогенный катализ – это когда реагирующие вещества и катализатор находятся в одной фазе (газ, раствор). Типичные гомогенные катализаторы – кислоты и основания. органические амины и др.
Гетерогенный катализ – это когда реагирующие вещества и катализатор находятся в разных фазах. Как правило, гетерогенные катализаторы – твердые вещества. Т.к. взаимодействие в таких катализаторах идет только на поверхности вещества, важным требованием для катализаторов является большая площадь поверхности. Гетерогенные катализаторы отличает высокая пористость, которая увеличивает площадь поверхности катализатора. Так, суммарная площадь поверхности некоторых катализаторов иногда достигает 500 квадратных метров на 1 г катализатора. Большая площадь и пористость обеспечивают эффективное взаимодействие с реагентами. К гетерогенным катализаторам относятся металлы, цеолиты — кристаллические минералы группы алюмосиликатов (соединений кремния и алюминия), и другие.
Пример гетерогенного катализа – синтез аммиака:
В качестве катализатора используется пористое железо с примесями Al2O3 и K2O.
Сам катализатор не расходуется в ходе химической реакции, но на поверхности катализатора накапливаются другие вещества, связывающие активные центры катализатора и блокирующие его работу (каталитические яды). Их необходимо регулярно удалять, путем регенерации катализатора.
В биохимических реакция очень эффективными оказываются катализаторы – ферменты. Ферментативные катализаторы действуют эффективно и избирательно, с избирательностью 100%. К сожалению, ферменты очень чувствительны к повышению температуры, кислотности среды и другим факторам, поэтому есть ряд ограничений для реализации в промышленных масштабах процессов с ферментативным катализом.
Катализаторы не стоит путать с инициаторами процесса и ингибиторами.
Например , для инициирования радикальной реакции хлорирования метана необходимо облучение ультрафиолетом. Это не катализатор. Некоторые радикальные реакции инициируются пероксидными радикалами. Это также не катализаторы.
Ингибиторы – это вещества, которые замедляют химическую реакцию. Ингибиторы могут расходоваться и участвовать в химической реакции. При этом ингибиторы не являются катализаторами наоборот. Обратный катализ в принципе невозможен – реакция в любом случае будет пытаться идти по наиболее быстрому пути.
Видео:Влияние температуры на скорость химических реакций. 10 класс.Скачать

5. Площадь соприкосновения реагирующих веществ
Для гетерогенных реакций одним из способов увеличить число эффективных соударений является увеличение площади реакционной поверхности . Чем больше площадь поверхности контакта реагирующих фаз, тем больше скорость гетерогенной химической реакции. Порошковый цинк гораздо быстрее растворяется в кислоте, чем гранулированный цинк такой же массы.
В промышленности для увеличения площади контактирующей поверхности реагирующих веществ используют метод «кипящего слоя».
Например , при производстве серной кислоты методом «кипящего слоя» производят обжиг колчедана.
Видео:Задачи на скорость реакции в зависимости от концентрации реагентовСкачать

6. Природа реагирующих веществ
На скорость химических реакций при прочих равных условиях также оказывают влияние химические свойства, т.е. природа реагирующих веществ.
Менее активные вещества будут имеют более высокий активационный барьер, и вступают в реакции медленнее, чем более активные вещества.
Более активные вещества имеют более низкую энергию активации, и значительно легче и чаще вступают в химические реакции.
Более стабильные вещества — это, например, те вещества, которые окружают нас в быту, либо существуют в природе.
Например , хлорид натрия NaCl (поваренная соль), или воды H2O, или металлическое железо Fe.
Более активные вещества мы можем встретить в быту и природе сравнительно редко.
Например , оксид натрия Na2O или сам натрий Na в быту и в природе не не встречаем, т.к. они активно реагируют с водой.
При небольших значениях энергии активации (менее 40 кДж/моль) реакция проходит очень быстро и легко. Значительная часть столкновений между частицами заканчивается химическим превращением. Например, реакции ионного обмена происходят при обычных условиях очень быстро.
При высоких значениях энергии активации (более 120 кДж/моль) лишь незначительное число столкновений заканчивается химическим превращением. Скорость таких реакций пренебрежимо мала. Например, азот с кислородом практически не взаимодействует при нормальных условиях.
При средних значениях энергии активации (от 40 до 120 кДж/моль) скорость реакции будет средней. Такие реакции также идут при обычных условиях, но не очень быстро, так, что их можно наблюдать невооруженным глазом. К таким реакциям относятся взаимодействие натрия с водой, взаимодействие железа с соляной кислотой и др.
Вещества, стабильные при нормальных условиях, как правило, имеют высокие значения энергии активации.
Видео:Скорость химической реакции. Гомо- и гетерогенные реакции. Механизм реакции.Скачать

Скорость гомогенных химических реакций кинетическое уравнение
2 ХИМИЧЕСКАЯ КИНЕТИКА И ХИМИЧЕСКОЕ РАВНОВЕСИЕ
2.1 КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
Химические реакции протекают с различными скоростями. Некоторые из них полностью заканчиваются за малые доли секунды (взрыв), другие осуществляются за минуты, часы, дни и большие промежутки времени. Кроме того, одна и та же реакция может в одних условиях (например, при повышенных температурах) протекать быстро, а в других (например, при охлаждении) – медленно. При этом различие в скорости одной и той же реакции может быть очень большим.
При рассмотрении вопроса о скорости реакций необходимо различать гомогенные и гетерогенные реакции. С этими понятиями тесно связано понятие фазы.
Фазой называется часть системы, отделенная от других ее частей поверхностью раздела, при переходе через которую свойства изменяются скачком.
Гомогенная реакция протекает в объеме фазы [пример – взаимодействие водорода и кислорода с образованием водяного пара: H2(г) + O2(г) → H2O(г)], а если реакция гетерогенна, то она протекает на поверхности раздела фаз [например, горение углерода: C(т) + O2(г) → CO2(г)].
Скоростью гомогенной реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени в единице объема фазы:

где n – количество вещества, моль; V – объем фазы, л; τ – время; С – концентрация, моль/л.
Скоростью гетерогенной реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице площади поверхности фазы:

где S – площадь поверхности раздела фаз.
К важнейшим факторам, влияющим на скорость гомогенной реакции, являются следующие: природа реагирующих веществ, их концентрации, температура, присутствие катализаторов.
Зависимость скорости реакции от концентраций реагирующих веществ. Реакция между молекулами происходит при их столкновении. Поэтому скорость реакции пропорциональна числу соударений, которые претерпевают молекулы реагирующих веществ. Число соударений тем больше, чем выше концентрация каждого из исходных веществ. Например, скорость реакции A + B → C пропорциональна произведению концентраций А и В:
где k – коэффициент пропорциональности, называемый константой скорости реакции. По смыслу величина k равна скорости реакции для случая, когда концентрации реагирующих веществ равны 1 моль/ л .
Это соотношение выражает закон действия масс Этот закон называют также законом действующих масс. : при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
Гораздо реже реакция осуществляется в результате одновременного столкновения трех реагирующих частиц. Например, реакция
может протекать путем тройного столкновения:
Тогда в соответствии с законом действия масс концентрация каждого из реагирующих веще ств вх одит в выражение скорости реакции в степени, равной коэффициенту в уравнении реакции:
Сумма показателей степенив уравнении закона действия масс называется порядком реакции . Например, в последнем случае реакция имеет третий порядок (второй — по веществу A и первый — по веществу B.
Зависимость скорости реакции от температуры. Если воспользоваться результатами подсчета числа столкновений между молекулами, то количество столкновений окажется настолько большим, что все реакции должны будут протекать мгновенно. Это противоречие можно объяснить тем, что в реакцию вступают лишь молекулы, обладающие некоторой энергией.
Избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию нового вещества, называется энергией активации (см. рисунок 2.1).
Рисунок 2.1 – Энергетическая диаграмма для реакции образования продукта АВ из исходных веществ А и В. Если энергия столкновения молекул А и В больше или равна энергии активации Еа , то энергетический барьер преодолевается, и происходит перемещение вдоль координаты реакции r от исходных веществ к продукту. Иначе имеет место упругое столкновение молекул А и В. Вершина энергетического барьера соответствует переходному состоянию (активированному комплексу), в котором связь А–В образовалась частично.
С ростом температуры число активных молекул возрастает Температура является мерой средней кинетической энергии молекул, поэтому повышение температуры приводит к увеличению средней скорости их движения. . Следовательно, скорость химической реакции должна увеличиваться с ростом температуры. Возрастание скорости реакции при нагревании принято характеризовать температурным коэффициентом скорости реакции ( γ ) – числом, показывающим, во сколько раз возрастает скорость данной реакции при повышении температуры на 10 градусов. Математически эта зависимость выражается правилом Вант-Гоффа :

где v1 – скорость при температуре t1; v2 – скорость при температуре t2. Для большинства реакций температурный коэффициент γ лежит в пределах от 2 до 4.
Более строго зависимость скорости реакции (а точнее, константы скорости) от температуры выражается уравнением Аррениуса :

где A – предэкспоненциальный множитель, зависящий только от природы реагирующих веществ; Ea – энергия активации, представляющая собой высоту энергетического барьера, разделяющего исходные вещества и продукты реакции (см. рисунок 2.1); R R=8,3144 Дж/(моль . K). В приближенных расчетах часто принимают R=8,31 Дж/(моль . K). – универсальная газовая постоянная; T T — абсолютная температура (в шкале Кельвина). Она связана с температурой по Цельсию уравнением
T = t o C + 273,15.
В приближенных расчетах пользуются соотношением
T = t o C + 273. – абсолютная температура.
Снижение энергии активации по каким-либо причинам, согласно уравнению Аррениуса, приводит к увеличению скорости реакции.
Влияние катализаторов на скорость реакции .
Катализатор – это вещество, не расходующееся в процессе протекания реакции, но влияющее на ее скорость.
Явление изменения скорости реакции под действием таких веществ называется катализом. Обычно катализаторами называют вещества, увеличивающие скорость реакции, а ингибиторами – вещества, замедляющие протекание реакции. В большинстве случаев действие катализатора объясняется тем, что он снижает энергию активации реакции (рисунок 2.2).
А + В → АВ – некаталитическая реакция
А + С + В → АС + В → АВ + С – каталитическая реакция (С – катализатор)
Рисунок 2.2 – Энергетическая диаграмма каталитической реакции в сравнении с некаталитической.
🌟 Видео
Порядок реакцииСкачать

Скорость реакции. Химия – ПростоСкачать

Составляем кинетические уравненияСкачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

8 класс - Химия - Гомогенные и гетерогенные химические реакции. Скорость химической реакции. Часть 2Скачать

Скорость химической реакции. Практическая часть. 10 класс.Скачать

259. Как изменится скорость хим реакции, если увеличить давлениеСкачать

Скорость химических реакций. Гомогенные и гетерогенные реакции. Химия 8 классСкачать

Все о скорости химической реакции | Химия ЕГЭ 10 класс | УмскулСкачать

Основы химической кинетикиСкачать

Обратимость и необратимость химических реакций. Химическое равновесие. 1 часть. 9 класс.Скачать