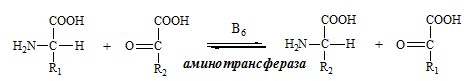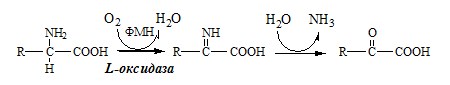Синтез аминокислоты глицина постоянно происходит в организме человека, обеспечивая расходным материалом для производства белков, гормонов, биологически-активных молекул. Прочитайте статью до конца, и вы узнаете механизмы реакций, протекающих в организме для синтеза глицина. Из чего образуется глицин, где он образуется и какие дополнительные компоненты необходимы для синтеза глицина. С вами Галина Батуро и аминокислота глицин.
- Синтез глицина
- Синтез глицина из серина
- Синтез глицина из треонина
- Синтез глицина из углекислого газа и аммиака
- Синтез глицина из глиоксиловой кислоты
- Глиоксиловая кислота и орнитин
- Прямой синтез глицина из глиоксиловой кислоты
- Синтез глицина из саркозина
- Заключение
- Acetyl
- Аминокислоты. Общие пути обмена аминокислот. Синтез мочевины.
- 🎬 Видео
Видео:Аэробный и анаэробный гликолиз. Реакции катаболизма глюкозы. Расчет выхода АТФ в гликолизеСкачать

Синтез глицина
Аминокислота глицин является заменимой протеиногенной аминокислотой. Это значит, что глицин входит в состав белков. Он присутствует в больших количествах в желатине, в виде амида он является составной частью гормонов вазопрессина и окситоцина. Вазопрессин, как явствует из его названия, это гормон, сужающий сосуды и поднимающий артериальное давление. Окситоцин – это гормон, способствующий сокращению гладкой мускулатуры, в большом количестве он выделяется во время родов, заставляя сокращаться матку и выталкивать плод из чрева.
Глицин входит в состав глутатиона, гиппуровой и гликохолевой кислот. В организме человека также вырабатывается N-метил-производное глицина – саркозин. Это производное холина и аминокислоты метионина.
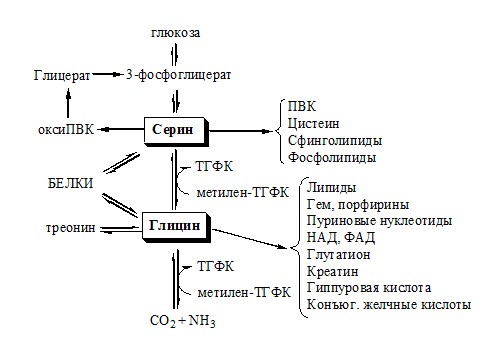
Глицин является источником таких важных метаболитов, как креатин, пуриновые основания и порфирины, из которых образуется белок крови гемоглобин.
Будучи заменимой аминокислотой, глицин может легко синтезироваться в организме. Он образуется в процессе следующих реакций: расщепление аминокислоты серина, синтез из воды и аммиака, аминирование глиоксиловой кислоты, деметилирование саркозина.
Видео:Качественная реакция глюкозы с гидроксидом меди (II)Скачать

Синтез глицина из серина
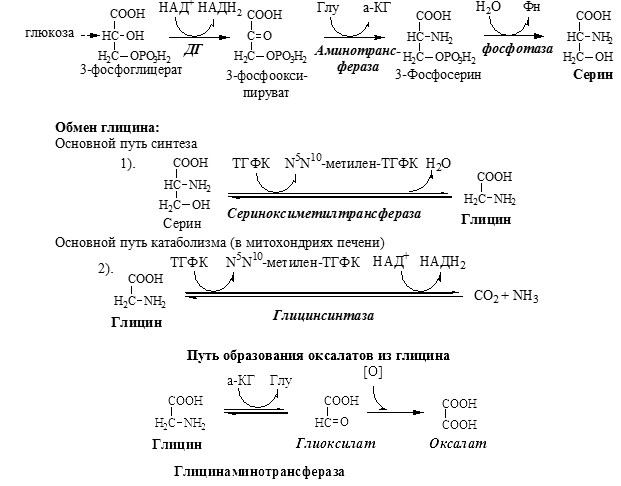
90% глицина синтезируется в организме из аминокислоты серин, тоже заменимой и протеиногенной. Углеродный скелет серин получает от 3-фосфоглицерата, промежуточного продукта распада глюкозы, а аминную голову предоставляет глутаминовая кислота. Казалось бы, при таких делах организм не должен бы испытывать недостаток глицина: глюкозу мы всегда получаем в избытке, и глутаминовая кислота, которая глутамат, обильно представлена в рационе. Однако засада подстерегает, где не ждешь. И называется она витамин B9, иначе говоря, фолиевая кислота, которую по идее мы должны получать со свежими листьями и травками. В нашей полосе, где девять месяцев зима, это особенно актуально.
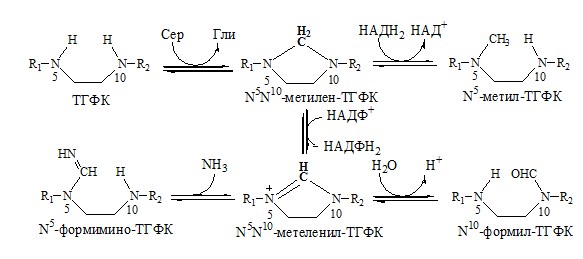
В синтезе глицина задействована активная форма витамина B9 (фолиевой кислоты) – Н4-Фолат, он же ТетраГидроФолиевая Кислота (ТГФК).
Образование ТГФК из фолиевой кислоты происходит в печени, это сложный каскад реакций, в которых задействованы особые ферменты, коферментом которых выступает НАДФ. Образовавшаяся ТГФК вступает в реакцию с серином при участии фермента СеринОксиМетилТрансфераза.
ТГФК принимает на себя метильную группу CH3, находящуюся в β-положении, и превращается N 5 N 10 МетиленН4Фолат, а спиртовая группа отщепляется в виде воды. Что значит это зубодробительное название? Фолат – это сокращенно фолиевая кислота, ибо соединение имеет гидроксильный хвост COOH. Метилен – означает, что соединение приняло на себя метильную группу CH2, причем приняли ее молекулы азота N в положении 5 и 10.
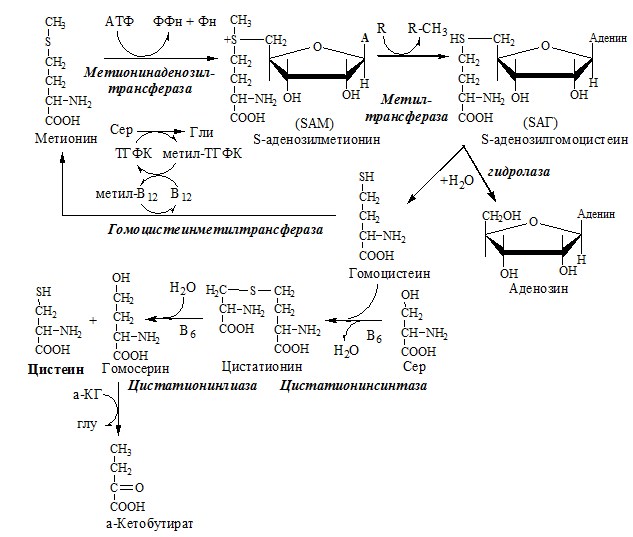
Реакция легко обратима, т.е. глицин может стать источником серина. В этом случае N 5 N 10 МетиленН4Фолат отдает метильную группу глицину, а вода станет источником спиртовой группы для серина. N 5 N 10 МетиленН4Фолат, образующийся вместе с глицином, быстренько превращается в N 5 МетилН4Фолат, который задействован в обезвреживании страшного гомоцистеина, превращая его в нужную аминокислоту метионин. В реакции принимает участие активная форма витамина B12 метилкобаламин.
Видео:Качественные реакции на глицерин, глюкозу и сахарозуСкачать

Синтез глицина из треонина
Долгое время считалось, что распад треонина с образованием глицина идет в клетках печени (гепатоцитах) под воздействием фермента ТреонинАльдолазы. В учебниках рисовали красивое уравнение реакции, приведенное ниже. Не обманывайтесь, насчет обратимости реакции. Уже тогда подчеркивалось, что реакция в живых организмах преимущественно идет в сторону распада треонина с образованием глицина и ацетальдегида. Обратный синтез треонина в живых организмах не наблюдался.
В настоящее время стало известно, что фермент ТреонинАльдолаза расщепляет с образованием глицина не L-треонин, содержащийся в белках, а стереоизомер алло-треонин, который в синтезе белков не участвует (1).
Образование глицина при распаде треонина долгое время считался возможным в митохондриях под воздействием фермента ТреонинДегидрогеназы, активность которого зависит от НАД. В результате образуется аминоацетон, который окисляется до α-АминоАцетоУксусной Кислоты, а та, в свою очередь является предшественницей глицина. Следует отметить, что человек в процессе эволюции утратил способность к синтезу ТреонинДегидрогеназы, следовательно образование глицина из треонина в человеческом организме не возможно (2).
В печени человека в процессе обезвреживания глиоксиловой кислоты (о чем дальше), треонин может переаминироваться под воздействием фермента КинуренинАминоТрансферазы, который оказался идентичным СеринПируватАминоТрансферазе и АланинГлиоксилАминоТрансферазе. В пероксисомах печени в присутствии ПиридоксальФосфата (активная форма витамина В 6) треонин соединяется с глиоксиловой кислотой, в результате чего образуется глицин и α-Кето-β-АминоМасляная кислота.
Видео:Михаил Никитин. Лекция 5. Место возникновения жизни. Восстановление СО2. Синтез нуклеотидов.Скачать

Синтез глицина из углекислого газа и аммиака
В печени позвоночных (и человека) при участии фермента ГлицинСинтазы глицин может образовываться из углекислого газа, аммиака, а также активной формы витамина В9 — N 5 N 10 МетиленН4Фолат (см. реакцию 1) и НАДН+Н. Реакция обратима, т.е. глицин может деградировать до углекислого газа и аммиака с образованием метилированной формы Фолата и НАДН+Н. Реакция идет в присутствии активной формы витамина B6 пиридоксальфосфата. Таким образом, для синтеза глицина нужно два витамина: фолиевая кислота (B9) и пиридоксин (B6). Фолиевая кислота содержится в свежей зелени, а также в печени, но вот беда, при тепловой обработке она разрушается. Пиридоксин содержится в семенах подсолнечника, отрубном хлебе, фасоли, красной морской рыбе и других продуктах.
Видео:Михаил Никитин. Лекция 6. Синтез нуклеотидов. Появление хиральной чистоты.Скачать
Синтез глицина из глиоксиловой кислоты
Глиоксиловая кислота — это жуткий яд, угнетающий тканевое дыхание. В больших количествах она содержится в незрелых фруктах, именно поэтому их не следует употреблять в пищу, особенно при проблемах с печенью и поджелудочной. В 30-е годы, когда в Среднем Поволжье разразился голод, мой двоюродный дед, будучи подростком, умер, поев незрелых яблок. Незрелые яблоки оказались соблазнительной пищей, с которой истощенный организм не справился. В другой раз чуть не отправился в кроличий рай мой домашний питомец, который дорвался до незрелых яблок, а я не сразу сообразила, что это не самая подходящая для него пища. Откачав крола, и вспомнив печальную историю двоюродного деда, я крепко-накрепко уяснила, что незрелые яблоки есть ни в коем случае нельзя. Теперь я знаю, почему – из-за высокого содержания глиоксиловой кислоты.
Глиоксиловая кислота также образуется в процессе биотрансформации этиленгликоля – яда, который добавляют в антифризы – жидкости-незамерзайки. При случайном (а иногда и не случайном) попадании внутрь, печень пытается обезвредить этиленгликоль, но в результате получаются соединения еще более ядовитые, и одним из них является глиоксиловая кислота.
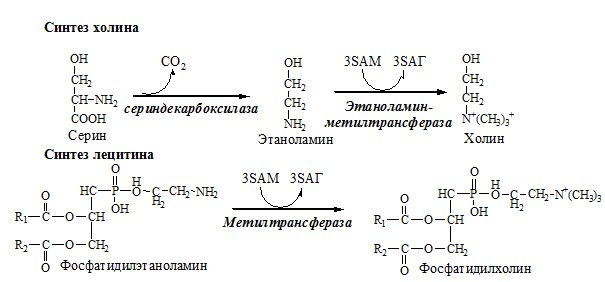
В небольших количествах глиоксиловая кислота образуется, как побочный продукт, на пути образования холина из серина. Холин нам нужен, ибо из него получается нейромедиатор ацетилхолин.
Фермент декарбоксилаза откусывает у серина карбоксильный хвост, в результате чего получается аминоспирт 2-аминоэтанол и выделяется углекислый газ.
2-аминоэтанол может пойти на синтез холина и далее на синтез нейромедиатора ацетилхолина, а может превратиться в гликолевый альдегид, лишившись аминной головы в ходе окислительного дезаминирования.
Гликолевый альдегид – ядовитое вещество, которое надо немедленно обезвредить. Образуется он не только из 2-аминоэтанола на пути превращения серина, но также при распаде пуриновых оснований (каркаса молекул ДНК и РНК – генетических матриц клеток) и при альтернативном пути гликолиза – распаде сахаров с выходом энергии. Таким образом, имеется 3 источника естественного образования гликолевого альдегида:
- превращение аминокислоты серин с образованием 2-аминоэтанола, который дает гликолевый альдегид
- распад пуринов: ксантин преобразуется в соль мочевой кислоты, которая декарбоксилируется, т.е. теряет карбоновый хвост, превращаясь в аллантоин и аллантоиновую кислоты, а те гидролизируются до мочевины и гликолевого альдегида
- альтернативный гликолиз: глюкоза превращается во фруктозу-1,6-бисфосфат, а ту фермент кетолаза превращает в гликолевый альдегид.
Гликолевый альдегид образуется также при переработке этиленгликоля в печени, при отравлении этим соединением, причем парадоксально, продукты метаболизма опаснее самого яда.
Гликолевый альдегид окисляется ферментом АльдегидОксидазой до гликолевой кислоты, а та, в свою очередь окисляется ферментом ЛактатДегидрогеназой до глиоксиловой кислоты.
Все эти вещества являются ядами, угнетающими тканевое дыхание и синтез белка, они блокируют митохондриальный транспорт электронов, разобщают окисление и фосфорилирование, т.е. химическая энергия, выделяющаяся при сгорании органических молекул, рассеивается в виде тепла, а не используется на работу биохимического конвейера.
Организм очень хитро придумал, преобразовывать яды в полезное вещество глицин. Этим занимаются печеночные клетки в особых органеллах – микротельцах (пероксисомах).
Основная реакция обезвреживания глиоксиловой кислоты – это соединение с аланином.
Донором аминной группы в этой реакции выступает аминокислота аланин, которая превращается в пируват. Реакция идет при участии фермента АланинГлиоксилатАминоТрансферазы в сопровождении активной формы витамина В6 – ПиридоксальФосфаста.
Видео:Аминокислоты. Глицин. Реальные эффекты. Седация и артериальное давлениеСкачать

Глиоксиловая кислота и орнитин
Другой реакцией обезвреживания глиоксиловой кислоты является соединение с орнитином, и на выходе получается глицин и γ-полуальдегид глутамиловой кислоты. Реакция активно идет в печени.
Где взять орнитин? Орнинин образуется из аргинина в процессе обезвреживания мочевины.
Видео:Биохимия | Синтез жиров и фосфолипидовСкачать

Прямой синтез глицина из глиоксиловой кислоты
Глицин может образовываться прямым синтезом из глиоксиловой кислоты. В этом случае аминную голову он берет у всевездесущего глутамата, который переходит в α-кетоглутарат. Реакция идет при участии фермента ГлицинАминоТрансферазы. Обратите внимание, что реакция обратима, т.е. глицин вполне может выступать источником глиоксиловой кислоты, и это не есть айс.
Глицин, таким образом, синтезируется, как конечный метаболит на пути обезвреживания гликолевого альдегида, гликолевой кислоты и глиоксиловой кислоты. Коль речь зашла об отравлении, надо сказать, что глиоксиловая кислота может превращаться в щавелевую кислоту, а та, поймав кальций, выпадает в осадок, образуя оксалаты – кальциевые соли щавелевой кислоты. Оксалаты представляют собой игольчатые кристаллы, они травмируют мочевыводящие протоки, образуют почечные камни. Образование большого количества оксалатов приводит к нарушению функции почек при отравлении этиленгликолем.
К чему это я? А к тому, что в некоторых случаях глицин выступает источником глиоксиловой кислоты, со всеми последствиями в виде образования в почках осксалатных камней.
Видео:[биохимия] — ГЛИКОЛИЗСкачать
![[биохимия] — ГЛИКОЛИЗ](https://i.ytimg.com/vi/EX5ZvvGQA5c/0.jpg)
Синтез глицина из саркозина
Саркозин – важный участник биохимического конвейера, в котором он задействован, как донор одноуглеродной группы в реакциях транметилирования, т.е. обмена метильными остатками CH3. Саркозин образуется в процессе распада холина. Превращения саркозина тесно связаны с глицином. Саркозин образуется из глицина, как непосредственно, так и через длинную биохимическую цепочку, в начале которой глицин превращается в серин, дальше через ряд соединений образуется холин, а из того при распаде получается саркозин.
У млекопитающихся (и человека) обнаружена размещенная в митохондриях ферментная система, которая разлагает саркозин с образованием глицина. 90% саркозина разлагается в митохондриях печени, а 10% — в почках. Реакция идет под действием фермента СаркозинДегидрогеназы, причем фермент работает при содействии апофермента, связанного с мембраной митохондрий. Его активность проявляется только в присутствии специфического флавопротеида ФАД (активной формы витамина В2 – рибофлавина), необходимого для переноса электронов. Эта реакция может идти как в присутствии, так и без ТетраГидроФолата (ТГФК – активной формы витамина В9 – фолиевой кислоты). В анаэробных условиях, т.е. без кислорода, ТГФК в реакции не участвует, в результате образуется свободный формальдегид, ядовитое вещество, которое срочно требуется обезвредить. В присутствии кислорода в реакцию вступает ТГФК, который забирает углеродный остаток СН3 у формальдегида, превращаясь в уже известный N 5 N 10 МетиленН4Фолат с выделением воды.
Точный механизм реакции не известен. Общая схема выглядит следующим образом:
Реакция в бескислородной среде протекает в два этапа. При участии кислорода и ТГФК – в три.
Первый этап: перенос водорода с N-метильной группы саркозина на ФАД, что позволяет воде атаковать образовавшийся положительно-заряженный карбокатион, с образованием промежуточного соединения. Происходит отсечение метильной головы, иначе говоря, деметилирование N-метильной группы на саркозине. Восстановленный на первой стадии ФАД Н — окисляется кислородом с образованием перекиси водорода.
Промежуточное соединение без ТГФК окисляется в глицин с выходом формальдегида.
На третьем этапе происходит обезвреживание формальдегида, для чего нужна ТГФК (активная форма фолиевой кислоты – витамина В9). ТГФК принимает на себя одноуглеродный остаток от формальдегида и превращается в N 5 ,N 10 -МетиленТетраГидроФолат.
Превращение происходит в четыре этапа с выделением воды.
Видео:Опыты по химии. Обнаружение глюкозы в виноградном соке и медеСкачать

Заключение
Глицин – активный участник биохимического конвейера, задействованный в переносе одноуглеродного остатка CH3, т.е. в реакциях метилирования. Обмен глицина тесно связан с обменом другой аминокислоты – серина и активной формы витамина B9 – фолиевой кислоты ТГФК. Биологический смысл данных процессов в передаче одноуглеродного остатка по биохимическому конвейеру, при этом глицин выступает источником одноуглеродного остатка, а ТГФК – передающим звеном, при этом обезвреживается образующийся в процессе биосинтеза опасный гомоцистеин с образованием безопасной аминокислоты метионин.
Глицин является конечным безопасным продуктом при обезвреживании клеточных ядов, имеющих как биосинтетическое происхождение, т.е. образующихся внутри организма при работе биохимического конвейера, так и пищевое происхождение, т.е. поступающих в организм извне, с пищей. Это гликолевый альдегид, гликолевая кислота и глиоксиловая кислота. В результате преобразований, происходящих в печени, клеточные яды превращаются в безопасный глицин.
Глицин также является конечным безопасным продуктом при утилизации холина и саркозина, в процессе которой образуются клеточный яд – формальдегид.
Распад биологически-активных молекул приводит к образованию опасных для организма веществ, требующих обезвреживания. Организм затрачивает усилия в виде энергии и работы ферментов и витаминов для того, чтобы запустить вторичное использование отработанных молекул, превращая яды в глицин. Глицин в свою очередь связывает обмен аминокислот, пуриновых оснований, порфиринов и, через аминокислоту серин, подпитывает углеводный обмен, давая организму энергию.
- Стр. 6. Малиновский А.В. «Переаминирование треонина»
- Стр. 15. Малиновский А.В. «Переаминирование треонина»
_» style=’position: relative; display: inline-block; /* height: 24px; */ /* padding: 0 12px 0 27px; */ /* border-radius: 12px; */ cursor: pointer; /* background: #21A5D8; */ text-decoration: none; padding: 2px 8px 2px 29px; /* font-size: 14px; */ /* font-family: Arial,sans-serif; */ /* color: #FFF; */ line-height: 25px; margin: 6px; color: #000; background: #fff; border: 1px solid #ccc; border-radius: 3px; vertical-align: middle; font-family: «Helvetica Neue»,Arial,sans-serif; font-size: 13px; line-height: 20px; cursor: pointer; line-height: 19px;’>
Видео:Реакция глюкозы с аммиачным раствором оксида серебраСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:Биосинтез пуринов | БиохимияСкачать  Аминокислоты. Общие пути обмена аминокислот. Синтез мочевины.» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»> Аминокислоты. Общие пути обмена аминокислот. Биосинтез мочевины. Аминокислоты – органические соединения, содержащие –СООН и -NH2 в α-положении. Почти все аминокислоты имеют хиральный атом и обладают оптической изомерией. У человека присутствуют L-аминокислоты Аминокислоты. Физико-химические свойства К наиболее важным общим реакциям аминокислот относятся реакции:
Специфические реакции аминокислот связаны с наличием функциональных групп в радикале (окислительно-восстановительные реакции цис). Аминокислоты. Классификация. Классификация аминокислот по природе радикала:
Классификация аминокислот по количеству карбоксильных и аминогрупп:
Классификация аминокислот по функциональным группам в радикале:
Классификация аминокислот по способности к синтезу:
Аминокислоты. Функции
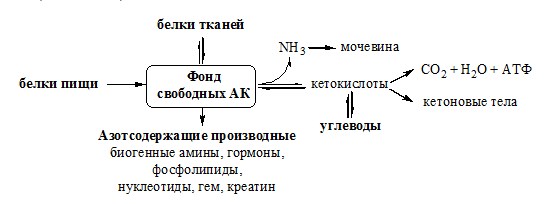
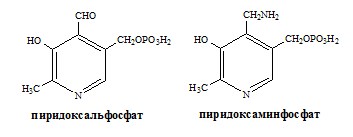
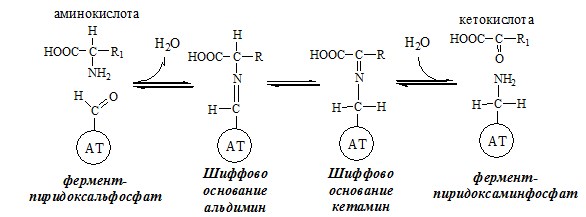
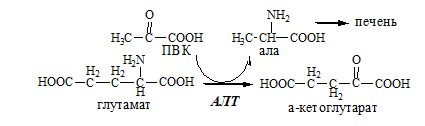
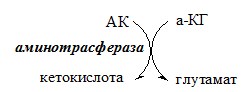
ПУТИ ОБРАЗОВАНИЯ ПУЛА АМИНОКИСЛОТ В КРОВИ Большая часть аминокислот организма человека, примерно 15кг, входит в состав белков. Фонд свободных аминокислот организма составляет примерно 35г. ОБЩИЕ РЕАКЦИИ ОБМЕНА АМИНОКИСЛОТ Аминокислоты, появившиеся в организме, включаются в общие и специфические реакции обмена. ТРАНСАМИНИРОВАНИЕ (ПЕРЕАМИНИРОВАНИЕ) АМИНОКИСЛОТ Трансаминирование — реакция переноса α-аминогруппы с аминокислоты на α-кетокислоту, в результате чего образуются новая α-кетокислота и новая аминокислота. Процесс трансаминирования легко обратим, при нем общее количество аминокислот в клетке не меняется. Реакции катализируют аминотрансферазы, коферментом которых служит пиридоксальфосфат (ПФ) — производное витамина В6 (пиридоксина).
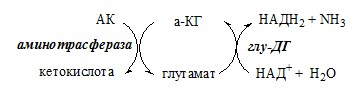
Механизм переаминирования Вначале, аминоксилота передает свою аминогруппу на пиродоксальфосфат. Аминокислота при этом превращается в кетокислоту, а пиродоксальфосфат – в пиридоксаминфосфат. Органоспецифичные аминотрансферазы АЛТ и АСТ Чаще всего в трансаминировании участвуют аминокислоты и кетокислоты, которых много в организме — глу, ала, асп, α-КГ, ПВК и ЩУК. Основным донором аминогруппы служит глу, а кетогруппы – α-КГ. Биологическое значение трансаминирования ДЕЗАМИНИРОВАНИЕ АМИНОКИСЛОТ Дезаминирование аминокислот — реакция отщепления α-аминогруппы от аминокислоты, в результате чего образуется соответствующая α-кетокислота и выделяется молекула аммиака. Прямое дезаминирование аминокислоты Существует 5 видов прямого дезаминирования аминокислот:
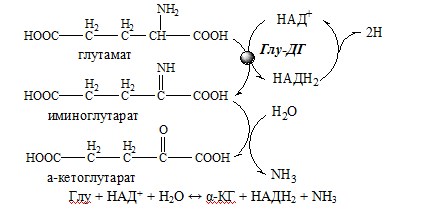
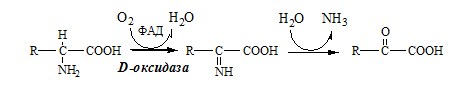
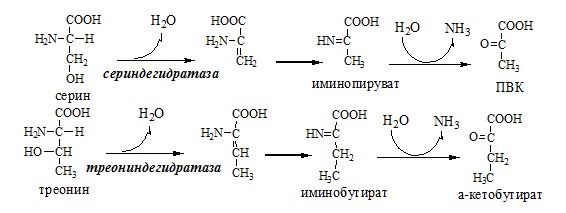
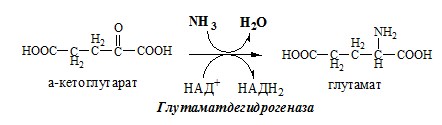
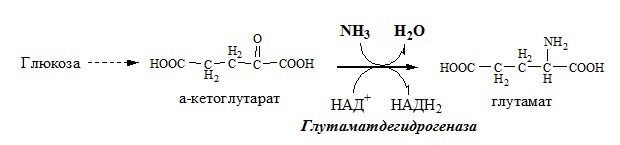
Окислительное дезаминирование – самый активный вид прямого дезаминирования аминокислот. 1. Глутаматдегидрогеназа (глу-ДГ) – олигомер, состоящий из 6 субъединиц (молекулярная масса 312 кД), содержит кофермент НАД+. Глу-ДГ катализирует обратимое дезаминирование глу, очень активна в митохондриях клеток практически всех органов, кроме мышц. Глу-ДГ аллостерически ингибируют АТФ, ГТФ, НАДH2, активирует избыток АДФ. Индуцируется Глу-ДГ стероидными гормонами (кортизолом). Глу + НАД+ + Н2О ↔ α-КГ + НАДН2 + NH3 2. Оксидаза L-аминокислот Оксидаза L-АК имеет кофермент ФМН. Т.к. оптимум рН оксидазы L-АК равен 10,0, активность фермента очень низка и вклад ее в дезаминирование незначителен. 3. Оксидаза D-аминокислот Неокислительное дезаминирование В печени человека присутствуют специфические пиридоксальфосфатзависимые ферменты сериндегидратаза, треониндегидратаза, катализирующие реакции неокислительного дезаминирования аминокислот серина и треонина. Внутримолекулярное дезаминирование Непрямое дезаминирование (трансдезаминирование) аминокислот Непрямое дезаминирование в печени Обе стадии непрямого дезаминирования обратимы, что обеспечивает как катаболизм аминокислот, так и возможность образования практически любой АК из соответствующей α-кетокислоты. Непрямое дезаминирование в мышцах (и нервной ткани) Можно выделить 4 стадии этого процесса:
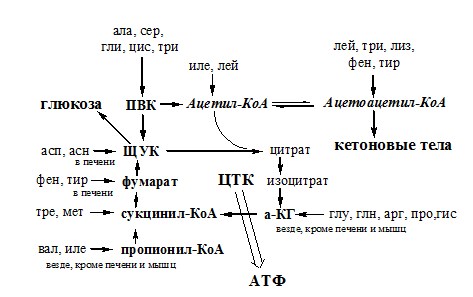
Этот путь дезаминирования преобладает в мышцах при интенсивной работе, в результате которой накапливается молочная кислота. Выделяющийся аммиак предотвращает закисление среды в клетках, вызванное образованием лактата. Пути обмена безазотистого остатка аминокислот За сутки у человека распадаются примерно 100г АК. Катаболизм всех АК сводится к образованию шести веществ, вступающих в общий путь катаболизма: ПВК, ацетил-КоА, α-кетоглутарат, сукцинил-КоА, фумарат и ЩУК. Эти вещества окисляются в ЦТК для образования АТФ или используются для синтеза глюкозы и кетоновых тел. Гликогенные аминокислоты – АК, которые превращаются в ПВК и промежуточные продукты ЦТК (а-КГ, сукцинил-КоА, фумарат, ЩУК). Они через ЩУК, используются в глюконеогенезе (ала, асн, асп, гли, глу, глн, про, сер, цис, арг, гис, вал, мет, тре). ОБМЕН АММИАКА Аммиак в организме образуется:
Концентрация аммиака Токсичность аммиака Механизм токсического действия аммиака:
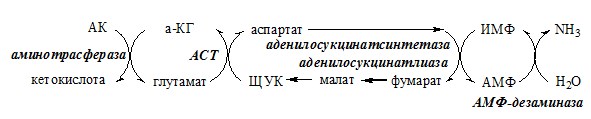
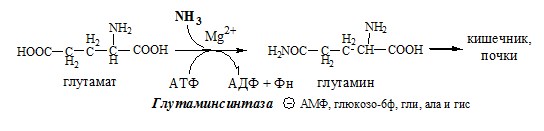
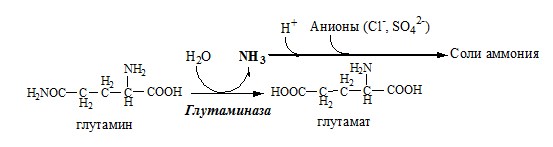
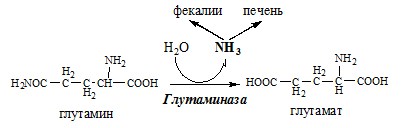
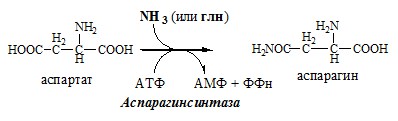
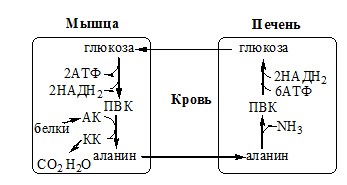
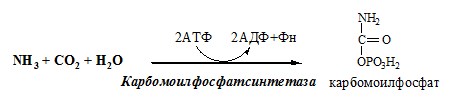
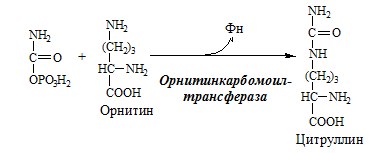
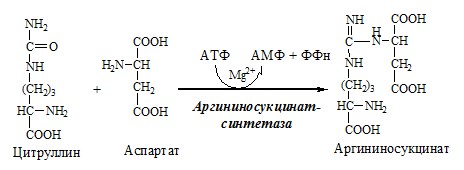
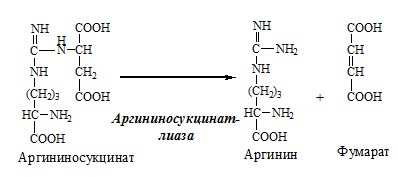
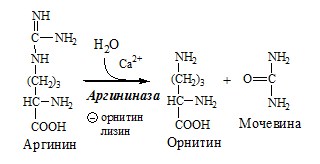
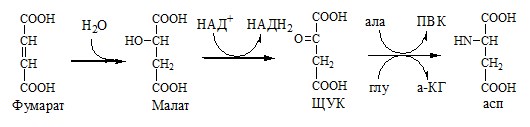
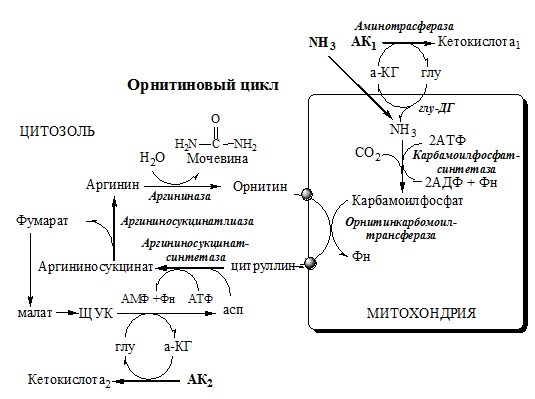
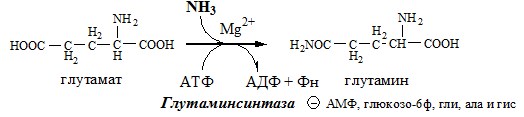
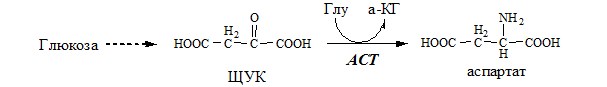
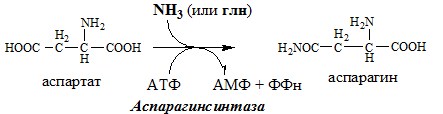
Связывание (обезвреживание) аммиака В связи с токсичностью аммиака в тканях происходит его связывание с образованием нетоксичных соединений – АК и мочевины. Процесс образования и обезвреживания аммиака регулируют в основном ферменты глутаматдегидрогеназа и глутаминсинтетаза. Обмен глутамата Однако этот путь обезвреживания аммиака в тканях используется слабо, так как глутаматдегидрогеназа катализирует преимущественно реакцию дезаминирования глутамата. Хотя, если учитывать последующее образование глутамина, реакция выгодна для клеток, так как способствует связыванию сразу 2 молекул NH3. Обмен глутамина Глутаминсинтетаза находиться в митохондриях клеток, содержит кофактор — ионы Mg2+, является одним из основных регуляторных ферментов обмена АК. Она аллостерически ингибируется АМФ, глюкозо-6ф, гли, ала и гис. Аммиак с протонами и анионами образует соли аммония (0,5 г/сут), которые выделяются с мочой. Этот процесс используется для регуляции КОС и сохранения в организме важнейших катионов Na+ и К+. Глутаминаза почек значительно индуцируется при ацидозе, ингибируется при алкалозе. Образовавшийся аммиак поступает через воротную вену в печень или удаляется из организма с фекалиями. Обмен аспарагина Обезвреживание аммиака в тканях происходит незначительно при синтезе аспарагина под действием глутаминзависимой и аммиакзависимой аспарагинсинтетазы. Первая функционирует в животных клетках, вторая преобладает в бактериальных клетках, но присутствует и у животных. Обмен аланина Из мышц и кишечника избыток аминого азота выводится преимущественно в виде аланина. Глутамат подвергается трансаминированию с ПВК с образованием аланина и α-кетоглутарата. Аланин поступает из кишечника в кровь воротной вены и поглощается печенью. Этот процесс называется глюкозо-аланиновый цикл: Он необходим, так как активность глу-ДГ в мышцах невелика и непрямое дезаминирование АК малоэффективно. ОРНИТИНОВЫЙ ЦИКЛ Большая часть свободного аммиака, а также аминного азота в составе (в основном глутамин, аланин) поступают в печень, где из них синтезируется нетоксичное и хорошо растворимое в воде соединение — мочевина. Мочевина является основной формой выведения азота из организма человека. Реакции орнитинового цикла (Карбамоилфосфатсинтетаза II локализована в цитозоле клеток всех тканей и участвует в синтезе пиримидиновых нуклеотидов). 2. В цитозоле аргининосукцинатсинтетаза с затратой 1 АТФ (двух макроэргических связей) связывает цитруллин с аспартатом и образует аргининосукцинат (аргининоянтарная кислота). Фермент нуждается в Mg2+. Аспартат — источник второго атома азота мочевины. 3. В цитозоле аргининосукцинатлиаза (аргининсукциназа) расщепляет аргининосукцинат на аргинин и фумарат (аминогруппа аспартата оказывается в аргинине). 4. В цитозоле аргиназа гидролизует аргинин на орнитин и мочевину. У аргиназы кофакторы ионы Са2+ или Мn2+, ингибиторы – высокие концентрации орнитина и лизина. Образующийся орнитин взаимодействует с новой молекулой карбамоилфосфата, и цикл замыкается. Регенерация аспартата из фумарата Фумарат, образующийся в орнитиновом цикле, в цитозоле превращается в ЩУК, который переаминируется с аланином или глутаматом с образованием аспартата. Аланин поступает главным образом из мышц и клеток кишечника: Малат может направиться в митохондрии и включиться в ЦТК. Энергетический баланс орнитинового цикла Энергозатраты при этом частично компенсируются:
Орнитиновый цикл в печени выполняет 2 функции:
Полный набор ферментов орнитинового цикла есть только в гепатоцитах. Отдельные же ферменты орнитинового цикла обнаруживаются в разных тканях. В энтероцитах, есть карбамоилфосфатсинтетаза I и орнитинкарбамоилтрансфераза, следовательно, может синтезироваться цитруллин. В почках есть аргининосукцинатсинтетаза и аргининосукцинатлиаза. Цитруллин, образовавшийся в энтероцитах, может поступать в почки и превращаться там в аргинин, который переносится в печень и гидролизуется аргиназой. Активность этих рассеянных по разным органам ферментов значительно ниже, чем в печени. Выделение азота из организма ГИПЕРАММОНИЕМИЯ Нарушение реакций обезвреживания аммиака может вызвать повышение содержания аммиака в крови — гипераммониемию, что оказывает токсическое действие на организм. Причинами гипераммониемии могут быть: Известны пять наследственных заболеваний, обусловленные дефектом пяти ферментов орнитинового цикла. Наследственные нарушения орнитинового цикла и их основные проявления Гиперам-мониемия, тип I В течение 24-48 ч после рождения кома, смерть Гиперам-мониемия, тип II Сцепленный с Х-хромосомой Гипотония, снижение толерантности к белкам Гипераммониемия тяжёлая у новорождённых. У взрослых — после белковой нагрузки Гипераммониемия, атаксия, судороги, выпадение волос Аргини-носукцинат NH 3 Аргини-носукци-нат, Глн, Ала, Лиз Apг Снижение активности какого-либо фермента синтеза мочевины приводит к накоплению в крови субстрата данного фермента и его предшественников. Гипераммониемия сопровождается появлением следующих симптомов:
В тяжёлых случаях развивается кома с летальным исходом. Лечение больных с различными дефектами орнитинового цикла в основном направлено на снижение концентрации аммиака в крови за счёт малобелковой диеты, введения кетоаналогов АК в рацион и стимуляцию выведения аммиака в обход нарушенных реакций:
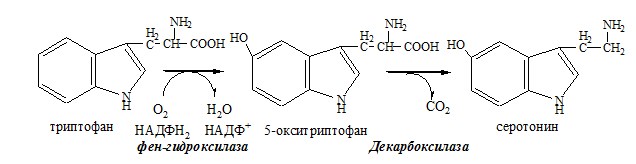
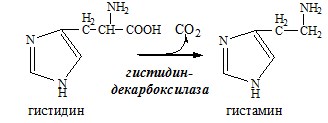
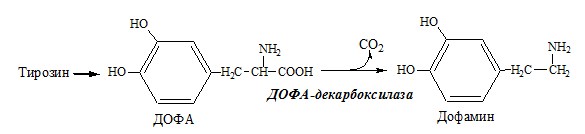
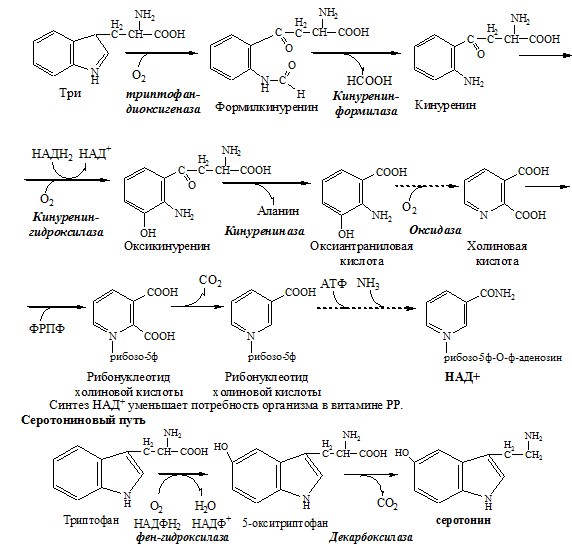
Обмен аминокислот и аммиака между тканями Печень Мышцы Кишечник Мозг Почки ДЕКАРБОКСИЛИРОВАНИЕ АМИНОКИСЛОТ И ИХ ПРОИЗВОДНЫХ Некоторые аминокислоты и их производные могут подвергаться декарбоксилированию – отщеплению α-карбоксильной группы. У млекопитающих декарбоксилируются: три, тир, вал, гис, глу, цис, арг, орнитин, SAM, ДОФА, 5-окситриптофан и т.д. Реакцию необратимо катализируют декарбоксилазы, которые содержат в активном центре пиридоксальфосфат. Механизм реакции похож на реакцию переаминирования. Серотонин
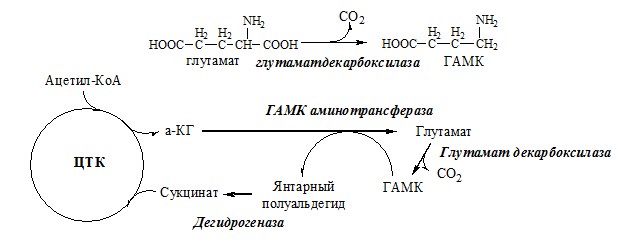
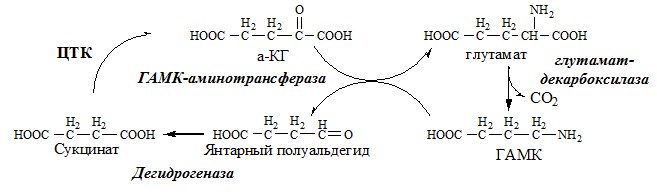
ГАМК ГАМК – тормозной нейромедиатор (повышает проницаемость постсинаптических мембран для К+), повышает дыхательную активность нервной ткани, улучшает кровоснабжение головного мозга. Гистамин Гистамин – медиатор воспаления, аллергических реакций, пищеварительный гормон:
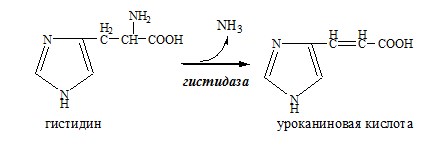
Дофамин Дофамин – нейромедиатор среднего отдела мозга. Аминокислоты. Специфические пути обмена аминокислот ФОЛИЕВАЯ КИСЛОТА Значительную роль в обмене ряда АК, синтезе некоторых сложных липидов, нейромедиаторов, гормонов и ряда других веществ играют производные фолиевой кислоты. Активная форма фолиевой кислоты – ТГФК. Она образуется в печени при восстановлении фолиевой кислоты с участием фолатредуктазы и дигидрофолатредуктазы, коферментом которых служит НАДФН2. Образование одноуглеродных фрагментов, их взаимопревращения ТГФК принимает от АК одноуглеродные фрагменты: серин и глицин дают метиленовый фрагмент (-СН2-), гистидин – формимино- и формильный фрагменты. Затем ТГФК отдает одноуглеродные фрагменты на:
Недостаточность фолиевой кислоты Гиповитаминоз фолиевой кислоты приводит к:
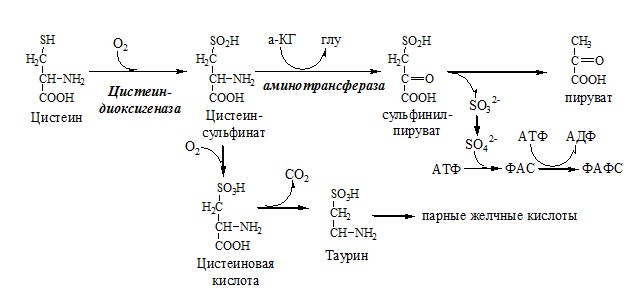
КОБАЛАМИН (В12) В12 синтезируется только микроорганизмами, им богаты печень, почки. Активные формы кобаламина – метилкобаламин (цитоплазма) и дезоксиаденозилкобаламин (митохондрии). Кобаламин участвует: Недостаточность В12 Гиповитаминоз В12 сопровождается: ОБМЕН СЕРИНА И ГЛИЦИНА Серин и глицин – заменимые аминокислоты. Схема путей обмена серина и глицина Глицин — важнейший (после ГАМК) тормозной нейромедиатор в спинном мозге, промежуточном мозге и некоторых отделах головного мозга. Наследственные нарушения обмена глицина Известно несколько заболеваний, связанных с нарушениями обмена глицина. В их основе лежит недостаточность ферментов или дефект системы транспорта этой АК. В состав белков человека входят 2 АК, содержащие серу, — метионин и цистеин. Эти аминокислоты метаболически тесно связаны между собой. МЕТИОНИН Метионин — незаменимая аминокислота, может регенерировать из гомоцистеина с участием серина и глицина. Метионин: Образование S-аденозилметионина Ресинтез метионина, роль ТГФК и витамина В12. Реакции трансметилирования с участием S-аденозилметионина Синтез холина и синтез лецитина Аналогично синтезируются: ЦИСТЕИН Цистеин – серосодержащая условнозаменимая АК. Синтезируется из незаменимого метионина и заменимого серина. Цистеин:
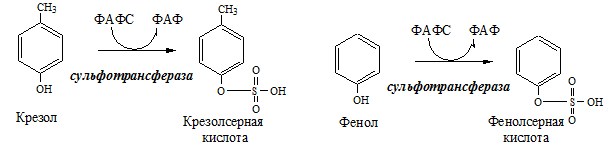
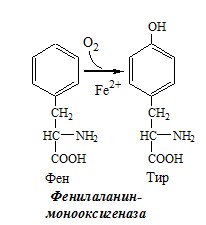
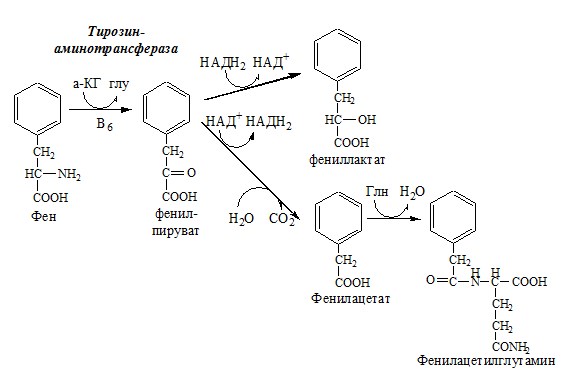
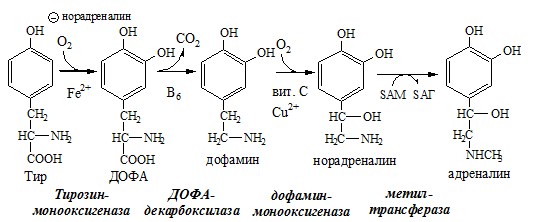
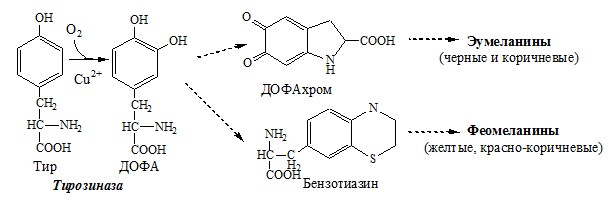
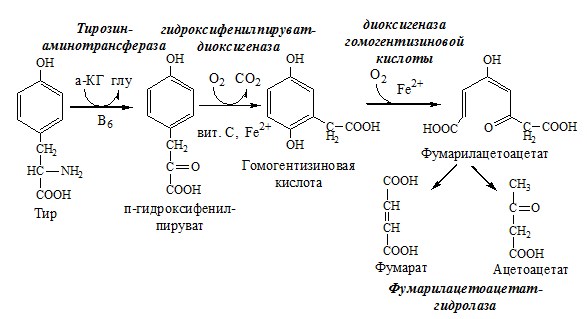
Образование сульфат-иона, его утилизация (образование ФАФС). ФАФС используется: 2. В синтезе гликозаминогликанов (сульфирование ОН групп производных глюкозы, галактозы сульфотрансферазой). ФЕНИЛАЛАНИН Фенилаланин — незаменимая АК, которая содержится в достаточных количествах в пищевых продуктах. Фенилаланин идет в основном на синтез белков и тирозина. Фенилкетонурия Классическая фенилкетонурия— наследственное заболевание, связанное с мутациями в гене фенилаланингидроксилазы (частота 1:10000 новорождённых), которые приводят к снижению активности фермента или полной его инактивации. Проявления фенилкетонурии: Проявления фенилкетонурии связаны с токсическим действием на клетки мозга высоких концентраций фенилаланина, фенилпирувата, фениллактата. Большие концентрации фенилаланина ограничивают транспорт тирозина и триптофана через гематоэнцефалический барьер и тормозят синтез нейромедиаторов (дофамина, норадреналина, серотонина). ТИРОЗИН Тирозин — условно заменимая АК, образуется из незаменимого фенилаланина. Содержание тир в пищевых белках достаточно велико. Обмен тирозина зависит от типа тканей. 1. Обмен тирозина в надпочечниках и нервной ткани Тирозингидроксилаза (тирозинмонооксигеназа) Fe2+ -зависимый фермент, в качестве кофермента использующий Н4БП. Ее ингибирует норадреналин. Болезнь Паркинсона 2. Обмен тирозина в меланоцитах В пигментных клетках (меланоцитах) обмен тирозин идет по меланиновому пути. Из тирозина синтезируются пигменты — меланины 2 типов: эумеланины и феомеланины. Эумеланины (чёрного и коричневого цвета) — нерастворимые высокомолекулярные полимеры 5,6-дигидроксииндола. Феомеланины — жёлтые или красновато-коричневые полимеры, растворимые в разбавленных щелочах. Альбинизм 3. Превращение тирозина в щитовидной железе 4. Катаболизм тирозина в печени Фумарат может окисляться до СО2 и Н2О или использоваться для глюконеогенеза. Ацетоацетат — кетоновое тело, окисляемое до СО2 и Н2О с выделением энергии. Алкаптонурия («чёрная моча») Тирозинемии Различают 3 типа тирозинемии.
ТРИПТОФАН Триптофан – незаменимая АК. В физиологических условиях >95% триптофана метаболизирует по кинурениновому пути и 1% по серотониновому пути. Схема кинуренинового пути Серотонин образуется в надпочечниках, ЦНС и тучных клетках. Образование и использование в организме ГАМК и ГОМК. Антиоксидантные, антигипоксические и адаптогенные свойства Глу, Асп, их клиническое применение. ГЛУТАМАТ Синтез глутамата 2). В реакция переаминирования с участием аминотрансфераз: Использование глутамата
Глутамат содержится в больших количествах в головном мозге, где выполняет разнообразные функции:
Нарушение обмена глутамата приводит к целому ряду патологических нарушений ЦНС: эпилепсии, расстройствах вестибулярной системы, ишемии и др. Глутамат и его аналоги используют как лекарственные средства при хронической недостаточности аминокислотного обмена, вегетососудистой дистонии, эпилепсии (в качестве предшественника ГАМК — тормозного медиатора). ГЛУТАМИН Синтез глутамина Использование глутамина АСПАРТАТ Синтез аспартата Использование аспартата АСПАРАГИН Синтез аспарагина Использование аспарагина 🎬 ВидеоГлицин. Чудо средство на все времена? Вся правда!Скачать  Михаил Никитин. Лекция 9. Происхождение рибосомы, белкового синтеза и генетического кода.Скачать  Проклятая химическая реакция 😜 #shortsСкачать  Глицин плюс N-ацетилцистеин: поворачивают вспять 10 признаков старения. Ошеломляющие результаты.Скачать  Биохимия. Качественные реакции для определения белков, аминокислот и углеводов (С. Смирнов)Скачать  ГЛИКОЛИЗ: Что, зачем и почему? // Биохимия простыми словамиСкачать  Пептидная связь. Образование пептидной связи. Запись структурной формулы пептида.Скачать  Гликолиз. Транспорт глюкозы в клетку.Скачать  ГЛИЦИН- МОЙ ОПЫТ | Я ПРИНИМАЛ ГЛИЦИН 30 ДНЕЙ (ЭКСПЕРИМЕНТ) | СПОКОЙСТВИЕ, СОН 🅰 #андрей_арбенинСкачать  |