Расщепление в желудке (кислая среда).
Всасывание в тонком кишечнике.
 |  |
На нужды организма: CO2, Н2О, NH3 -выведение.
(аминокислоты выстраиваются в


(алиментарная дистрофия – необратимая)
Весь синтез белков состоит из двух процессов: транскрипции и трансляции.
1. Транскрипция – процесс считывания, синтез РНК, осуществляемый РНК полимеразой. Процесс идёт с одной цепи ДНК. Транскрипция производится одним или несколькими генами, отвечающих за синтез определённого белка. У прокариотов этот участок называется опероном.
2. В начале каждого оперона находится площадка для РНК полимеразы – промотр – специальная последовательность нуклеотидов РНК, которую фермент определяет благодаря химическому средству. Присоединяется к просмотру и начинается синтез иРНК. Дойдя до конца оперона фермент встречает сигнал (определённую последовательность нуклеотидов), который означает конец считывания.
1. Связывание РНК полимеразы с промотором.
2. Инициация – начало синтеза.
3. Элонгация – рост цепочки РНК. V=50 нуклеотидов/секунда.
4. Терминация – завершение синтеза.
Трансляция – происходит в ядре на рибосомах.
1. Аминокислоты доставляют тРНК к рибосомам. Кодоны шифруют аминокислоты. На вершине тРНК имеется последовательность трёх нуклеотидов, компланарных нуклеотидам кодона в иРНК, — антикодон. Фермент определяет антикодон и присоединяет тРНК аминокислоту.
2. На рибосоме тРНК переводит с «языка» нуклеотидов на «язык» аминокислот. Далее аминокислоты отрываются от тРНК.
3. Фермент синтеза присоединяет аминокислоту к полипептидной цепи.
Синтез завершён и готовая цепь отходит от рибосом.
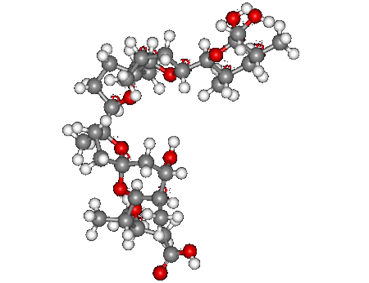
Белки – это высокомолекулярные соединения, молекулы которых представлены двадцатью альфа – аминокислотами, соединёнными пептидными связями – СО — NН —
Мономерами белков являются аминокислоты.
Кислотные свойства аминокислот определятся карбоксильной группой (-СООН), щелочные – аминогруппой (-NH2). Каждая из 20 аминокислот имеет одинаковую часть, включающую обе эти группы (-CHNH2 – COOH), и отличается от любой другой особой химической группировкой R – группой, или радикалом.
· Простые белки – состоящие из одних аминокислот. Например, растительные белки – проламины, белки кровяной плазмы – альбулины и глобулины.
· Сложные белки – помимо аминокислот имеют в своём составе другие органические соединения (нуклеиновые кислоты, липиды, углеводы), соединения фосфора, металлы. Имеют сложные названия нуклеопротеиды, шикопротеиды и т. д.
Простейшая аминокислота – глицерин NH2 – CH2 – COOH.
Но разные аминокислоты могут содержать различные радикалы CH3 – CHNH2 – COOH

Образование линейных молекул белков происходит в результате соединения аминокислот друг с другом. Карбоксильная группа одной аминокислоты сближается с аминогруппой другой, и при отщеплении молекулы воды между аминокислотными остатками возникает прочная ковалентная связь, называемая пептидной.
· Первичная – определяется последовательностью аминокислот. Из трёх аминокислот – 27 комбинаций, тогда из 20 аминокислот – 10 1300 длиной каждая не менее 100 остатков, следовательно, продолжается эволюционный процесс.
· Вторичная – спираль, полая внутри, которая удерживается водородными связями, при этом радикалы направлены наружу.
· 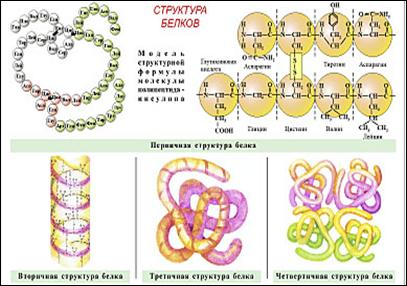
· Четвертичная структура – некоторые белки, например гемоглобин и инсулин, состоят из нескольких цепей, различающихся по первичной структуре.
В человеческом организме около 100000 белков, молекулярная масса которых от нескольких тысяч до нескольких миллионов.


В 1902 г. Э. Фишер предложил пептидную теорию строения белка.
В 1951 г. Л. Полинг разработал модель вторичной структуры белка.

У белков очень сложное строение и на данном этапе развития науки очень сложно выявить структуру молекул белков.
Первый белок, у которого была расшифрована первичная структура, был инсулин. Это случилось в 1954 году. Для этого понадобилось около 10 лет. Синтез белков — очень сложная задача, и если ее решить, то возрастет количество ресурсов для дальнейшего использования их в технике, медицине и т.д., а также уже возможен биохимический и синтетический способы получения пищи.
А.Н. Несмеянов провел широкие исследования в области создания микробиологической промышленности по производству искусственных продуктов питания. Практическое осуществление путей получения такой пищи ведется в двух основных направлениях. Одно из них основано на использовании белков растений, например сои, а второе — на использовании белков продуктов, полученных микробиологическим путем из нефти.
В природе широко представлена автоматическая самосборка надмолекулярных структур и инициатором ее являются белковые молекулы. Это дает надежду выяснить закономерности формообразования у растений и животных и понять молекулярные механизмы, обеспечивающие сходство родителей и детей.
Чем глубже химики познают природу и строение белковых молекул, тем более они убеждаются в исключительном значении получаемых данных для раскрытия тайны жизни. Раскрытие связи между структурой и функцией в белковых веществах — вот краеугольный камень, на котором покоится проникновение в самую глубокую сущность жизненных процессов, вот та основа, которая послужит в будущем исходным рубежом для нового качественного скачка в развитии биологии и медицины.
Белки входят в состав живых организмов и являются основными материальными агентами, управляющими всеми химическими реакциями, протекающими в организме.
Одной из важнейших функций белков является их способность выступать в качестве специфических катализаторов (ферментов), обладающих исключительно высокой каталитической активностью. Без участия ферментов не проходит почти ни одна химическая реакция в живом организме.
Вторая важнейшая функция белков состоит в том, что они определяют механо — химические процессы в живых организмах, в результате которых поступающая с пищей химическая энергия непосредственно превращается в необходимую для движения организма механическую энергию.
Третьей важной функцией белков является их использование в качестве материала для построения важных составных частей организма, обладающих достаточной механической прочностью, начиная с полупроницаемых перегородок внутри клеток, оболочек клеток и их ядер и заканчивая тканями мышц и различных органов, кожи, ногтей, волос и т.д.
Белки являются необходимой составной частью продуктов питания. Отсутствие или недостаточное количество их в пище вызывает серьезные заболевания.
Важную роль в жизнедеятельности играют комплексы белков с нуклеиновыми кислотами — нуклеопротеиды. Из нуклеопротеидов состоят, в частности, хромосомы, важнейшие составные части ядра клетки, ответственные за хранение наследственной информации, а также рибосомы — мельчайшие частицы протоплазмы, в которых происходит синтез белковых молекул.
Видео:Понятно и просто: биосинтез белка для ЕГЭ по биологииСкачать

Биосинтез белка
Если провести анализ сухой массы клетки, то более 50% приходится на долю белков. Это главный строительный элемент, который играет важную роль в росте и развития клеток, тканей и всего организма. Биосинтез белков берет свое начало с ядра, а в дальнейшем проходит в цитоплазме. Такой механизм биосинтеза характерный для эукариот.
Стадии биосинтеза белка:
- Транскрипция. На этом этапе генетическая информация ДНК переносится на мРНК.
- Трансляция. Здесь наблюдаем трансформацию триплетного нуклеотидного кода с образованием аминокислотной последовательности.
Что собой представляет биосинтез белка? Это сложный процесс синтеза и созревания белков который не обходится без ферментов. С участием мРНК и тРНК наблюдается синтез полипептидных цепей, которые формируются из аминокислот. Для эффективного биосинтеза белка нужна энергия и ионные активаторы.
Механизм биосинтеза белка:
- Сформированная мРНК покидает ядро и переходит в цитоплазму.
- Активация аминокислот. Присоединяется карбоксильная группа аминокислоты к соответствующей тРНК. Для протекания этого процесса нужна энергия.
- Формирование инициирующего участка (мРНК и рибосома) создание полипептидной цепи.
- Элонгация. На этом этапе выстраивается полипептидная последовательность.
- Терминация. Образование первичной структуры белка.
- Процессинг. На этом этапе формируется вторичная и третичная структура белка.
Сложно разобраться самому?
Попробуй обратиться за помощью к преподавателям
Видео:Биосинтез белка за 3 минуты (даже меньше)Скачать

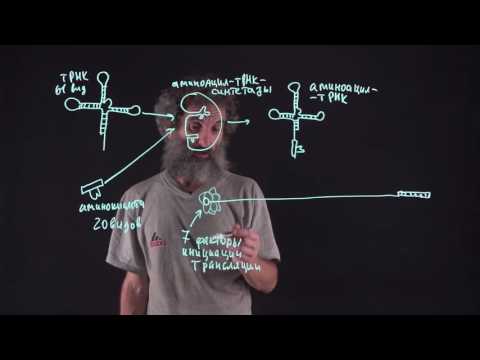
Аминоацилсинтетазы
В данном случае классическими ферментами выступают аминоацилсинтетазы. Каждая кислота реагирует исключительно на свой фермент. Комплекс между лизином и лизиновой тРНК называю лизил-тРНК. Как видим соединение в своем названии имеют окончание – ил (- ил). Процесс синтеза белка стартует при участии инициирующего комплекса. Такая система у эукариот формируется на цитоплазме или на поверхности шероховатого эндоплазматического ретикулума. У одноклеточных живых организмов лишенных сформированного ядра, ИК формируется в цитоплазме, другие варианты не представляются возможны.
В состав инициирующего комплекса входит:
- Стартовый аминоацил-тРНК.
- Рибосомы.
- Полностью сформированная мРНК.
Рибосомы состоят из большой и малой субъединицы. Эти клеточные структуры лишены оболочек, в их составе имеется белок и РНК. Структура рибосом у прокариот и эукариот практически идентичны: отмечается наличие специальных участков (Р-участок и А-участок).
Видео:Синтез белка: транскрипция | самое простое объяснениеСкачать

Образование инициирующего комплекса
В качестве примера возьмем клетку прокариот. Ключевые этапы формирования ИК можем описать следующим образом: поначалу фактор инициации связывает P-участок малой субъединицы. Затем присоединяется большая субъединица. На этапе элонгации активно формируется полипептидная цепь. Комплементарная аминоацил-тРНК фиксируется на А-участке рибосомы.
Не нашли что искали?
Просто напиши и мы поможем
Между аминогруппой первой кислоты и карбоксильной группы второй аминокислоты формируются особый вид амидной связи. Этот процесс невозможен без применения фермента — пептидилтрансферазы, который фиксируемый на рибосоме. На протяжении всей реакции он не покидает место работы. Как только аминоацил-тРНК стыковался и сформировалась пептидная связь, между аминокислотами наблюдается смещение ИК на 3 нуклеотида вдоль молекулы мРНК.
Различные аминокислоты дают начало разным белкам. Инициирующая аминоацил-тРНК не склонна к формированию амидной связи с последующей аминокислотой. Процесс считывания данных мРНК протекает в направлении 5г — 3г. Рост полипептидной цепи соответствует направлению N — С.
Терминация — это финишный этап биосинтеза, в ходе которого мРНК встречает один из 3х стоп-кодонов. Процессинг — это созревание полипептидной цепи. На этом этапе появляется третичная структура белка. Рассматривая сложные белки, стоит отметить, что на этапе процессинга могут включаться небелковые группы.
В настоящее время биосинтез белка изучен схематично и есть много нюансов, которые нуждаются в детальном рассмотрении. Несмотря на то, что учеными наиболее подробно изучен биосинтез белка Escherichia coli, здесь много невыясненных моментов. В этой статье мы рассмотрели биосинтез белка, опираясь на классические схемы.
Видео:Цитология. Лекция 31. Синтез белкаСкачать
Белки. Свойства белка.
Белки – природные полипептиды с огромной молекулярной массой. Они входят в состав всех живых организмов и выполняют различные биологические функции.
Видео:Биосинтез белка | Биология ОГЭ 2022 | УмскулСкачать

Строение белка.
У белков существует 4 уровня строения:
- первичная структура белка – линейная последовательность аминокислот в полипептидной цепи, свернутых в пространстве:
- вторичная структура белка – конформация полипептидной цепи, т.к. скручивание в пространстве за счет водородных связей между NH и СО группами. Есть 2 способа укладки: α-спираль и β— структура.
На одном витке укладываются 4 аминокислотных остатка, которые находятся снаружи спирали.
Полипептидная цепь растянута, ее участки располагаются параллельны друг другу и удерживаются водородными связями.
- третичная структура белка – это трехмерное представление закрученной α-спираль или β-структуры в пространстве:
Эта структура образуется за счет дисульфидных мостиков –S-S- между цистеиновыми остатками. В образовании такой структуры участвуют противоположно заряженные ионы.
- четвертичная структура белка образуется за счет взаимодействия между разными полипептидными цепями:
Видео:Синтез белка: трансляция | самое простое объяснениеСкачать
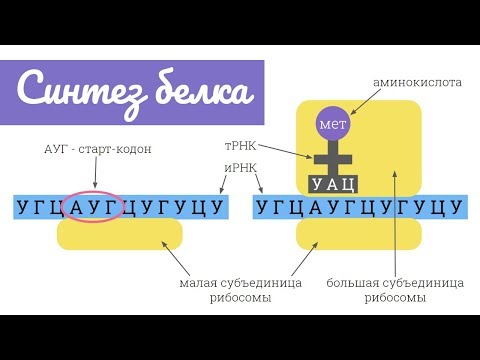
Синтез белка.
В основе синтеза лежит твердофазный метод, в котором первая аминокислота закрепляется на полимерном носителе, а к ней последовательно подшиваются новые аминокислоты. После полимер отделяют от полипептидной цепи.
Видео:Трансляция РНК | синтез белка, биология и физиология клеткиСкачать

Физические свойства белка.
Физические свойства белка определяются строением, поэтому белки делят на глобулярные (растворимые в воде) и фибриллярные (нерастворимые в воде).
Видео:Биосинтез белка с 0. Вся теория + практика | Биология ЕГЭ 2024 | УмскулСкачать

Химические свойства белков.
1. Денатурация белка (разрушение вторичной и третичной структуры с сохранением первичной). Пример денатурации – свертывание яичных белков при варке яиц.
2. Гидролиз белков – необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот. Так можно установить количественный состав белков.
3. Качественные реакции:
Биуретовая реакция – взаимодействие пептидной связи и солей меди (II) в щелочном растворе. По окончанию реакции раствор окрашивается в фиолетовый цвет.
Ксантопротеиновая реакция — при реакции с азотной кислотой наблюдается желтое окрашивание.
Видео:Биосинтез белка: штрих концы, антипараллельность - 27 задачаСкачать

Биологическое значение белка.
1. Белки – строительный материал, из него построены мышцы, кости, ткани.
2. Белки — рецепторы. Передают и воспринимают сигнал, поступающих от соседних клеток из окружающей среды.
3. Белки играют важную роль в иммунной системе организма.
4. Белки выполняют транспортные функции и переносят молекулы или ионы в место синтеза или накопления. (Гемоглобин переносит кислород к тканям.)
5. Белки – катализаторы – ферменты. Это очень мощные селективные катализаторы, которые ускоряют реакции в миллионы раз.
Есть ряд аминокислот, которые не могут синтезироваться в организме — незаменимые, их получают только с пищей: тизин, фенилаланин, метинин, валин, лейцин, триптофан, изолейцин, треонин.
📹 Видео
Синтез белка для дебиловСкачать

Решение задач синтез белкаСкачать

Биосинтез с нуля: штрих концы в задании 27 | Биология ЕГЭ 2022 | УмскулСкачать

ЕГЭ Биология | Синтез белка. РЕАКЦИИ МАТРИЧНОГО СИНТЕЗАСкачать

Реакция на результаты ЕГЭ 2022 по русскому языкуСкачать

Лекция 3. Транскрипция, трансляция. Окштейн И.Л., МФТИСкачать

Биосинтез белка. Видеоурок 13. Биология 9 классСкачать

Л.22 | РЕАКЦИИ МАТРИЧНОГО СИНТЕЗА | ОБЩАЯ БИОЛОГИЯ ЕГЭСкачать

Синтез белкаСкачать

Биосинтез белка | Решение задач по биологии | Биология ЦТ, ЦЭ, ЕГЭ (2023) | Уроки по биологииСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать