Аммиак – ключевой продукт различных азотсодержащих веществ, применяемых в промышленности и сельском хозяйстве. Аммиак используется для получения азотной кислоты, полимерных материалов, в холодильной технике, для производства минеральных удобрений.
Состав аммиака был установлен Бертолле в 1784 году. Аммиак – NH3 – основание, умеренно сильный восстановительный агент и эффективный комплексообразователь.
NH3— газ с резким запахом.
Растворимость: в 1л воды растворяется 700 л NH3
С воздухом аммиак образует взрывчатую смесь в интервале (15-27%)NH3
Синтез аммиака из элементов осуществляется по уравнению реакции: N2+3H2↔2NH3+Q – обратимая, экзотермическая.
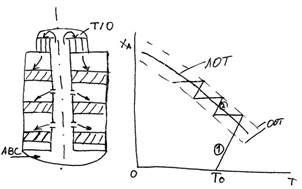
Согласно принципу Ле-Шателье при нагревании равновесие смещается влево, в строну уменьшения выхода аммиака. Реакция синтеза аммиака протекает с уменьшением объема. Значит для интенсификации процесса получения аммиака необходимо: t↓ (420-550 ᵒС) и p↑ 320 атм, катализатор Fe.
Синтез аммиака протекает с заметной скоростью только в присутствии катализатора, причем твердого катализатора (железо). Гетерогенно-каталитический процесс синтеза аммиака имеет сложный механизм:
1) внешняя диффузия N2 и Н2 к поверхности катализатора;
2) Диффузия внутри пор катализатора
3) Химическая реакция на поверхности катализатора
3.1 Абсорбция на активных центрах Ϭ катализатора
3.2 Взаимодействие поверхностных комплексов:
NϬ+HϬ→NHϬ+Ϭ (NHϬ — имид)
3.3 десорбция NH3 с поверхности катализатора
4) Диффузия NH3 в порах катализатора
5) Диффузия NH3 через пограничную газовую пленку в газовый поток.
Лимитирующая стадия – хемосорбция азота (диффузия внутри пор катализатора).
Скорость обратимой реакции получения аммиака из элементов на большинстве катализаторов описывается уравнением Темкина-Пыжева:
Скорость реакции синтеза аммиака зависит от температуры, давления и состава реакционной смеси. Оптимальными считают такие значения указанных параметров, при которых скорость процесса максимальна.
Из этого уравнения видно, что скорость прямой реакции синтеза пропорционально р 1,5 , а скорость обратной – р 0,5 . Очевидно, что с ростом давления скорость процесса увеличивается.
С ростом давления увеличивается расход электроэнергии, при понижении давления снижается расход энергии, но увеличиваются размеры аппаратов. Для определения оптимального давления синтеза была использована комплексная математическая модель агрегата синтеза аммиака. В качестве критерия оптимизации – приведенные затраты.
На основании анализа определено, что наиболее эффективным является давление около 30 МПа.
1) высокое давление
2) наличие циркуляционного контура
3) использование холода для разделения газовой смеси
Так как присутствие инертных примесей в реакционной смеси равносильно снижению общего давления, то с увеличением содержания метана, аргона и гелия в смеси скорость реакции синтеза уменьшается.
С повышением содержания аммиака общая скорость реакции падает.
Влияние объемной скорости потока υ.
Увеличение объемной скорости смеси приводит к уменьшению прироста содержания аммиака и, тем самым к росту средней скорости и повышению производительности процесса.
Увеличение υV в 4 раза снижает хА на 20%.
Рабочие υV=30*10 3 1/час
1 – синтез аммиака
2 – выделение аммиака
Реакция синтеза аммиака обратима, поэтому полного превращения азота и водорода в аммиак за время их однократного прохождения через аппарат не происходит. Для более полного использования реагентов необходима их многократная циркуляция через колонну синтеза.
Устройство колонны синтеза.
— прочность (320 атм.)
— оптимальный температурный режим
— использование избыточного тепла
АВС – для снижения температуры
1 – колонна синтеза
Давление 30 МПа
8 – аммиачный холодильник.
Чтобы выделить аммиак, азотоводородную смесь вместе с аммиаком охлаждают до температуры сжижения аммиака. Концентрация аммиака в азотоводородной смеси, содержащей инертные газы, в состоянии насыщения при давлении 30 МПа и различных температурах:
| Т, ᵒС | -10 | ||||
| СNH3, % | 2,1 | 3,2 | 4,7 | 5,5 | 7,3 |
СNH3 – остаточное в газе (то, что остается и не конденсируется).
Поэтому целесообразно в систему подавать жидкий аммиак, который охлаждает газ до -10ᵒС
Часть газа накапливается (Ar) и поэтому от них надо избавляться. Это делается путем сбрасывания продувки. 7% нашего газа сбрасывается в трубу и сжигается.
Свежий газ (азото-водородная смесь) после очистки от посторонних примесей и после охлаждения поступает нижнюю часть конденсационной колонны 7 для очистки от остаточных примесей СО2, Н2О. Свежий газ барботирует через слой сконденсировавшегося жидкого аммиака, особождается от водяных паров и следов СО2, насыщается аммиаком и смешивается с циркуляционным газом. Полученная смесь проходит по трубкам теплообменника конденсационной колонны и нагревается в теплообменнике 2, протекая по трубам. Затем поступает в колонну синтеза 1. В колонне синтеза 1 газ проходит снизу вверх по кольцевой щели между корпусом колонны и поступает в межтрубное пространство внутреннего теплообменника, размещенного в горловине колонны синтеза. В теплообменнике циркуляционный газ нагревается до температуры начала реакции и затем проходит четыре слоя катализатора, концентрация аммиака в газе увеличивается. Пройдя через центральную трубу азотоводородно-аммиачная смесь направляется во внутренний теплообменник, где охлаждается до 300ᵒС. Дальнейшее охлаждение в теплообменнике 3, в трубном пространстве теплообменника 2 холодным циркуляционным газом. Часть аммиака конденсируется. Жидкий аммиак, сконденсировавшийся при охлаждении, отделяется в сепараторе 6, смешивается с жидким аммиаком из конденсационной колонны 8 и из нижней ее части.
Циркуляционный газ поступает в систему вторичной конденсации, поступает в колонну 8 охлаждается до 18ᵒС за счет аммиака охлажденного в аммиачной колонне 8. В сепарационной части колонны 8 происходит отделение жидкого аммиака от газа и смешение свежей АВС с циркуляционным газом.
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Синтез аммиака
Видео:Термохимические уравнения. Решение задач из ЕГЭ на тепловой эффект.Скачать

Что такое синтез аммиака
Синтез аммиака это взаимодействие азота с водородом в жестких условиях, поскольку реакция обратима весь процесс производят при нагревании до 500°, выше дает отрицательный вариант с меньшим выхода аммиака, также одним из условий синтеза повышенное давление, что хорошо сказывается на выходе NH3.
NH3 получение в лаборатории

Проверяют прибор на герметичность. Пускают ток азота и водорода, следя за тем, чтобы число пузырьков этих газов, проходящих через промывные склянки 1 и 2 с концентрированной серной кислотой, относилось как 1 :3. Скорость поступления азота и водорода регулируют с помощью кранов или зажимов от газометра и аппарата Киппа.
Проверяют полноту вытеснения воздуха из установки (поджиганием в пробирке газа, собранного у газоотводной трубки 7) и отсутствие аммиака в исходной азотоводородной смеси (лак мусом или фенолфталеином). Включают электрический ток и следят, чтобы в трубке-реакторе 3 спираль 4 с катализатором раскалилась докрасна.
Рис. Установка для синтеза аммиака:
1, 2 —промывные склянки, 3 — трубка-реактор, 4 электроспираль, 5, 7 — газоотводные трубки, 6 — дугообразная трубка.
Азотоводородная смесь, проходя над спиралью с катализатором без нагревания, не образует даже следов аммиака. Аммиак появляется, когда катализатор нагревается.
После появления окраски в дугообразной трубке 6 с фенолфталеином ее отключают и к отверстию газоотводной трубки 5 подносят стеклянную палочку, смоченную концентрированной соляной кислотой (или влажную лакмусовую бумагу красного цвета). Для окончания опыта выключают электрический ток, закрывают кран аппарата Киппа, продолжая некоторое время пропускать азот до полного удаления из аппарата водорода и охлаждения катализатора.
Синтез аммиака — обратимая экзотермическая реакция:
Для начала реакции необходимо нагревание, осуществляемое накаливанием электроспирали до красного цвета (около 400°С). (При очень сильном нагревании аммиак не образуется.) Обнаружение аммиака подтверждается следующими реакциями: а) в растворе с помощью фенолфталеина:
б) в воздухе (по образованию белого дыма в присутствии концентрированной соляной или азотной кислот):
Меры предосторожности. Водород необходимо проверить на чистоту.
В такой же реакционной трубке можно осуществить опыт разложения аммиака и обнаружить образовавшийся водород. С этой целью пропускают аммиак над нагретой спиралью с катализатором, собирают продукты разложения и испытывают их на горючесть.
Физические свойства аммиака
Горючий бесцветный газ. Мол. масса 17,03; температура кипения — 33,4 °С; плотность по воздуху 0,597; коэф. диф. газа в воздухе 0,198 см 2 /с; тепл. cгop. —316,5 кДж/моль; растворимость в воде 34,2% (масс). Т. самовоспл. 650 °С; конц. пределы распр. пл. в воздухе 15—28% (об.), в кислороде 13,5—79% (об.); миним. энергия зажигания 680 мДж; макс. давл. взрыва 588 кПа; МВСК 16,2% (об,); ад. т. гор. 1777 К; норм, скорость распр. пл. 0,23 м/с при 150 °С.
Аммиачная вода
Водный раствор аммиака, не способна к горению; над ее поверхностью возможно образование взрывоопасной смеси аммиака с воздухом. Показатели пожарной опасности приведены в табл.
Таблица . Показатели пожаровзрывоопасности аммиачной воды
| Концентрации раствора, % (масс.) | Температура самовоспламенения, °С | Температурные пределы распр. пл., °С | |
| нижний | верхний | ||
| 15 27 | >750 >750 | 23 -2 | 33 10 |
В открытых сосудах и при разливе в помещении вероятность создания взрывоопасной концентрации практически отсут.
Аммиачно водородные смеси
Горючи. В табл. 2. приведены значения конц. пределов распр, пл. по газовоздушным смесям различного состава при нормальных условиях.
Значения верхних пределов распр. шл. аммиачно водородных смесей в воздухе, обогащенном кислородом, приведены в табл. 3.
Таблица 2 . Показатели, пожаровзрывоопасности аммиачно водородных смесей
| Состав горючей | смеси. % (об.) | Конц. пределы распр. пл., % (об.) | |
| аммиак | водород | нижний | верхний |
| 100 | 0 | 15 | 28 |
| 90 | 10 | 11,5 | 31,3 |
| 80 | 20 | 9,2 | 34,9 |
| 70 | 30 | 7,3 | 38,5 |
| 60 | 40 | 6,3 | 43,7 |
| 50 | 50 | 5,7 | 47 |
| 40 | 60 | 5,2 | 51,2 |
| 30 | 70 | 4,6 | 56,2 |
| 20 | 80 | 4,3 | 61,6 |
| 10 | 90 | 4,02 | 67,1 |
| 5 | 95 | — | 71,5 |
Таблица 3. Верхние пределы распространения пламени аммиачно-водородных смесей
| Состав горючей смеси, % (об.) | Верхние пределы распр. пл., % (об.), при содержании кислорода в воздухе, % (об.) | ||||
| аммиак | водород | 28 | 36 | 43,7 | 52 |
| 100 | 0 | 39,5 | 49 | 57 | 62 |
| 80 | 20 | — | 57 | 62,5 | — |
| 60 | 40 | — | 64 | 70 | — |
| 40 | 60 | — | 70,4 | 74,5 | — |
| 20 | 80 | — | 78 | 80 | — |
Также в лабораторных условиях можно получить аммиак нагревание нашатыря с гашеной известью Са(ОН)2 Реакция выражается уравнением
Выделяющийся аммиак содержит пары воды. Для осушения его пропускают через склянку с натронной известью (смесь извести с едким натром).
Многие нитриды полностью гидролизуются водой с образова нием аммиака и гидроокиси металла. Например;
Цель статьи
В данной статье мы узнали методы и способы образования NH3 , в лабораторных условиях, рассмотрели синтез аммиака с помощью аппарата Киппа, узнали пажароопасность аммиачно водородных смесей
Статья на тему Синтез аммиака
Похожие страницы:
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
Видео:Как БЫСТРО и ЛЕГКО проверить КАТАЛИЗАТОР автомобиляСкачать

Производство аммиака.
Аммиак – ключевой продукт различных азотсодержащих веществ, применяемых в промышленности и сельском хозяйстве.
Области применения: в производстве азотной кислоты, карбамида, взрывчатых веществ, минеральных удобрений, красителей, полимерных материалов и т.д.
Синтез аммиака из элементов осуществляется по уравнению реакции:
Реакция обратимая, экзотермическая, характеризуется большим отрицательным энтальпийным эффектом (ΔН298 = — 91,96 кДж/моль) и при высоких температурах становится еще более экзотермической. Изменении энтропии в данном случае тоже отрицательно ( ΔS 0 298 =-198,13 кДж/моль . К) и не благоприятствует протеканию реакции. При отрицательном значении ΔS 0 повышение температуры уменьшает вероятность протекания реакции, так как при этом ΔG 0 становится все более положительной величиной.
Поэтому, чем выше температура, тем менее термодинамически вероятным будет процесс.
Поскольку процесс синтеза аммиака является обратимым, экзотермическим и идет с уменьшением числа молей, для смещения равновесия вправо необходимо снижать температуру и увеличивать давление.
Синтез аммиака не идет в газовой фазе даже при очень высоких температурах из-за высокой энергии активации. Для ее снижения процесс необходимо проводить на поверхности катализатора.
Наибольшей каталитической активностью обладают Fe, Os, W, Pt, Ru. В промышленности нашли применения железные катализаторы, получаемые сплавлением оксидов железа с активаторами (промоторами) и последующим восстановлением оксидов железа. В качестве активаторов применяют Al2O3 и K2O для уменьшения роста кристаллов железа и для облегчения диффузии образовавшегося аммиака с поверхности катализатора соответственно.
Катализатор из активированного железа необратимо отравляется сернистыми соединениями и обратимо –кислородосодержащими соединениями. Поэтому перед синтезом свежая АВС подвергается тщательной очистке.
Таким образом, процесс является гетерогенно-каталитическим. Лимитирующая стадия – хемсорбция азота на поверхности катализатора.
ZN2 +3H2 = 2NH3 + Z (2.3.), где Z – свободный центр поверхности катализатора.
Так как синтез аммиака идет в кинетической области, то для увеличения скорости процесса необходимо увеличивать температуру.
Катализатор –активированное железо, работает в узком температурном интервале 420-500 0 С, что и будет определять температуру синтеза.
Осуществляются три режима работы:
1). Низкое 10-20 МПа
2) Среднее 28-35 МПа
3) Высокое 45 –100 МПа.
Установки низкого давления применяются редко, из-за их малой экономичности и сложности схемы.
Преимущества аппаратов высокого давления: увеличивается концентрация аммиака в газе, растет производительность установок, проще схема. Однако, наряду с позитивными моментами, существуют и недостатки: увеличивается концентрация инертных примесей, большой расход электроэнергии, уменьшается срок службы катализатора.
Большинство установок в промышленности работают при среднем давлении – 30 – 32 МПа.
Повышение давления оказывает положительное влияние как на выход, так и на скорость процесса, так как скорость прямой реакции зависит от давления в степени 1,5, а скорость обратной реакции – в степени 0,5.
Выбор соотношения исходных компонентов.
Так как процесс синтеза аммиака является обратимым несмещенным, то избыток компонента не сможет существенно сместить равновесие реакции. И с другой стороны, лимитирующая стадия – хемсорбция азота, поэтому для увеличения скорости процесса он должен быть выбран, как реагент, используемый в избытке. А это приведет к накоплению инертов и снижению давления в системе, что в свою очередь снизит выход и скорость процесса.
Таким образом, целесообразно поддерживать стехиометрическое соотношение исходных компонентов, т.е. N2 :H2=1:3
Для увеличения степени использования сырья процесс проводят по циркуляционной схеме вдали от положения равновесия с большими объемными скоростями. Повышение объемной скорости приводит к снижению выхода аммиака, но в целом ведет к увеличению интенсивности процесса.
Для предотвращения накопления инертов в циркуляционном газе проводят отдувку – часть циркуляционного газа выбрасывают в атмосферу с таким расчетом, чтобы количество инертов, поступающих со свежим газом, было равно количеству инертов, удаляемых из системы отдувкой.
Для разрешения противоречия между выходом и скоростью, процесс проводят по линии оптимальных температур. Для этого в колонне синтеза предусмотрена подача холодного байпасного газа после каждого слоя катализатора.
📹 Видео
пламегаситель вместо катализатора + обманка лямбда зондаСкачать

Изменение мощности двигателя после удаления катализатораСкачать

Химическое равновесие. Урок 2 | ХИМИЯ ЕГЭ | Лия МенделееваСкачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Цепочки превращений по неорганической химии. Вариант №6. Азот и его соединения.Скачать

Равновесие в химических реакциях | ЕГЭ-марафон | ХимияСкачать

Как сбалансировать: N2 + H2 = NH3 (синтез аммиака)Скачать

Интенсив. День 2. Таисия Фламель | ЕГЭ Химия. ВебиумСкачать

Пламегаситель - развод или необходимость?Скачать

2AZ-FE катализатор после раскоксовки GRENNOLСкачать

ЕГЭ. Химия. #Урок2. Термохимические уравненияСкачать

Химия — 9, 27.04.2020Скачать

замена катализатора на пламегаситель и прошивка на евро 2Скачать

Три основных преимущества воронки перед классическим коллекторным пламегасителемСкачать

ОШИБКИ при УДАЛЕНИИ КАТАЛИЗАТОРА #4Скачать

Влияние различных факторов на равновесие. Принцип смещения равновесия - Ле Шателье-Брауна. 10 класс.Скачать

Урок №9-4. Принцип Ле-Шателье (доп.тема) Beyond ChemistryСкачать