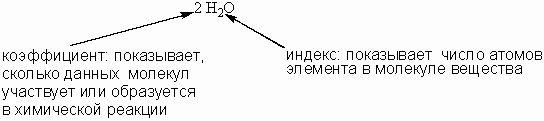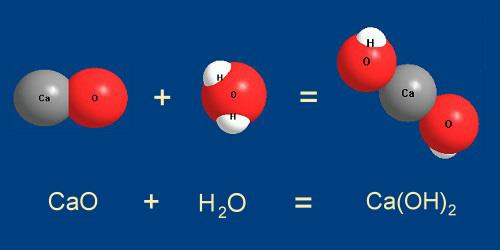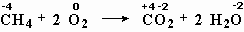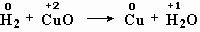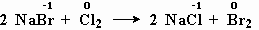Шпаргалка для 9 и 11 классов .Все уравнения химических реакций характерных для неорганических классов соединений, металлы, основные неметаллы. удобно пользоваться
в файле приведена систематизация неорганических соединений, химические свойства, , удобно для отработки при изучении и закреплении материала, как учителям так и учащимся .
Просмотр содержимого документа
«Шпаргалка для 9 и 11 классов .Все уравнения химических реакций»
справочник по органике для 9 классов
химические свойства предельные
1.вступают в реакции замещения с галогенами( F2 ,Cl2 Br2 I2)
2. горят с образованием углекислого газа и воды ( СО2, Н2О)
связи в молекуле все одинарные сигма (
суффикс ен двойная связь в молекуле сигма 
химические свойства непредельных этиленовых
1.вступают в реакции присоединения:
3. горят с образованием углекислого газа и воды ( СО2, Н2О)
суффикс ин двойная связь в молекуле сигма 
химические свойства непредельных ацетиленовых
1.вступают в реакции присоединения:
3. горят с образованием углекислого газа и воды ( СО2, Н2О)
в спиртах все связи сигма
химические свойства предельные спирты вступают в реакции;
2. горят с образованием углекислого газа и воды ( СО2, Н2О)
4. карбоновыми кислотами ( RCOOH)
имеется двойная связь между углеродом и кислородом
1. с основаниями( растворимыми и не растворимыми)
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Шпаргалка для решения химических уравнений
Определения основных классов соединений
1. Оксид – это сложное вещество, состоящее из двух элементов, один из которых кислород с валентностью II
Примеры оксидов: Na2O – оксид натрия, Al2O3 –оксид алюминия, H2O –оксид водорода (вода), CO2 – оксид углерода, P2O5 –оксид фосфора и т.д.
2. Кислота – это сложное вещество, состоящее из водорода и кислотного остатка. (Кислоты вы учили и знаете их)
3. Основание (щёлочь) – это сложное вещество, состоящее из металла и OH (гидрокси) группы. Например, NaOH-гидроксид натрия, Al(OH)3 –гидроксид алюминия и т.д.
4. Соль – это сложное вещество, состоящее из металла и кислотного остатка. Например, NaCl –хлорид натрия, CaCO3 – карбонат кальция (мел).
Свойства кислот, солей, оснований и оксидов
1. Кислота +металл = соль + водород
2. Кислота + оксид металла = соль + вода
3. Кислота + щелочь (основание) = соль + вода
4. Кислота + соль = другая соль +другая кислота
5. Соль +кислота = другая соль + другая кислота
6. Соль + щелочь = основание + другая соль
7. Соль 1 + соль 2 = соль 3 + соль 4
8. Соль + металл = другая соль + другой металл
9. Щелочь + оксид неметалла = соль + вода
10. Щелочь + соль = Основание +новая соль (основание нерастворимое, выпадает в осадок)
11. Щелочь (основание) + кислота = соль + вода (уже знакомая реакция, в свойствах кислот)
12. Нерастворимое основание =(t) оксид металла и вода (реакция разложения)
13. Оксид металла + вода = щелочь
14. Оксид металла + кислота = соль + вода (уже встречали это свойство в кислотах)
15. Оксид металла + оксид неметалла = соль
16. Оксид неметалла + щелочь = соль + вода
17. Оксид неметалла + вода = кислота
В каких случаях идёт реакция
1. Если металл в электрохимическом ряду напряжения стоит до водорода.
2. Металлы не должны взаимодействовать с водой, I и II группы ПСХЭ с водой реагируют.
3. В ходе реакции должна получится растворимая соль. (иначе образуется защитная пленка)
4. Реакция характерна для растворимых кислот. (кремниевая кислота не вступает в реакцию)
5. Концентрированные серная и растворы азотной кислоты реагируют иначе
6. Реакция идет до конца, если образуется осадок или газ.
7. Металл вытесняет из растворов солей все другие металлы расположенные правее его в электрохимическом ряду напряжений металлов
8. Обе соли должны быть растворимые
9. Металлы не должны взаимодействовать с водой (Металлы I и II группы, главной подгруппы с водой реагируют)
10. Оксид металла НЕ растворяется в воде (т.е. должно образоваться растворимое основание – щелочь)
11. Оксид неметалла нерастворим в воде.
Видео:Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Химия. Учебники по химии. Шпаргалки по химии.
§ 5.1 Химические реакции. Уравнения химических реакций
Химическая реакция — это превращение одних веществ в другие. Впрочем, такое определение нуждается в одном существенном дополнении. В ядерном реакторе или в ускорителе тоже одни вещества превращаются в другие, но такие превращения химическими не называют. В чем же здесь дело?
В ядерном реакторе происходят ядерные реакции. Они заключаются в том, что ядра элементов при столкновении с частицами высокой энергии (ими могут быть нейтроны, протоны и ядра иных элементов) — разбиваются на осколки, представляющие собой ядра других элементов. Возможно и слияние ядер между собой. Эти новые ядра затем получают электроны из окружающей среды и, таким образом, завершается образование двух или нескольких новых веществ. Все эти вещества являются какими-либо элементами Периодической системы. Примеры ядерных реакций, используемых для открытия новых элементов, приведены в §4.4.
В отличие от ядерных реакций, в химических реакциях не затрагиваются ядра атомов. Все изменения происходят только во внешних электронных оболочках. Разрываются одни химические связи и образуются другие.
Химическими реакциями называются явления, при которых одни вещества, обладающие определенным составом и свойствами, превращаются в другие вещества — с другим составом и другими свойствами. При этом в составе атомных ядер изменений не происходит.
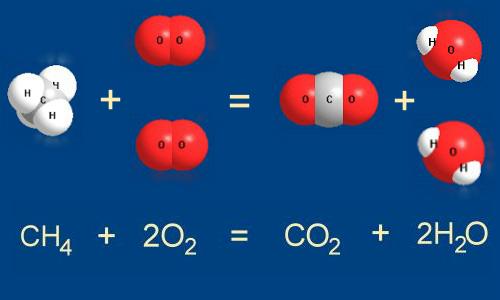
Рассмотрим типичную химическую реакцию: сгорание природного газа (метана) в кислороде воздуха. Те из вас, у кого дома есть газовая плита, могут ежедневно наблюдать эту реакцию у себя на кухне. Запишем реакцию так, как показано на рис. 5-1.
Рис. 5-1. Метан СН 4 и кислород О 2 реагируют между собой с образованием диоксида углерода СО 2 и воды Н 2 О. При этом разрываются связи между атомами С и Н в молекуле метана и между атомами кислорода в молекуле О 2 . На их месте возникают новые связи между атомами С и О, Н и О. На рисунке хорошо видно, что для успешного осуществления реакции на одну молекулу метана надо взять две молекулы кислорода.
Записывать химическую реакцию с помощью рисунков молекул не слишком удобно. Поэтому для записи химических реакций используют сокращенные формулы веществ — как это показано в нижней части рис. 5-1. Такая запись называется уравнением химической реакции .
Количество атомов разных элементов в левой и правой частях уравнения одинаково. В левой части один атом углерода в составе молекулы метана (СН 4 ), и в правой — тот же атом углерода мы находим в составе молекулы СО 2 . все четыре водородных атома из левой части уравнения мы обязательно найдем и в правой — в составе молекул воды.
В уравнении химической реакции для выравнивания количества одинаковых атомов в разных частях уравнения используются коэффициенты , которые записываются перед формулами веществ. Коэффициенты не надо путать с индексами в химических формулах.
Рассмотрим другую реакцию — превращение оксида кальция СаО (негашеной извести) в гидроксид кальция Са(ОН) 2 (гашеную известь) под действием воды.
Рис. 5-2. Оксид кальция СаО присоединяет молекулу воды Н 2 О с образованием
гидроксида кальция Са(ОН) 2 .
В отличие от математических уравнений, в уравнениях химических реакций нельзя переставлять левую и правую части. Вещества в левой части уравнения химической реакции называются реагентами , а в правой — продуктами реакции . Если сделать перестановку левой и правой части в уравнении из рис. 5-2, то мы получим уравнение совсем другой химической реакции:
Ca(OH) 2 = CaO + H 2 O
Если реакция между СаО и Н 2 О (рис. 5-2) начинается самопроизвольно и идет с выделением большого количества теплоты, то для проведения последней реакции, где реагентом служит Са(ОН) 2 , требуется сильное нагревание.
Добавим также, что реагентами и продуктами могут быть не обязательно молекулы, но и атомы — если в реакции участвует какой-нибудь элемент или элементы в чистом виде. Например:
H 2 + CuO = Cu + H 2 O
Существует несколько способов классификации химических реакций, из которых мы рассмотрим два способа.
По первому из них все химические реакции различают по признаку изменения числа исходных и конечных веществ . Здесь можно найти 4 типа химических реакций:
Приведем конкретные примеры таких реакций. Для этого вернемся к уравнениям получения гашеной извести и уравнению получения негашеной извести:
СаО + Н 2 О = Са(ОН) 2
Са(ОН) 2 = СаО + Н 2 О
Эти реакции относятся к разным типам химических реакций. Первая реакция является типичной реакцией соединения , поскольку при ее протекании две молекулы реагентов СаО и Н 2 О соединяются в одну, более сложную молекулу Са(ОН) 2 .
Вторая реакция Са(ОН) 2 = СаО + Н 2 О является типичной реакцией разложения : здесь реагент Ca(OH) 2 разлагается с образованием двух других, более простых веществ (продуктов реакции).
В реакциях обмена количество реагентов и продуктов обычно одинаково. В таких реакциях исходные вещества обмениваются между собой атомами и даже целыми составными частями своих молекул. Например, при сливании раствора CaBr 2 с раствором HF выпадает осадок. Происходит реакция, в которой ионы кальция и водорода обмениваются между собой ионами брома и фтора:
CaBr 2 + 2HF = CaF 2 ¯ + 2HBr
При сливании растворов CaCl 2 и Na 2 CO 3 тоже выпадает осадок, потому что ионы кальция и натрия обмениваются между собой частицами CO 3 2 — и Cl – .
CaCl 2 + Na 2 CO 3 = CaCO 3 ¯ + 2NaCl
Стрелка рядом с продуктом реакции показывает, что это соединение нерастворимо и выпадает в осадок. Таким образом, стрелку можно использовать и для обозначения удаления какого-нибудь продукта из химической реакции в виде осадка ( ¯ ) или газа ( ). Например:
Zn + 2HCl = H 2 + ZnCl 2
Последняя реакция относится к еще одному типу химических реакций — реакциям замещения . Цинк заместил водород в его соединении с хлором — в HCl. Водород при этом выделяется в виде газа.
Реакции замещения внешне могут быть похожи на реакции обмена. Отличие заключается в том, что в реакциях замещения обязательно участвуют атомы какого-нибудь простого вещества, которые замещают атомы одного из элементов в сложном веществе. Например:
2NaBr + Cl 2 = 2NaCl + Br 2 — реакция замещения ;
в левой части уравнения есть простое вещество-молекула хлора Cl 2 , и в правой части есть простое вещество – молекула брома Br 2 .
В реакциях обмена и реагенты и продукты являются сложными веществами. Например:
CaCl 2 + Na 2 CO 3 = CaCO 3 ¯ + 2NaCl — реакция обмена ;
в этом уравнении реагенты и продукты — сложные вещества.
Деление всех химических реакций на реакции соединения, разложения, замещения и обмена — не единственное. Есть другой способ классификации: по признаку изменения (или отсутствия изменения) степеней окисления у реагентов и продуктов. По этому признаку все реакции делятся на окислительно-восстановительные реакции и все прочие (не окислительно-восстановительные).
Реакция между Zn и HCl является не только реакцией замещения, но и окислительно-восстановительной реакцией , потому что в ней изменяются степени окисления реагирующих веществ:
Zn 0 + 2H +1 Cl = H 2 0 + Zn +2 Cl 2 — реакция замещения и одновременно окислительно-восстановительная реакция.
Окислительно-восстановительными являются также реакции метана с кислородом (рис. 5-1), реакция оксида меди с водородом, реакция бромида натрия с хлором.
меняют степень окисления углерод и кислород,
меняют степень окисления водород и медь,
меняют степень окисления бром и хлор.
А вот все остальные реакции, рассмотренные в этом параграфе, окислительно-восстановительными не являются, потому что в них не изменяются степени окисления атомов ни в реагентах, ни в продуктах.
5.1. На месте знаков “?” правильно заполните пропуски в уравнениях химических реакций:
Ca + 2HCl = Ca”?” + H 2
2H 2 ”?” + 3O 2 = 2H 2 O + 2SO 2
Fe 2 O 3 + 3H 2 = 2Fe + 3”?”O
CaCl 2 + 2NaOH = Ca(OH) 2 + 2Na”?”
5.2. Приведены 8 разных химических реакций. а) Найдите среди них реакции соединения, разложения, замещения и обмена. Запишите их уравнения в 4 столбика (по две реакции каждого типа в столбике); б) Уравняйте реакции; в) Подчеркните те реакции, которые являются окислительно-восстановительными. Укажите в них степени окисления атомов в реагентах и продуктах:
H 2 + O 2 = H 2 O (реакция идет со взрывом)
Zn + CuCl 2 = Cu + ZnCl 2 (реакция происходит в растворе)
NH 3 = N 2 + H 2 (реакция идет при нагревании в газовой фазе)
Cu + S = CuS (реакция идет при нагревании порошков Cu и S)
AgF + NaCl = AgCl ¯ + NaF (реакция происходит в растворе)
CaCO 3 = CaO + CO 2 (реакция происходит при нагревании)
CuBr 2 + NaOH = Cu(OH) 2 ¯ + NaBr (реакция происходит в растворе)
Fe + H 2 O = H 2 + Fe 2 O 3 (реакция происходит при нагревании)
🎦 Видео
Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Химия 8 класс (Урок№10 - Расчёты по уравнениям химических реакций.)Скачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Как решать задачи по химии? Расчет по уравнениям химических реакций | TutorOnlineСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

8 класс.Ч.1.Решение задач по уравнению реакций.Скачать

10 класс § 5 "Расчеты по уравнениям химических реакций"Скачать

Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

8 класс. Составление уравнений химических реакций.Скачать

ХИМИЧЕСКИЕ УРАВНЕНИЯ - Топ 5 Ошибок в уравнениях химических реакций // Подготовка к ЕГЭ по ХимииСкачать

Расчеты по уравнениям химических реакций. 2 часть. 8 класс.Скачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

Реакция на результаты ЕГЭ 2022 по русскому языкуСкачать

Химия 8 класс (Урок№7 - Закон сохранения массы веществ. Химические уравнения.)Скачать

Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 1 ч. 9 класс.Скачать