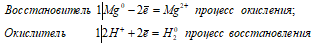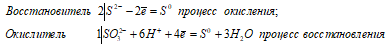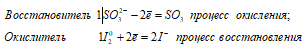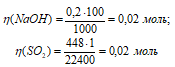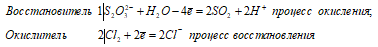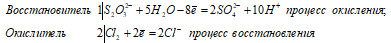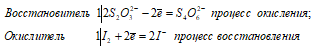Сернистая кислота H2SO3 – это двухосновная кислородсодержащая кислота. При нормальных условиях — неустойчивое вещество, которое распадается на диоксид серы и воду.
Валентность серы в сернистой кислоте равна IV, а степень окисления +4.
- Химические свойства
- Свойства сернистой кислоты и её взаимодействие с другими веществами
- Сернистая кислота — что она собой представляет
- Химические и физические свойства
- Качественная реакция на сернистую кислоту
- Способы получения и как применяется
- Характеристика окислительно-восстановительных свойств сернистой кислоты
- Тиосульфат натрия
- Тетратионовая кислота
- 📹 Видео
Видео:Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Химические свойства
1. Сернистая кислота H2SO3 в водном растворе – двухосновная кислота средней силы. Частично диссоциирует по двум ступеням:
HSO3 – ↔ SO3 2– + H +
2. Сернистая кислота самопроизвольно распадается на диоксид серы и воду:
3. Сернистая кислота взаимодействует с сильными основаниями и их оксидами.
Например , сернистая кислота реагирует с гидроксидами натрия и калия:
4. Наиболее ярко выражены восстановительные свойства сернистой кислоты. При взаимодействии с окислителями степень окисления серы повышается.
Например , сернистая кислота обесцвечивает бромную воду:
Азотная кислота очень легко окисляет сернистую:
Озон также окисляет сернистую кислоту:
Качественная реакция на сернистую кислоту – обесцвечивание раствора перманганата калия:
5. В присутствии сильных восстановителей сернистая кислота может проявлять окислительные свойства.
Например , при взаимодействии с сероводородом сернистая кислота восстанавливается до молекулярной серы:
Видео:Химия | Молекулярные и ионные уравненияСкачать

Свойства сернистой кислоты и её взаимодействие с другими веществами
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Сернистая кислота — что она собой представляет
Сернистая кислота — это двухосновная кислородсодержащая кислота.
Сернистая кислота является неустойчивым веществом, распадающимся на диоксид серы S O 2 и воду. Валентность серы в сернистой кислоте равна IV, а степень окисления: +4. Структурная формула выглядит так:
Формула серной кислоты в химии — H 2 S O 4 . Степень окисления серы: +6. Данные характеристики отличают соединение от сернистой кислоты. Серная кислота может существовать в виде разбавленных и концентрированных растворов. Сернистую кислоту лишь называют кислотой, так как вещество может существовать в только в разбавленном водном растворе, в чистом виде не выделяется. В процессе концентрации определенное количество кислоты, которое превышает максимальную концентрацию, распадается. В результате происходит образование воды и сернистого ангидрида S O 2 . По этой причине водный раствор сернистой кислоты всегда обладает запахом сернистого ангидрида, то есть сгоревшей головки спички. Серная кислота не имеет запаха. Концентрированная серная кислота практически в два раза тяжелее, чем сернистая.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Химические и физические свойства
Сернистый ангидрид S O 2 представляет собой бесцветный газ и обладает резким запахом.
Физические свойства сернистой кислоты:
- не имеет цвета;
- существует только в водном растворе;
- имеет характерный резкий запах;
- хорошо растворяется в воде;
- при контакте с красителями обесцвечивает их;
- убивает микроорганизмы.
Сернистая кислота в водном растворе является слабым электролитом. Диссоциация протекает обратимо по двум ступеням.
H 2 S O 3 ↔ H S O 3 – + H +
H S O 3 – ↔ S O 3 2 – + H +
В процессе самопроизвольного распада сернистой кислоты образуются диоксид серы и вода.
H 2 S O 3 ↔ S O 2 + H 2 O
Сернистая кислота вступает в химическую реакцию с сильными основаниями и их оксидами.
Взаимодействие сернистой кислоты с гидроксидами таких щелочных металлов, как натрий и калий, описывается уравнениями:
H 2 S O 3 + К О Н → K H S О 3 + H 2 O
H 2 S O 3 + 2 К О Н → К 2 S О 3 + 2 H 2 O
Среди всех химических свойств сернистой кислоты наиболее ярко выражены ее восстановительные свойства. Взаимодействуя с окислителями, сера повышают собственную степень окисления.
Обесцвечивание бромной воды с помощью сернистой кислоты:
H 2 S O 3 + B r 2 + H 2 O → H 2 S O 4 + 2 H B r
Процесс окисления сернистой кислоты азотной протекает достаточно легко по уравнению:
H 2 S O 3 + 2 H N O 3 → H 2 S O 4 + 2 N O 2 + H 2 O
Окисление сернистой кислоты с помощью озона:
H 2 S O 3 + O 3 → H 2 S O 4 + O 2
При контакте с сильными восстановителями могут проявляться окислительные свойства сернистой кислоты.
Взаимодействие сернистой кислоты и сероводорода сопровождается ее восстановлением до элементарной серы:
H 2 S O 3 + 2 Н 2 S → 3 S + 3 H 2 O
Видео:составляем молекулярные уравнения по сокращённым ионнымСкачать

Качественная реакция на сернистую кислоту
Качественная реакция на сернистую кислоту представляет собой обесцвечивание раствора перманганата калия:
5 H 2 S O 3 + 2 K M n O 4 → 2 H 2 S O 4 + 2 M n S O 4 + K 2 S O 4 + 3 H 2 O
Качественная реакция на соли сернистой кислоты (сульфиты) представляет собой химическую реакцию их растворов с сильными кислотами, которая сопровождается выделением газа S O 2 , обладающего резким запахом:
N a 2 S O 3 + 2 H C l → 2 N a C l + S O 2 ↑ + H 2 O
2 H + + S O 3 2 – → S O 2 ↑ + H 2 O
Видео:Химия 9 класс (Урок№12 - Оксид серы (IV). Сернистая кислота и ее соли.)Скачать

Способы получения и как применяется
Сернистую кислоту синтезируют с помощью растворения сернистого газа ( S O 2 ) в воде ( H 2 O ) . Процесс можно наблюдать опытным путем. Необходимо взять концентрированную серную кислоту ( H 2 S O 4 ) , медь ( C u ) и пробирку. Алгоритм действий таков:
- аккуратно добавить в пробирку концентрированную серную кислоту;
- поместить в пробирку, содержащую кислоту, кусочек меди;
- смесь требуется нагреть.
Далее можно наблюдать реакцию, протекающую по уравнению:
C u ( м е д ь ) + 2 H 2 S O 4 ( с е р н а я к и с л о т а ) = C u S O 4 ( с у л ь ф а т с е р ы ) + S O 2 ( с е р н и с т ы й г а з ) + H 2 O ( в о д а )
Затем поток сернистого газа следует направить в пробирку с водой. При нахождении в ней газообразное вещество растворяется, частично протекает химическая реакция с водой. В итоге синтезируется сернистая кислота:
S O 2 ( с е р н и с т ы й г а з ) + H 2 O ( в о д а ) = H 2 S O 3
Таким образом с помощью пропускания сернистого газа через воду получают сернистую кислоту.
В процессе экспериментов с сернистым газом необходимо использовать индивидуальные средства защиты, так как вещество раздражает слизистую оболочку дыхательных путей. Подобное воздействие сопровождается воспалительным процессом и потерей аппетита. Длительное вдыхание сернистого газа приводит к потере сознания.
Сернистая кислота нашла применение в качестве восстановителя. Вещество используют для беления шерсти, шелка и других материалов, которые не способны выдержать отбеливание сильными окислителями в виде хлора. Сернистую кислоту используют в процессе консервирования плодов и овощей, а также для:
- обесцвечивания натуральных тканей, древесной массы, бумаги;
- консервации, антисептической обработки — к примеру, для защиты от ферментации зерна в производстве крахмала, предотвращения процесса брожения в бочках вина;
- переработки древесной щепы в сульфитную беленую целлюлозу, необходимую для изготовления бумаги.
В процессе обработки древесного сырья на бумажном производстве используют раствор гидросульфита кальция ( C a ( H S O 3 ) 2 ) . Вещество является растворителем лигнина, который связывает волокна целлюлозы.
Видео:СЕРНАЯ КИСЛОТА разбавленная и концентрированная - в чем отличия? | Химия ОГЭСкачать

Характеристика окислительно-восстановительных свойств сернистой кислоты
Задача 863.
Какие свойства, окислительные или восстановительные, проявляет сернистая кислота при ее взаимодействии: а) с магнием; б) с сероводородом; в) с йодом? Какой из входящих в ее состав ионов обусловливает эти свойства в каждом из указанных случаев?
Решение:
а) Mg + H2SO3 ↔ MgSO3 + H2↑
Уравнения ионно-молекулярного баланса:
Mg 0 + 2H + = Mg 2+ + H2 0
Таким образом, сернистая кислота проявляет свойства окислителя, уменьшая степень окисления водорода от +2 до 0.
2S 2- + SO3 2 — + 6H + ↔ 3S 0 + 3H2O
Таким образом, сернистая кислота проявляет свойства восстановителя, увеличивая свою степень окисления серы от -2 до 0.
Таким образом, сернистая кислота проявляет свойства восстановителя, увеличивая степень окисления серы от +4 до +6.
Видео:Реакции ионного обмена. 9 класс.Скачать

Тиосульфат натрия
Задача 864.
Через 100 мл 0,2 н. раствора NаОН пропустили 448 мл SO2 (условия нормальные). Какая соль образовалась? Найти ее массу.
Решение:
Уравнение реакции имеет вид:
Находим количество NaOH и SO2:
Из уравнения реакции вытекает, что из 2 молей NaOH и 1 моля SO2 образуются 1 моль Na2SO3, значит , NaOH взято в недостатке, поэтому расчет массы Na2SO3 производим по количеству NaOH. Исходя из этих рассуждений в результате реакции из 0,02 моль NaOH образовалось 0,01 моль Na2SO3.
Рассчитаем массу Na2SO3, учитывая, что М( Na2SO3) равна 126 г/моль, получим:
m( Na 2SO 3) = M( Na 2SO 3) . n( Na 2SO 3) = 126 . 0,01 = 1,26 г.
Ответ: m( Na 2SO 3) = 126 г.
Тетратионовая кислота
Написать уравнения реакций взаимодействия тиосульфата натрия: а) с хлором (при его недостатке и при его избытке); б) с йодом.
Решение:
а) Взаимодействие тиосульфата натрия с хлором (при его недостатке):
S2O3 2- + 2Cl2 0 + H2O ↔ 2SO 2 ↑ + 4Cl — + 2H +
Na 2 S 2 O 3 + 2Cl 2 + H 2 O ↔ 2NaCl + 2SO 2 ↑ + 2HCl
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от -2 до +4.
б) Взаимодействие тиосульфата натрия с хлором (при его избытке):
S2O3 2- + 4Cl2 0 + 5H2O ↔ 2SO4 2- + 8C l- + 10H +
Na 2 S 2 O 3 + 4Cl 2 + 5H 2 O ↔ + 2H 2 SO 4 + 2NaCl + 6HCl
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от 0 до +4, другого – от +4 до +6.
в) Под действием слабого окислителя тиосульфат натрия окисляется до соли тетратионовой кислоты H2S4O6.
Взаимодействие тиосульфата натрия с йодом:
2 Na 2 S 2 O 3 + I 2 ↔ Na 2 S 4 O 6 + 2NaI
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от 0 до +4.
Под действием слабого окислителя йода тиосульфат натрия окисляется до соли тетратионовой кислоты H 2 S 4 O 6 .
📹 Видео
Соединения серы. 9 класс.Скачать

Реакции ионного обмена. 9 класс.Скачать

Ионные уравнения реакций. По сокращенному ионному уравнению составляем полное ионное и молекулярное.Скачать

КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Химия 9 класс (Урок№13 - Оксид серы (VI). Серная кислота и ее соли.)Скачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Серная кислота и ее соли. 9 класс.Скачать

9 класс. Реакции ионного обмена. Ионные уравнения.Скачать

Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

РЕАКЦИИ ИОННОГО ОБМЕНА и условия их протекания | Как составлять молекулярные и ионные уравненияСкачать

Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать