Материалы в помощь студентам и научным работникам
Видео:Серная кислота и ее соли. 9 класс.Скачать

Задание с ответами: химия. ЕГЭ — 2018
Для выполнения задания используйте следующий перечень веществ: серная кислота, сероводород, карбонат натрия, вода, марганцовая кислота. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Сведения для решения
Для начала запишем молекулярные формулы данных веществ: 


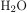

Условия реакций ионного обмена (РИО):
1) Растворимость реагирующих веществ:
Кислота + Основание. Растворим хотя бы 1 из реагентов
Кислота + Соль. Обязательно растворима должна быть кислота
Основание + Соль. Растворимы оба реагента
Соль + Соль. Должны быть обе растворимы
2) В ходе реакции должны образоваться осадок, газ или вода.
Вода не вступает в реакцию ионного обмена.
Серная кислота растворимая кислота, вступает в реакцию с растворимой солью карбоната натрия (в эквивалентных количествах образуется сульфат натрия, в избытке кислоты гидросульфат) с образованием углекислого газа и воды. Не вступает в РИО с кислотами: сероводородом и марганцевой кислотой.
Сероводородная кислота — растворимая кислота, вступает в реакцию с растворимой солью карбоната натрия (образуется гидросульфид, так как кислота слабая и полностью не диссоциирует) с образованием углекислого газа и воды. Не вступает в РИО с кислотами: серной и марганцевой кислотой.
Марганцовая кислота — растворимая кислота, вступает в реакцию с растворимой солью карбоната натрия с образованием углекислого газа и воды. Не вступает в РИО с кислотами.
Первый вариант ответа:






Второй вариант ответа:
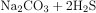





Третий вариант ответа:






Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Задачи 30 и 31 из реального ЕГЭ по химии
Задания 30 и 31 из реального ЕГЭ по химии-2021 — ответы и решения, все задачи на окислительно-восстановительную реакцию и реакции ионного обмена из реального экзамена ЕГЭ по химии, задания 32 из реального ЕГЭ 2021 (основная волна и резервные дни — 30 мая 2021 года) с текстовыми решениями и ответами.
| Выдержка из формулировки каждого варианта 30 задания: «В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.» Выдержка из формулировки каждого варианта 31 задания: «Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.» Ниже приведены перечни веществ, а также дополнительные условия, которые были указаны в соответствующем варианте 30 и 31 задания. 1) Если вещество растворимо в воде, то допустимо использование водного раствора этого вещества. 2) Если концентрация кислоты указана, то следует использовать кислоту указанной концентрации. 3) Если концентрация кислоты не указана, то можно использовать и разваленную и концентрированную кислоту. |
1. Сульфид меди(II), гидросульфат калия, гидроксид бария, фосфин, гидроксид алюминия, азотная кислота.
Задание 30. Из предложенного перечня веществ выберите те, которые вступают в окислительно-восстановительную реакцию с образованием бесцветного раствора. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня веществ выберите те, между которыми реакция ионного обмена протекает без видимых признаков. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
1 | P -3 — 8e → P +5
8 | N +5 + 1e → N +4
Азот в степени окисления +5 (или азотная кислота) является окислителем.
Фосфор в степени окисления -3 (или фосфин) является восстановителем.
Ba 2+ + 2OH — + 2H + + 2NO3 — = Ba 2+ + 2NO3 — + 2H2O
2. Гидрокарбонат калия, нитрат алюминия, оксид фосфора(V), азотная кислота, сульфид меди(II), гидроксид бария.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием окрашенного раствора. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите кислую соль и вещество, между которыми протекает реакция ионного обмена с образованием осадка и выделением газа. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
1 | S -2 — 8e → S +6
Азот в степени окисления +5 (или азотная кислота) является окислителем .
Сера в степени окисления -2 (или сульфид меди (II)) является восстановителем.
3. Оксид серы(IV), перманганат калия, гидроксид магния, бромоводородная кислота, аммиак, гидроксид железа(III).
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием в растворе двух солей и кислоты. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите вещества, между которыми протекает реакция ионного обмена и происходит растворение белого осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2 | Mn +7 + 5e → Mn +2
5 | S +4 — 2e → S +6
Марганец в степени окисления +7 (или перманганат калия) является окислителем
Сера в степени окисления +4 (или оксид серы (IV)) является восстановителем
Mg(OH)2 + 2H + + 2Br — = Mg 2+ + 2Br — + 2H2O
4. Перманганат натрия, нитрит натрия, гидроксид натрия, гидрокарбонат бария, серная кислота, гидрокарбонат магния.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием зеленого раствора и без образования осадка. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите вещества, между которыми реакция ионного обмена протекает с выделением газа и без образования осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2 | Mn +7 + 1e → Mn +6
1 | N +3 — 2e → N +5
Марганец в степени окисления +7 (или перманганат натрия) является окислителем.
Азот в степени окисления +3 (или нитрит натрия) является восстановителем.
5. Аммиак, перманганат калия, гидросульфат лития, нитрат стронция, иод, сульфит натрия.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием нерастворимого вещества и без выделения газа. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите кислую соль и вещество, между которыми протекает реакция ионного обмена с образованием осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2 | Mn +7 + 3e → Mn +4
3 | S +4 — 2e → S +6
Марганец в степени окисления + 7 (или перманганат калия) является окислителем
Сера в степени окисления + 4 (или сульфит натрия) является восстановителем
Li + + HSO4 — + Sr 2+ + 2NO3 — = SrSO4 + Li + + H + + 2NO3 —
6. Гидрофосфат калия, сульфит кальция, перманганат калия, хлороводород, гидроксид железа(III), нитрат марганца(II).
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием осадка. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите кислую соль и вещество, между которыми протекает реакция ионного обмена без видимых признаков. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2 | Mn +7 + 3e → Mn +4
3 | S +4 — 2e → S +6
Марганец в степени окисления + 7 (или перманганат калия) является окислителем
Сера в степени окисления + 4 (или сульфит кальция) является восстановителем
2K + + HPO4 2- + 2H + + 2Cl — = 2K + + 2Cl — + H3PO4
7. Сероводород, карбонат аммония, сульфат железа(II), дихромат калия, серная кислота, хлорид натрия.
Задание 30. Из предложенного перечня выберите вещества, между которыми в растворе протекает окислительно-восстановительная реакция с образованием трех солей. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите два сильных электролита, между которыми протекает реакция ионного обмена с образованием осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
1 | Cr +6 + 3e → Cr +3
3 | Fe +2 — e → Fe +3
Хром в степени окисления + 6 (или дихромат калия) является окислителем
Железо в степени окисления + 2 (или сульфат железа (II)) является восстановителем
8. Бромид кальция, гидрофосфат аммония, перманганат калия, серная кислота, нитрат калия, медь.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием бурого газа и не сопровождается выпадением осадка. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите две соли, между которыми протекает реакция ионного обмена с образованием осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
1 | Cu 0 — 2e → Cu +2
Азот в степени окисления + 5 (или нитрат калия) является окислителем
Медь в степени окисления 0 является восстановителем
Ca 2 + + 2Br — + 2NH4 + + HPO4 2- = CaHPO4 + 2NH4 + + 2Br —
9. Бромоводород, гидросульфат калия, перманганат калия, графит, нитрат серебра, ацетат бария.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием простого вещества. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите две соли, между которыми протекает реакция ионного обмена с образованием белого осадка. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
2 | Mn +7 + 5e → Mn +2
5 | 2Br — — 2e → Br2 0
Марганец в степени окисления + 7 (или перманганат калия) является окислителем
Бром в степени окисления -1 (или бромоводород) является восстановителем
Ba 2 + + 2CH3COO — + K + + HSO4 — = BaSO4 + CH3COO — + K + + CH3COOH
10. Оксид хрома(III), дихромат аммония, гидрокарбонат натрия, графит, хлорид железа(III), серная кислота.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием двух кислотных оксидов. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите две соли, между которыми протекает реакция ионного обмена с образованием осадка и выделением газа. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
1 | C 0 — 4e → C +4
2 | S +6 + 2e → S +4
Сера в степени окисления + 6 (или серная кислота) является окислителем
Углерод в степени окисления 0 является восстановителем
Fe 3 + + 3Cl — + 3Na + + 3HCO3 — = Fe(OH)3 + 3CO2 + 3Na + + 3Cl —
11. Оксид серы(IV), гидроксокарбонат меди(II), перманганат калия, дигидрофосфат натрия, аммиак, гидроксид калия.
Задание 30. Из предложенного перечня выберите вещества, окислительно-восстановительная реакция между которыми протекает с образованием осадка и выделением газа. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите кислую соль и вещество, которое вступает с этой кислой солью в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
1 | 2N -3 — 6e → N2 0
2 | Mn +7 + 3e → Mn +4
Марганец в степени окисления + 7 (или перманганат калия) является окислителем
Азот в степени окисления -3 (или аммиак) является восстановителем
3Na + + 3H2PO4 — + 6K + + 6OH — = 6K + + 2PO4 3- + 3Na + + PO4 3- + 6H2O
12. Оксид хрома(VI), хлорид железа(II), азотная кислота, аммиак, иод, фторид аммония.
Задание 30. Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с образованием кислоты. При этом одна молекула восстановителя . отдает десять электронов. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите два сильных электролита, между которыми протекает реакция ионного обмена без видимых признаков. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
1 | I2 0 — 10e → 2I —
10 | N +5 + 1e → N +4
Азот в степени окисления +5 (или азотная кислота) является окислителем
Йод в степени окисления 0 является восстановителем
13. Оксид серы(IV), фосфин, аммиак, дигидрофосфат натрия, пероксид натрия, гидроксид натрия.
Задание 30. Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с образованием щелочи и выделением газа. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите кислую соль и вещество, между которыми протекает реакция ионного обмена с образованием средней соли. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
1 | 2N -3 — 6e → N2 0
6 | O -1 + 1e → O -2
Азот в степени окисления -3 (или аммиак) является восстановителем
Кислород в степени окисления -1 (или пероксид натрия) является окислителем
14. Серная кислота, гидросульфат аммония, фосфин, сульфид меди(II), гидроксид бария, гидроксид хрома(III).
Задание 30. Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает с образованием бесцветного раствора кислоты. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите вещества, между которыми протекает реакция ионного обмена с образованием окрашенного раствора и без выделения газа. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
1 | P -3 — 8e → P +5
4 | S +6 + 2e → S +4
Фосфор в степени окисления -3 (или фосфин) является восстановителем
Сера в степени окисления +6 (или серная кислота) является окислителем
15. Бром, нитрат бария, гидроксид хрома(III), гидрокарбонат калия, оксид серы(IV), нитрат алюминия.
Задание 30. Из предложенного перечня выберите вещества, между которыми окислительно-восстановительная реакция протекает в растворе с образованием двух кислот. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель
Задание 31. Их предложенного перечня выберите вещества, между которыми протекает реакция ионного обмена с образованием осадка и выделением газа. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
1 | S +4 — 2e → S +6
1 | Br2 0 + 2e → 2Br —
Фосфор в степени окисления -3 (или фосфин) является восстановителем
Сера в степени окисления +6 (или серная кислота) является окислителем
Видео:Химия 9 класс (Урок№13 - Оксид серы (VI). Серная кислота и ее соли.)Скачать

Серная кислота сероводород карбонат натрия вода марганцовая кислота ионное уравнение
Для выполнения задания используйте следующий перечень веществ: серная кислота, сероводород, карбонат натрия, вода, марганцовая кислота. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Для выполнения задания используйте следующий перечень веществ: серная кислота, сероводород, карбонат натрия, вода, марганцовая кислота. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Запишем уравнение реакции:
Составим электронный баланс:
Сера в степени окисления −2 является восстановителем, а марганец в степени окисления +7 — окислителем.
некорректное задание, так как возможен второй вариант ОВР: сероводород+серная кислота
Данное задание подразумевает, что правильный ответ может быть не один. В решении достаточно привести хотя бы 1 правильный ответ.
Для начала запишем молекулярные формулы данных веществ: ,
,
,
,
.
Условия реакций ионного обмена (РИО):
1) Растворимость реагирующих веществ:
Кислота + Основание. Растворим хотя бы 1 из реагентов
Кислота + Соль. Обязательно растворима должна быть кислота
Основание + Соль. Растворимы оба реагента
Соль + Соль. Должны быть обе растворимы
2) В ходе реакции должны образоваться осадок, газ или вода.
Серная кислота растворимая кислота, вступает в реакцию с растворимой солью карбоната натрия (в эквивалентных количествах образуется сульфат натрия, в избытке кислоты гидросульфат) с образованием углекислого газа и воды. Не вступает в РИО с кислотами: сероводородом и марганцевой кислотой.
Сероводородная кислота — растворимая кислота, вступает в реакцию с растворимой солью карбоната натрия (образуется гидросульфид, так как кислота слабая и полностью не диссоциирует) с образованием углекислого газа и воды. Не вступает в РИО с кислотами: серной и марганцевой кислотой.
Марганцовая кислота — растворимая кислота, вступает в реакцию с растворимой солью карбоната натрия с образованием углекислого газа и воды. Не вступает в РИО с кислотами.
Первый вариант ответа:
→
↑
→
↑
→
↑
Второй вариант ответа:
→
→
→
Третий вариант ответа:
→
↑
→
↑
→
↑
| Критерии оценивания выполнения задания | Баллы |
|---|---|
| Ответ правильный и полный, содержит следующие элементы: − выбраны вещества, и записано молекулярное уравнение реакции ионного обмена; 🔥 ВидеоХимия 9 класс (Урок№11 - Сера. Серовород. Сульфиды.)Скачать  СЕРНАЯ КИСЛОТА разбавленная и концентрированная - в чем отличия? | Химия ОГЭСкачать  Химия ЕГЭ 2022 / Задание 30Скачать  ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать  Серная кислота и металлы за 10 минут | ХИМИЯ ЕГЭ | СОТКАСкачать  Сероводород и сульфиды. 11 класс.Скачать  8 класс. Массовая доля растворенного вещества. Решение задач.Скачать  Все про серную кислоту | Химия ОГЭ 2023 | УмскулСкачать  Химия ЕГЭ 2022 / Задание 31Скачать  Серная кислота. Химические свойства. Реакции с металлами.Скачать  ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать  Лабораторная работа №3 Гидролиз. Кислотно-основные взаимодействия в растворахСкачать  Серный ангидрид Серная кислота СульфатыСкачать  Разбираем ВСЕ ОПЫТЫ с гидроксидами | ЕГЭ по химии | Катя СтрогановаСкачать  Свойства серной кислотыСкачать  Соединения серы. 9 класс.Скачать  Концентрированная серная кислота и ее особые свойства | Химия ЕГЭ | УмскулСкачать  |