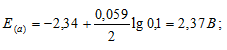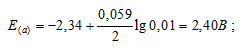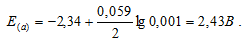Задача 652.
Гальванический элемент состоит из серебряного электрода, погруженного в 1 М раствор AgNO3, и стандартного водородного электрода. Написать уравнения электродных процессов и суммарной реакции, происходящей при работе элемента. Чему равна его э.д.с.?
Решение: 


H20 — 2 
Серебро, потенциал которой +0,80 В, — катод, т.е. электрод, на котором протекает восстановительный процесс:
Ag + + 2 
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного и катодного процессов, получим
Видео:Продукты в ОВР. Ч.2-1. Электродный потенциал металлов.Скачать

H20 + 2Ag + = 2H + + 2Ag 0
Для определения ЭДС гальванического элемента необходимо из потенциала катода вычесть потенциал анода, т.е. при вычислении ЭДС элемента меньший электродный потенциал вычитается из большего (в алгебраическом смысле), получим:


Ответ: +0,80В.
Задача 653.
Э. д. с. гальванического элемента, состоящего из стандартного водородного электрода и свинцового электрода, погруженного в 1 М раствор соли свинца, равна 126 мВ. При замыкании элемента электроны во внешней цепи перемещаются от свинцового к водородному электроду. Чему равен потенциал свинцового электрода? Составить схему элемента. Какие процессы протекают на его электродах?
Решение: 
Pb 0 — 2 
А на водородном – восстановительный:
2H + + 2 
Видео:Гальванические элементы. 1 часть. 10 класс.Скачать

Таким образом, свинцовый электрод будет анодом, а водородный – катодом.
Уравнение окислительно-восстановительного процесса, протекающего при работе данного гальванического элемента, можно получить, сложив электронные процессы на электродах:
Pb 0 + 2H + = Pb 2+ + H2 0
Для расчета электродного потенциала свинца, можно использовать уравнение определения ЭДС гальванического элемента:
E = 

Видео:Электродные потенциалы металлов. Электроды сравненияСкачать

Подставив в уравнение данные задачи, получим:
Е = 



Ответ: -0,126В.
Задача 654.
Рассчитать электродные потенциалы магния в растворе его соли при концентрациях иона Mg 2+ 0,1, 0,01 и 0,001 молы/л.
Решение:
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация (при точных измерениях активность) гидратированных ионов металла в растворе. Е 0 для магния равен -2,34 В.
Определим электродные потенциалы магния в растворах при разных значениях концентрации его ионов:
Видео:Уравнение Нернста. Задачи на расчет потенциалов. Продукты в ОВР. Ч.5-2.Скачать

а) Mg 2+ = 0,1 молы/л.
б) Mg 2+ = 0,01 молы/л.
в) Mg 2+ = 0,001 молы/л.
Ответ: а) 2,37 В; б) 2,40 В; в) 2,43 В.
Видео:Почему липнут электроды и как с этим бороться!? / УОНИ 13/55Скачать

Серебряный электрод и его уравнение
Электроды второго рода представляют собой металлические электроды, покрытые слоем труднорастворимой соли того же металла. При погружении в раствор соли одноименного аниона его потенциал будет определяться активностью иона в растворе.
а) Хлорсеребряный электрод (ХСЭ) Ag, AgCl|Cl – представляет собой серебряный проводник, покрытый твердым AgCl, который погружен в насыщенный раствор KCl.
Серебро электрохимически взаимодействует со своим ионом:
| Ag + + e – = Ag. |
Уравнение Нернста для этого процесса:
| (7.2) |
Однако в присутствии труднорастворимого AgCl активность ионов серебра очень мала и ее трудно определить. Но активность ионов Ag + связана с легко задаваемой в данной системе активностью ионов Cl – произведением растворимости хлорида серебра ПРAgCl:
 |
откуда
 |
Подставляя это выражение в (7.2)
 |
и обозначив
 |
получим уравнение Нернста для хлорсеребряного электрода:
|
Потенциалопределяющими являются ионы хлора, а электродный процесс может быть представлен уравнением
 |
б) Каломельный электрод (КЭ) Hg, Hg2Cl2|Cl – – это ртуть, находящаяся в контакте с пастой из смеси ртути и каломели Hg2Cl2, которая, в свою очередь, соприкасается с насыщенным раствором KCl.
Видео:Электроды и гальванические элементыСкачать

Принцип действия каломельного электрода тот же, что и хлорсеребряного.
📹 Видео
Разная чувствительность поджига электродовСкачать

Какие электроды выбрать? | Обмазки электродов | Виды электродовСкачать

Основной электрод без отрыва. Труба 76х3,2.Скачать

Как правильно выбрать электроды? Урок 6Скачать

Как расспознать тип электродов и понять для чего они применяются?!Скачать

Как делают сварочные электродыСкачать

4 3 Электрохимический потенциалСкачать

Каким должен быть наклон электрода? | АКАДЕМИЯ СВАРГО #shortsСкачать

Лекция 68 Газовые электродыСкачать

Классификация электродов 1Скачать

Электроды УОНИ или МР3, АНО, ОК46, ОЗС (рутиловые), Lb-52U, какие выбрать? Или УОНИИ правильно?Скачать

Лекция 6 Водородный электрод в качестве электрода сравненияСкачать

Не выбрасывайте старые электроды!Скачать

Электроды LB 52U. Пенза против Японии.Скачать