Серебро известно человеку с древности, что связано, в первую очередь с тем, что оно встречается в природе в виде самородков.
Серебро является одним из самых распространенных в земной коре благородных металлов — содержание серебра в земной коре составляет 7·10 -6 по массе, наиболее богаты серебром глинистые сланцы (1 г на тонну). Современной науке известно порядка 60 минералов, в состав которых входит серебро.
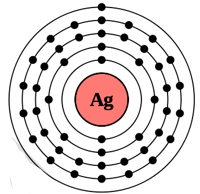
Рис. Строение атома серебра.
Электронная конфигурация атома серебра — 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 1 (см. Электронная структура атомов). Серебро является химически неактивным металлом.
Физические свойства серебра:
- блестящий мягкий металл белого цвета;
- обладает хорошей пластичностью;
- имеет среди всех металлов самую высокую теплопроводность и электропроводность.
Химические свойства серебра:
- при н. у. не реагирует с кислородом, при нагревании до 170°C покрывается оксидной пленкой: 4Ag + O2 = 2Ag2O;
- не реагирует с водой, щелочными растворами;
- с концентрированной серной кислотой реагирует при нагревании: 2Ag + 2H2SO4 = Ag2SO4 + SO2 + 2H2O;
- легко реагирует с азотной кислотой, как разбавленной, так и концентрированной: Ag + 2HNO3(конц.) = AgNO3 + NO2 + H2O.
Применение серебра:
- для получения сплавов с другими металлами;
- в производстве аккумуляторов большой емкости;
- в ювелирном деле;
- в чеканке монет;
- в качестве катализатора химических процессов.
Наиболее распространенные соединения серебра:
- оксид серебра Ag2O;
- гидроксид серебра AgOH;
- галогениды AgCl, AgBr, AgI — применяются в производстве кино- и фотопленки;
- нитрат серебра AgNO3 — растворимое в воде соединение, применяется в фотографии, для серебрения зеркал, для получения других соединений серебра.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Серебро с водой
Радиоактивная еда. Прилагательное образовано от слова «радий». Элемент открыли на рубеже 19-го и 20-го веков. Тогда вещество добавляли в пищу, лекарства и косметику. «Радиоактивность сохраняет ясность ума, бодрость и счастливое настроение».
Это цитата из «Журнала Клинической Медицины» выпуска 1923-го года. Теперь, радий объявлен ядом. В 21-ом веке люди предпочитают добавлять в косметику и пищу не радиоактивные вещества. К примеру, в тренде вода с ионами серебра. В чем ее польза и, нет ли у «медали» обратной стороны, как в случае с радием?
Серебряная вода и механизм ее действия
Ионизация воды серебром приводит к повышенному содержанию металла в жидкости. Считается, что такой напиток лечебный. В первую очередь, медики указывают на антимикробное действие серебра. Бактерий белый металл, действительно, убивает.
Серебро, с водой поступая в организм, собирается клеточными мембранами (оболочками). При этом, бактерии теряют способность делиться. Блокируется размножение, блокируется и развитие болезни. При превышении норм серебра, клетки не только не делятся, они гибнут. Звучит заманчиво.
Серебро для воды используют с древности. Еще Геродот в своих трудах указывал, что персидская армия хранит питьевую воду в сосудах из белого металла. Заметка относится к войскам царя Кира, правившего в 5-ом веке до нашей эры. Древнегреческий историк писал так же, что серебряную посуду на полях сражений используют, чтобы напитки не портились даже в сильную жару, чтобы у воинов не было дизентерии и прочих недугов.
Однако, оговорка состоит в том, что древние применяли посуду, а не добавляли серебро в саму воду. Белый металл относится к тяжелым. Его токсичность в несколько раз выше, чем у свинца. Благотворное влияние серебряных емкостей на напитки связано с малой инертностью драгоценного элемента.
Он не вступает в реакцию с большинством веществ, даже кислотами, что уж говорить о воде. От посуды в нее проникает ничтожное число ионов. Но, их достаточно, чтобы обеззаразить воду. Большее количество металла для здоровья опасно.
Не зря санитарной службой установлены строгие ограничения на содержание белого элемента в пище. На 1 кубический дециметр серебра не должно быть больше 0,05 миллиграмм. Драгоценному металлу присвоен 2-ой класс опасности. Для сравнения, у ртути – первый, а у европия и хлоридов – четвертый.
Воздействие серебра одинаково на все клетки, не только вредоносные. Грубо говоря, серебро очищает воду и организм от всех бактерий, в том числе, и полезных. То есть, действие металла сродни антибиотикам, которые, как известно, применяют лишь в крайних случаях.
Надо отметить, что серебро обладает малой всасываемостью. К примеру, в кишечнике вещество не задерживается. Действие металла направленно именно на бактерии. Но, этого достаточно, чтобы при неправильном обращении нанести урон здоровью.
Серебро, или его соединения?
Всасываемость самого металла, и его соединений разнится. К примеру, реагирует серебро с водой весьма инертно. Но, нитрат серебра вода, как и другие соли металла принимает охотно. Всасываемость солей на основе драгоценного элемента в разы выше. Такие соединения проникают и в кишечник, и в кровь, во все структуры организма. Поэтому, не всякое серебро хорошо для напитков, пищи, косметики, даже в малых дозах.
Драгоценный металл выводится организмом. За «депортацию» излишков отвечает печень. При однократных превышениях норматива, ничего страшного не происходит. Но, если постоянно употреблять элемента больше, чем надо, развивается аргироз. Так медики называют хроническое отравление печени серебром. При этом недуге кожа и слизистые человека приобретают зеленовато-серый оттенок.
Очистка воды серебром
Очистка воды серебром происходит, в основном за счет фильтров. В них встроены серебряные пластины, обогащающие напиток ионами металла. Этот метод современен, и безопасен. Вариант аналогичен применению серебряной посуды, но, нет необходимости покупать цельные драгоценные сервизы.
Ионизатор для воды из серебра часто выполняется в виде специального украшения, которое опускается в емкость, крепясь, к примеру, за ее край. Недорогие образцы стоят от 600-от рублей. Стандартная стоимость – 1000-1500.
Вещицу часто заводят в домах, где есть маленькие дети и в регионах, где качество воды оставляет желать лучшего. Так, в 2013-ом новостные ленты пестрили сообщениями о синегнойной палочке, найденной в водопроводных сетях Улан-Удэ. Многие жители Бурятии тогда запаслись ионизаторами. Как говорится, береженого Бог бережет.
Изредка в продажу поступают не ионизаторы, а чистый порошок серебра. От его приобретения специалисты отговаривают. Здесь, как раз, сложно соблюсти норму при добавлении металла в воду. За счет количества частиц, увеличивается общая поверхность металла, «испаряющая» ионы. Точные расчеты произвести почти невозможно.
Серебро для воды купить – не единственный выход. В аптеках продают уже готовую серебряную воду. В ней соблюдены все нормы. Хоть металл и тяжелый, и имеет 2-ой класс опасности, он все же, нужен организму. В микроскопических долях вещество содержится в тканях.
Доказано, что элемент нужен мозгу, железам внутренней секреции, при строении костей. Врачи советуют в день выпивать около 200-от миллилитров состава серебро и вода. Реакция организма на вещество в этом случае, говорят, будет сугубо положительной. Тем не менее, помня о пропаганде радия в начале прошлого века, не стоит чересчур увлекаться модным напитком. Все хорошо, как говориться, в меру.
Видео:Реакции металлов с кислородом и водой. 8 класс.Скачать

Химические свойства серебра
В твердом серебре растворимость кислорода мала, поэтому при затвердевании расплавленного серебра происходит выделение растворенного в нем кислорода, сопровождающееся иногда разбрызгиванием металла.
С водородом, азотом и углеродом серебро непосредственно не взаимодействует. Фосфор действует на серебро лишь при температуре красного каления с образованием фосфидов.
При нагревании с серой серебро легко образует сульфид Ag2S. Это же соединение получается при действии на серебро газообразной серы, выделяющейся при термической диссоциации некоторых сульфидов (пирита, пирротина, халькопирита), и при нагреве металла в контакте с этими сульфидами. При воздействии сероводорода поверхность серебра покрывается черной пленкой Ag2S. Процесс медленно идет уже в обычных условиях и является причиной постепенного потемнения серебянных изделий.
Серебро взаимодействует также со свободными хлором, бромом и иодом с образованием соответствующих галогенидов. Эти процессы медленно протекают, даже при обычных температурах и ускоряются в присутствии влаги, при нагревании и под действием света.
Электродный потенциал серебра в водных растворах высок :
Ag → Ag⁺ + е, φ0 = + 0,799В
Поэтому, как и золото, серебро не вытесняет водород из водных растворов кислот, устойчиво по отношению к щелочам. Однако в отличие от золота оно растворяется в кислотах, являющихся достаточно сильными окислителями, например, в азотной и концентрированной серной. Подобно золоту, серебро легко взаимодействует с царской водкой и насыщенной хлором соляной кислотой, но при этом оно остается в нерастворимом остатке вследствие образования малорастворимого хлорида AgCl.
Такие различия в поведении золота и серебра часто используют для разделения этих металлов. Тонкодисперсное серебро в контакте с кислородом воздуха растворяется в разбавленной серной кислоте. Подобно золоту, серебро растворяется также в насыщенных воздухом водных растворах цианидов щелочных и щелочноземельных металлов, в водном растворе тиомочевины в присутствии солей железа (III).
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Соединения серебра
В подавляющем большинстве своих соединений серебро имеет степень окисления (+1). Соединения с более высокой степенью окисления серебра (+2 и +3) сравнительно малочисленны и практического значения не имеют.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Оксид серебра Ag2О
Черно-коричневого цвета может быть получен введением щелочи в раствор, содержащий ионы Ag⁺. Вначале, по-видимому, образуется гидроксид, тотчас переходящий в оксид:
2AgOH = Ag2O + Н2О.
Хотя оксид серебра — малорастворимое в воде соединение, его водная суспензия имеет четко выраженную основную реакцию, поэтому соли серебра в водных растворах не гидролизуются и дают нейтральную реакцию. При нагревании до 185—190°С Ag2О разлагается на элементы. Перекись водорода легко восстанавливается Ag2О уже при комнатной температуре:
В водном растворе аммиака Ag2О растворяется с образованием комплексного соединения:
При стоянии из раствора осаждается чрезвычайно взрывчатый даже во влажном состоянии осадок нитрида серебра Ag3N (гремучее серебро).
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Галогениды серебра
Малорастворимые соединения. Исключение составляет лишь легкорастворимый фторид AgF. Хлорид AgCl, бромид AgBr и иодид AgI выпадают в осадок при введении в раствор, содержащий ионы Ag⁺ (например, раствор AgNO3), ионов Сl⁻, Вr⁻ и I⁻. Их произведения растворимости составляют соответственно 1,8 • 10⁻¹º (AgCI), 5,3 • 10⁻¹³ (AgBr) и 8,3 •10⁻¹⁷ (AgI).
В гидрометаллургии и аффинаже благородных металлов широко используют прием осаждения серебра в виде хлорида, осуществляемый введением в серебросодержащие растворы NaCl или НСl. Хлорид серебра плавится при 455°С. Температура кипения AgCl 1550°С, но заметное улетучивание наблюдается уже при температуре выше 1000 °с.
Ионы серебра образуют прочные комплексы с целым рядом ионов и молекул (CN⁻, S2O²3⁻, SO²3⁻ Cl⁻, NH3, CS(NH2)2 и т.д.). Благодаря этому практически нерастворимый в воде AgCl легко растворяется в водных растворах цианистого калия, тиосульфата и сульфита натрия, аммиака, например:
AgCl + 2CN⁻ = Ag (CN)F + Сl⁻;
AgCl + 2S2C²3⁻ = Ag (S2O2)³2⁻ + Сl⁻;
AgCl + 2NH4OH = Ag(NH3)2+ + Сl⁻ + 2H2O.
Вследствие образования комплексов с ионами Сl³⁻ хлорид серебра заметно растворим также в концентрированных соляной кислоте и растворах других хлоридов:
AgCl + Сl⁻ = AgCl⁻ 2.
Например, в концентрированном растворе NaCl растворимость хлорида серебра составляет 6,7•10³⁻моль/л (0,72 г/л Ag) против 1,3•10⁻⁵ в воде. Концентрированные растворы NaCl использовали ранее для выщелачивания серебра из огарков хлорирующего обжига.
Таким образом при введении хлор-ионов в серебросодержащие растворы концентрация серебра вначале падает (образование AgCl), а затем начинает возрастать (в ре-зультате комплексообразования). Поэтому для достижения полноты осаждения серебра следует избегать большого избытка ионов хлора.
Электроотрицательными металлами (цинком, железом) .хлорид серебра, взятый в виде суспензии в разбавленной серной кислоте, легко восстанавливается до металла. Этот простой прием получения металлического серебра из его хлорида широко применяют в аффинажном производстве.
Бромид серебра AgBr похож по своим свойствам на AgCl. Он растворим в аммиачных, тиосульфатных, сульфитных и цианистых растворах, легко восстанавливается до металла.
Видео:Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Иодид AgI
Наименее растворимый из галогенидов серебра, поэтому в отличие от AgCl и AgBr он не растворим в аммиачных растворах, но растворим в присутствии ионов CN⁻ и S2O²3⁻ , с которыми серебро образует более прочные, нежели с аммиаком, комплексы. Заметной растворимостью AgI обладает также в концентрированных растворах иодидов щелочных металлов, что объясняется образованием комплексных ионов AgI⁻2.
Весьма характерной и важной особенностью труднорастворимых галогенидов серебра является их светочувст-вительность, заключающаяся в том, что под действием света они разлагаются на металлическое серебро и свободный галоид:
Это свойство галоидных солей серебра лежит в основе их применения для производства фотоматериалов — светочувствительных пленок, пластинок и бумаги. Светочувствительность галидов серебра возрастает в ряду AgI
К галогенидам серебра очень близок по своим свойствам цианид AgCN. Он выпадает в виде белого осадка при добавлении к раствору, содержащему ионы Ag⁺, раствора цианида щелочного металла (без избытка). Подобно галогенидам серебра, AgCN практически нерастворим в воде (произведение растворимости 2.3•10⁻¹⁶) и разбавленных кислотах, но растворим в аммиачных, тиосульфатных и цианистых растворах, вследствие образования соответствующих комплексных соединений. В отличие от галогенидов цианид серебра под действием света не разлагается.
Видео:8 класс. Составление уравнений химических реакций.Скачать

Нитрат серебра
Из других соединений серебра большое практическое значение имеют нитрат и сульфат серебра.
Нитрат серебра AgNО3 получают действием азотной кислоты на металлическое серебро:
3Ag + 4HNO3 = 3AgNО3 + NO + 2H2О.
Нитрат серебpa представляет собой бесцветные негигроскопичные кристаллы, плавящиеся при 208,5 °С ; при температуре выше 350 °С термически разлагается. AgNО3 очень легко растворяется в воде. При 20 °С его растворимость составляет 222 г на 100 г воды, при 100 °С она возрастает до 952 г на 100 г.
В присутствии органических веществ нитрат серебра чернеет вследствие частичного восстановления до металла.
Нитрат серебра — технически наиболее важное соединение этого металла. Эта соль служит исходным продуктом для приготовления остальных соединений серебра. Водный раствор AgNO3 используют в качестве электролита при электролитическом рафинировании серебра.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Сульфат серебра Ag2SO4
Может быть получен растворением металлического серебра в горячей концентрированной серной кислоте:
2Ag + 2H2SO4 = Ag2SO4 + SO2 + 2Н2O.
Сульфат серебра образует бесцветные кристаллы, плавящиеся при 660°С. При температуре выше 1000°С термически разлагается. Растворимость Ag2SO4 в воде невелика, при 25°С она составляет 0,80 г на 100 г воды. В концентрированной серной кислоте растворимость значительно выше вследствие образования более растворимого бисульфата AgHSO4.
Сульфид серебра Ag2S — наиболее трудно растворимая соль этого металла (произведение растворимости 6.3• 10⁻⁵º). Он выпадает в виде черного осадка при пропускании сероводорода через растворы солей серебра. Образование Ag2S происходит также при действии H2S на металлическое серебро в присутствии влаги и кислорода воздуха;
4Ag + 2H2S + O2 = 2Ag2S + 2Н2O
Как было отмечено, этот процесс является причиной потемнения серебряных изделий при длительном хранении. Сульфид серебра можно получить также непосредственно из элементов, нагревая металлическое серебро с элементарной серой.
В цианистых растворах Ag2S растворяется в результате образования комплексного соединения:
Ag2S + 4CN⁻ ⇄ 2Ag(CN)⁻2 + S²⁻
Эта реакция обратима, протеканию ее слева направо способствует повышение концентрации иновов CN⁻ и удаление ионов S²⁻ окислением их кислородом продуваемого воздуха.
С разбавленными минеральными кислотами Ag2S не взаимодействует. Концентрированная серная и азотная кислота окисляют сульфид серебра до сульфата. При нагревании в атмосфере воздуха Ag2S разлагается с образованием металлического серебра и диоксида серы:
Ag2S + О2 = 2Ag + SО2
Из ранее упоминавшихся комплексных соединений серебра наибольший интерес для гидрометаллургии этого металла представляют хорошо растворимые комплексные цианистые соединения калия, натрия и кальция. Подобно аналогичным соединениям золота, комплексные цианиды серебра образуются при растворении металлического серебра в растворе соответствующего цианида при доступе кислорода воздуха:
4Ag + 8CN⁻ + О2 + 2Н2О = 4Ag(CN)7 + 4ОН⁻
Эта реакция, как и аналогичная реакция с золотом, лежит в основе процесса цианирования.
Как и золото, серебро растворяется в водных растворах тиомочевины в присутствии солей Fe(III),образуя комплексные катионы Ag[CS(NH2)2]⁺2
Статья на тему химические свойства серебра
Похожие страницы:
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
🔥 Видео
Монооксид Серебра - Ag2O2. Реакция Оксида Серебра, Перманганата Калия и Гидроксида Натрия.Скачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Проклятая химическая реакция 😜 #shortsСкачать

Типы химических реакций. 1 часть. 8 класс.Скачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Реакции замещенияСкачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Химическая реакция йода и алюминия.Скачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

формула водыСкачать


