| Щавелевая кислота | |
|---|---|
 | |
 | |
| Систематическое наименование | Этандиовая кислота |
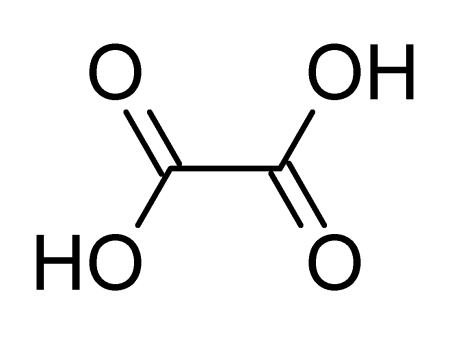
| Хим. формула | HOOC-COOH |
| Состояние | Кристаллическое |
| Молярная масса | 90,04 г/моль |
| Плотность | 1,36 г/см³ |
| Т. плав. | |
| Т. кип. | 100,7 градус Цельсия |
| Т. разл. | |
| Т. всп. | 166 °C |
| Мол. теплоёмк. | 108,8 Дж/(моль·К) |
| Энтальпия образования | −817,38 кДж/моль |
| Энтальпия сгорания | −251,8 кДж/моль |
| Энтальпия растворения | −9,58 кДж/моль |
| Энтальпия сублимации | 90,58 кДж/моль |
| Давление пара | 0,001 ± 0,001 мм рт.ст. |
| pKa | 1,25; 4,14 |
| Растворимость в воде | 10 г/100г (20 °C); 25 г/100г (44,5 °C); 120 г/100г (100 °C) |
| Кристаллическая структура | Моноклинная |
| Дипольный момент | 0,1⋅10 −30 Кл·м |
| ГОСТ | ГОСТ 22180-76 |
| Рег. номер CAS | 144-62-7 |
| PubChem | 971 |
| Рег. номер EINECS | 205-634-3 |
| SMILES | |
| RTECS | RO2450000 |
| ChEBI | 16995 и 44583 |
| Номер ООН | 3261 |
| ChemSpider | 946 |
| ПДК | 0,2 мг/л (в воде водоёмов хозяйств бытового пользования) |
| Токсичность | токсична |
| Сигнальное слово | Опасно |
| Пиктограммы СГС | Пиктограммы СГС:  |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
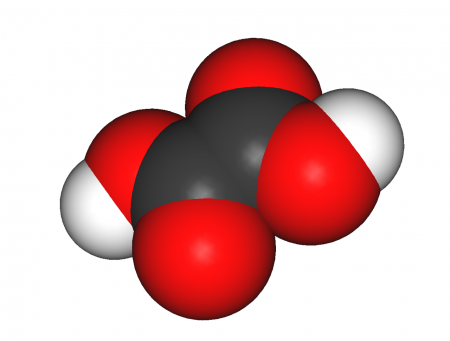
Щавелевая кислота, также этандиовая кислота — органическое соединение, двухосновная предельная карбоновая кислота, с формулой HOOC-COOH, простейшая двухосновная кислота, первый член гомологического ряда двухосновных предельных карбоновых кислот. Принадлежит к сильным органическим кислотам. Обладает всеми химическими свойствами, характерными для карбоновых кислот. Соли и сложные эфиры щавелевой кислоты называются оксалатами. В природе содержится в щавеле, ревене, карамболе и некоторых других растениях в свободном виде и в виде оксалатов калия и кальция. Впервые щавелевая кислота синтезирована в 1824 году немецким химиком Фридрихом Вёлером из дициана.
- Содержание
- Получение
- Свойства
- Применение
- Опасность
- Acetyl
- Применение щавелевой кислоты и свойства: химическая формула
- Что такое щавелевая кислота?
- Применение щавелевой кислоты
- Органическая и неорганическая щавелевая кислота
- Щавелевая кислота (этандиовая кислота)
- Щавелевая кислота это простейшая двухосновная карболовая кислота
- 🎦 Видео
Видео:ЩАВЕЛЕВАЯ КИСЛОТАСкачать

Содержание
- 1 Получение
- 2 Свойства
- 3 Применение
- 4 Опасность
Видео:Щавелевая Кислота - КАЧЕСТВЕННАЯ РЕАКЦИЯСкачать

Получение
В промышленности щавелевую кислоту получают окислением углеводов, спиртов и гликолей смесью HNO3 и H2SO4 в присутствии V2O5, либо окислением этилена и ацетилена HNO3 в присутствии PdCl2 или Pd(NO3)2, а также окислением пропилена жидким NO2. Перспективен способ получения щавелевой кислоты из CO через формиат натрия:
NaOH + CO → HCOONa →−H2 NaOOC-COONa → H+ HOOC-COOH
Видео:Реакция Гидрокарбоната Натрия и Щавелевой Кислоты. Реакция NaHCO3 и H2C2O4Скачать

Свойства
- Энтальпия сгорания (ΔH 0сгор) −251,8 кДж/моль
- Температура декарбоксилирования 166—180 °C
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Применение
В лабораториях щавелевую кислоту иногда применяют для получения хлороводорода и йодоводорода:
Также щавелевая кислота используется для лабораторного синтеза диоксида хлора:
Щавелевая кислота и оксалаты находят применение в текстильной и кожевенной промышленности как протрава. Они служат компонентами анодных ванн для осаждения металлических покрытий — алюминия, титана и олова. Щавелевая кислота и оксалаты являются реагентами, используемыми в аналитической и органической химии. Они входят в составы для удаления ржавчины и оксидных плёнок на металле; применяются для осаждения редкоземельных элементов.
Производные щавелевой кислоты — диалкилоксалаты, главным образом диэтилоксалат и дибутилоксалат — применяются как растворители целлюлозы. Ряд сложных эфиров щавелевой кислоты и замещённых фенолов используются как хемилюминесцентные реагенты.
Щавелевая кислота является хорошим стимулятором работы мышц и нервов.
Видео:Реакции металлов с кислородом и водой. 8 класс.Скачать

Опасность
Щавелевая кислота и её соли токсичны. Некоторые соли щавелевой кислоты, — оксалаты, в частности, оксалат кальция и оксалат магния очень плохо растворимы в воде и оседают в почечных лоханках в виде конкрементов различного размера (песок, камни), иногда причудливой формы (коралловые камни).
ПДК в воде водоёмов хозяйств бытового пользования — 0,2 мг/л.
Видео:Щавелевая кислотаСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать  Применение щавелевой кислоты и свойства: химическая формулаСегодня речь пойдет том, что такое щавелевая кислота: применение в быту, свойства, меры предосторожности при работе с ней. Или вы думаете, что вам это не нужно, потому что вы с ней нигде не сталкиваетесь? Видео:Проклятая химическая реакция 😜 #shortsСкачать  Что такое щавелевая кислота?Это органическая кислота, которая в природе встречается в некоторых растениях. Больше всего ее в щавеле, шпинате и ревене. Именно она придает им кислый вкус. Как ни странно, много ее в шоколаде, свекле и крепком черном чае. Соли щавелевой кислоты называются оксалатами. Думаю, это слово вы часто слышали, особенно те, у кого проблемы с отложением солей в суставах или с камнями в почках – это именно нерастворимые оксалаты кальция. Именно поэтому при лечении врачи рекомендуют снизить употребление продуктов, в которых много щавелевой кислоты. Природные соединения щавелевой кислоты – это, чаще всего, оксалаты калия. Интересно, но щавелевая кислота сыграла значительную роль в развитии органической химии как науки. Дело в том, что в начале 19-го века ученые четко разделяли все вещества на так называемые минеральные и органические. Причем, первые могли существовать только в живых организмах, а вторые – соответственно, в неживых предметах. И вот в 1824 году немецкий химик Фридрих Вёлер разрушил эти представления тем, что получил органическое вещество (щавелевую кислоту) из неорганических веществ. Ну а после этого подобные открытия пошли одно за другим. В итоге, ученые пришли к тому, что пропасти между неорганическими и органическими веществами не существует, для всех них действуют одни и те же законы. Вот такое интересное вещество – эта щавелевая кислота или «щавелька», как называют ее химики в лабораториях, часто используя ее для приготовления смесей для мытья химической посуды. Видео:Опыт с Щавелевой кислотойСкачать  Применение щавелевой кислотыЧто и говорить, оно огромно:
Ну а в быту основное ее применение — входит в состав моющих средств как отбеливающее и дезинфицирующее вещество. Самое распространенное применение – очистка от ржавчины. Причем, это свойство щавелевой кислоты легко расправляться с ржавчиной действительно и для сантехники, и для металлических деталей, и даже для пятен ржавчины на одежде. Когда-то один мой коллега повесил свой белый свитер сушиться на батарею и не обратил внимание, что на ней есть потеки ржавчины. В итоге на свитере остались ржавые пятна. Я тогда работала в лаборатории, мы дали ему немного щавелевой кислоты, с помощью которой он и спас свою одежду. Сейчас чистую щавелевую кислоту найти и купить проблематично, по крайней мере, у нас, в Казахстане, но ее легко можно найти в составе самых разных порошков для чистки труб, моющих средств, а также «Антинакипина». Кстати, пока писала, мне подсказали, что ее можно найти в магазинах для пчеловодов и в ветеринарных магазинах. Ну а как пользоваться? Легко. Чайную ложку растворяем с литре теплой воды – вот и готов раствор против ржавчины. Только не забывайте про меры предосторожности! Это вещество относится ко второму классу опасности – раздражает верхние дыхательные пути, обладает ярко выраженным раздражающим действием для кожи и слизистых оболочек. Причем, это касается не только самой кислоты, но и ее солей. Кроме того, пыль ее пожароопасна. Видео:Реакция ДИХРОМАТА АММОНИЯ, ЩАВЕЛЕВОЙ КИСЛОТЫ и КОНЦЕНТРИРОВАННОЙ СЕРНОЙ КИСЛОТЫ. Опыты по химии.Скачать  Органическая и неорганическая щавелевая кислотаА теперь – то, что вызвало мое огромное недоумение, а потом – возмущение. Когда искала материал к это статье, то перерыла много справочной и специальной литературы как в бумажном, так и электроном виде, и также попыталась искать информацию в интернете. Я говорю «попыталась», потому что практически в каждой второй статье мне попадался такой ужас… Я даже не знаю, какими словами это описать. Судите сами, вот скриншот части статьи на одном из таких сайтов: А как вам такое: Как может органическая щавелевая кислота вдруг превратиться в неорганическую?! Ну что за бред-то! Вещество – всегда одно, если с ним происходят какие-то химические превращения, то оно превращается в другое вещество, которое будет называться по-другому, иметь другое строение и другие свойства. Но такого, чтобы вещество вдруг претерпело какие-то химические превращения и осталось самим собой – не бывает такого! А органический кальций – это синоним белой сажи! Не бывает органического кальция. Особенно порадовало «разрушение кальция», которое происходит при обработке пищи. А она, случайно, не в атомном реакторе обрабатывается? Ведь только ядерные реакции способны разрушить какой-либо химический элемент. Короче, если вы видите подобный сайт – бегите от него со всех ног. Их авторы безграмотны и глупы. Безграмотны – потому что не знают элементарного школьного курса химии, а глупы – потому что переписывают друг у друга подобную чушь, даже не задумываясь над тем, что они пишут. И никакой викиум им уже не поможет. Это как в статье про воду с «живой активной средой», про которую я уже писала. Соответственно, очень большой вопрос – можно ли доверять советам с таких сайтов. Если хотите – попробуйте, рискните своим здоровьем. А я не буду. Видео:Синтез щавелевой кислотыСкачать  Щавелевая кислота (этандиовая кислота)Щавелевая кислота — представляет собой бесцветные моноклинные гигроскопичные кристаллы, легко растворимые в воде, ограниченно — в этиловом спирте и диэтиловом эфире, нерастворимые в хлороформе, петролейном эфире и бензоле. Щавелевая кислота это двухосновная предельная карбоновая кислота. Принадлежит к сильным органическим кислотам. Обладает всеми химическими свойствами, характерными для карбоновых кислот. Соли и эфиры щавелевой кислоты называются оксалатами. Щавелевая кислота образует кислые и средние эфиры, амиды, хлорангидрид. В природе содержится в щавеле, ревене и некоторых других растениях в свободном виде и в виде оксалатов калия и кальция. Плотность 1,36 г/см³. Температура плавления — 189,5° C, температура возгонки — 125° C, температура разложения — 100-130° C, температура декарбоксилирования — 166-180° C. Химическая формула: С2Н2O4
— в химической промышленности (органический синтез, при производстве пластмасс, чернил, в синтезе красителей, как компонент пиротехнических составов); Физико-химические характеристики щавелевой кислоты Наименование показателяНормаВнешний видБесцветные кристаллыМассовая доля щавелевой кислоты, %, не менее99,2Массовая доля золы в виде сульфатов, %, не более0,05Массовая доля не растворимых в воде веществ, %, не более0,012Массовая доля железа (Fe2+), %, не более0,005Массовая доля тяжелых металлов, %, не более0,002 Щавелевая кислота — горючее вещество, в осевшем состоянии пыль щавелевой кислоты пожароопасна, по степени воздействия на организм относится к веществам 2-го класса опасности. Щавелевая кислота и ее соли токсичны. При работе с щавелевой кислотой следует применять СИЗ. Упаковка, транспортировка и хранение. Так же может упаковываться в фанерные барабаны с пленочным мешком-вкладышем или мягкие специализированные контейнеры разового использования. Видео:Реакция Дихромата Аммония И Щавелевой Кислоты. Реакция (NH4)2Cr2O7 и H2C2O4Скачать  Щавелевая кислота это простейшая двухосновная карболовая кислота
При работе с щавелевой кислотой следует применять СИЗ. Щавелевая кислота относительно сильная кислота. Образует гидрат состава C2H2O4.2H2O, кислые и средние соли (оксалаты), эфиры, амиды и другие производные. Щавелевая кислота образуется при щавелевокислом брожении. Плохо растворяется в воде, хорошо — в спирте, эфире. Содержится в некоторых растениях, в том числе в щавеле в виде калиевой соли. Может вызывать раздражение кожи. В косметике применяется как активная добавка в отбеливающих кремах от веснушек. Щавелевая кислота техническая получается окислением этиленгликоля смесью азотной и серной кислот в присутствии катализатора пятиокиси ванадия предназначается для использования в химической, медицинской промышленностях, в химической металлургии и в аналитической химии. Техническая щавелевая кислота — горючее вещество, в осевшем состоянии пожароопасна. По степени воздействия на организм относится к веществам 3-го класса опасности. Щавелевая кислота техническая упаковывается:
🎦 Видео8 класс. Кислоты. Химические свойства разбавленных кислот.Скачать  Реакция НИТРАТА СЕРЕБРА и ЩАВЕЛЕВОЙ КИСЛОТЫ.Reaction of SILVER NITRATE and OXALIC ACID.Опыты химияСкачать  Реакция щавелевой кислоты и перманганата калияСкачать  Окисление щавелевой кислотыСкачать  ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать  Как запомнить название соли щавелевой кислоты #школьнаяхимия #репетиторпохимии #химияскатей #егэСкачать  Галилео. Эксперимент. Растворяем алюминийСкачать  Щавелевая кислота. Как её использовать и зачем.Скачать  |







 Применение щавелевой кислоты.
Применение щавелевой кислоты.