Данную реакцию используют в аналитической химии и в фармацевтическом анализе для определения ионов Са +2 .
В количественном анализе используют восстановительные свойства щавелевой кислоты:
Мп +7 +5е —> Мп +2 2 окислитель
КАЧЕСТВЕННЫЕ РЕАКЦИИ ГЕТЕРОФУНКЦИОНАЛЬНЫХ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Качественную реакцию на винную (виннокаменную) кислоту проводят при строгом соблюдении нейтральной среды с КС1 (для инактивации, выделившейся в результате реакции НС1, добавляют СН3-СООNa ), с добавлением С2Н5ОН.
Растворимость КНС2Н4О6 — белого кристаллического осадка возрастает с повышением температуры, поэтому реакцию надо вести при охлаждении. Кроме того, этот осадок образует пересыщенный раствор; для ускорения образования кристаллов требуется механическое воздействие (трение, взбалтывание). Данную реакцию используют в аналитической химии и в фармацевтическом анализе для определения ионов К + .
Винная кислота в своем составе имеет диольный фрагмент – СН (ОН)-СН(ОН)-, наличие гидроксильных групп в винной кислоте доказывают со свежеприготовленным Си(ОН)2.
НООС – СН – СН – СООН НООС – СН – СН — СООН
комплексное соединение винной кислоты
и меди (11), раствор синего цвета
Лимонную кислоту определяют при нагревании с солями Са +2 , в результате реакции образуется белый осадок цитрат кальция.
2НО — С – СООН + 3 СаС12 ———————> цитрат кальция + 6 НС1
Цитрат натрия применяется для консервации донорской крови. Противосвертывающее действие основано на том, что цитрат натрия связывает участвующие в процессе свертывания ионы кальция в нерастворимый цитрат кальция.
Фенолокислоты в своем составе имеют фенольную гидроксильную группу, поэтому качественную реакцию на салициловую кислоту и другие фенолокислоты, проводят с раствором хлорида железа (III), появляется комплекс фиолетового цвета.
Салициловая кислота + FeC13 ——> комплекс фиолетового цвета
Салициловая кислота – это ароматическое соединение, можно предложить реакцию с бромной водой, в результате чего выпадает белый осадок 2,4,6 –трибромфенол.
Салициловая кислота + 3 Вг2 ——> 2,4,6-трибромфенол + СО2 + 3 НВг
Общей качественной реакцией для обнаружения à-аминокислот служит реакция с нингидрином. Конечным продуктом сложных превращений является вещество сине-фиолетового цвета. Реакция основана на окислительном дезаминированиии одновременном декарбоксилировании a — аминокислот. Эта очень чувствительная реакция используется для обнаружения a — аминокислот на хроматограммах и в спектрофотометрическом анализе при количественном определении a — аминокислот.
HOOC – (CH2)2 – CH (NH2) – COOH + раствор нингидрина ——-> фиолетовое окрашивание
a – Аминокислоты способны образовывать комплексные соединения за счет – СООН и –NН2. Это свойство используют для качественного анализа глютаминовой кислоты.
2 НООС – СН2 – СН2 – СН – СООН

Углеводы широко распространены в природе и играют очень большую роль жизнедеятельности человека. Из углеводов мы рассмотрим качественные реакции на глюкозу, фруктозу и крахмал.
Глюкоза по своему строению относится к альдегидоспиртам, что и используют при качественном анализе.
Благодаря наличию альдегидной группы в составе, проводят окислительные реакции, используя восстановительные свойства глюкозы. Для проведения реакций можно применить:
1) реактив Толленса
Глюкоза + 2Аg(NH3)2OH ——> Аg + продукты окисления
C +1 — 2e —-> C +3 1 восстановитель
Ag + + 1e —-> Ag 2 окислитель
на стенках пробирки серебристый налет.
2) Реактив Фелинга
Глюкоза + 2NаООС – СН – СН – СООК ——> Си2О + 2NаООС –СН(ОН)-СН(ОН) -СООН
С +1 – 2е —-> С +3 1 восстановитель
Си +2 + 1е—> Си +1 2 окислитель
выпадает кирпично – красный осадок.
3) свежеприготовленный Си(ОН)2.
Глюкоза + 2Си(ОН)2 —-> Си2О + продукты окисления.
С +1 – 2е —> С +3 1 восстановитель
Си +2 +1е —> Си +1 2 окислитель
Выпадает кирпично –красный осадок.
В составе глюкозы наблюдается диольный фрагмент – СН (ОН) –СН(ОН)-, наличие гидроксильных групп доказывают при помощи Си(ОН)2.
С – СН – СН – СН – СН — СН2ОН +Си(ОН)2 ——> С- СН –СН –СН –СН –СН2ОН
Н ОН ОН ОН Н ОН О О
+ 2Н2О, комплекс глюкозы и меди (11)
раствор синего цвета
В медицине чистую глюкозу применяют в виде растворов для введения в кровь при ряде заболеваний; глюкоза применяется при производстве различных таблеток и т.д.
Фруктоза, подобно глюкозе, дает реакцию «серебряного зеркала» и восстанавливает Си(ОН)2, хотя и не содержит альдегидной группы. Это объясняется тем, что под действием гидроксидов щелочных металлов фруктоза превращается в глюкозу и расщепляется на ряд легко окисляющихся веществ. Характерной реакцией фруктозы, отличающей ее от других моносахаридов, является реакция Селиванова: при нагревании раствора фруктозы с крепкой хлороводородной кислотой и резорцином быстро появляется интенсивное вишнево-красное окрашивание и при больших концентрациях фруктозы – красно-бурый осадок. Сущность этой реакции сводится к образованию из фруктозы оксиметилфурфурола. Фруктоза образует сложно построенный высокомолекулярный полисахарид инулин, содержащийся в некоторых растениях.
Крахмал определяют с помощью раствора иода, реакция очень чувствительная: даже при наличии малых концентраций крахмала образуется комплекс синего цвета.
Крахмал + I2 ——> синее окрашивание.
В медицине и фармации крахмал используют при приготовлении присыпок, паст (густых мазей), а также при производстве таблеток и т.д.
КАЧЕСТВЕННЫЕ РЕАКЦИИ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ
Антипирин в своем составе содержит ядро пиразолона. С азотистой кислотой антипирин дает изумрудно – зеленое окрашивание. Эта реакция обусловлена тем, что атом водорода у четвертого атома пиразольного кольца, вообще отличающийся большой подвижностью, легко замещается нитрозогруппой, т.е. происходит нитрозирование антипирина:
Антипирин + НО-N = О —-> нитрозоантипирин + Н2О
Эту реакцию используют в аналитической химии и в фарманализе для определения нитритов.
С раствором хлорида железа (III) антипирин дает красное окрашивание, которое обусловлено образованием окрашенного в красный цвет комплексного соединения антипирина с хлоридом железа (III) – ферропирина.
Никотиновая кислота (пиридин – 3 –карбоновая кислота) является провитамином РР.
Качественную реакцию на никотиновую кислоту проводят при кипячении с раствором СиSО4, выпадает осадок интенсивно – синего цвета никотинат меди (II)
Никотиновая кислота + СиSО4 ——> никотинат меди + Н2SО4,
А если эту реакцию проводить без кипячения и при добавлении роданида аммония, то образуется раствор ярко — зеленого цвета.
Никотиновая кислота + СиSO4 + 2NH4SCN —-> тетраникотинмеди (II) роданид + (NH4)2SO4
Из пуриновых производных рассмотрим качественные реакции на теобромин, теофиллин, кофеин. Общей качественной реакцией для обнаружения ксантинов является мурексидная проба. Эта реакция достаточно сложна, она основана на окислении ксантинов азотной кислотой. Продукт окисления при взаимодействии с аммиаком образует аммониевую соль пурпуровой кислоты, называемую мурескидом, пурпурно – красного цвета.
Реакции солеобразования используются в качественном анализе метилированных ксантинов. Теофиллин и теобромин в щелочной среде образуют с хлоридом кобальта (II) нерастворимые соли соответственно белый осадок с розовым оттенком и серо – голубой осадок.
Теофиллин + NаОН ——-> теофиллинат натрия ————> теофиллинат кобальта
Теобромин + NаОН ——> теоброминат натрия ———-> теброминат кобальта
Кофеин , у которого метилированы все атомы азота, кислотных свойств не проявляет и не вступает во взаимодействие с хлоридом кобальта (II). Благодаря своим основным свойствам кофеин образует с танином — природным веществом кислотного характера – нерастворимую соль белого цвета таннат кофеина.
Видео:щавелевая кислота и хлорид кальцияСкачать

Реакция взаимодействия CaCl2, H2SO4
Одним из камней преткновения на первых шагах изучения химических закономерностей и основ является написание химических реакций. Поэтому вопросы о взаимодействии CaCl2, H2SO4 встречаются даже не периодически, а систематически. Разберем основные «проблемные» моменты.
Видео:Уроки химии с БСК. Урок №2. Хлорид кальцияСкачать

Запись молекулярного уравнения
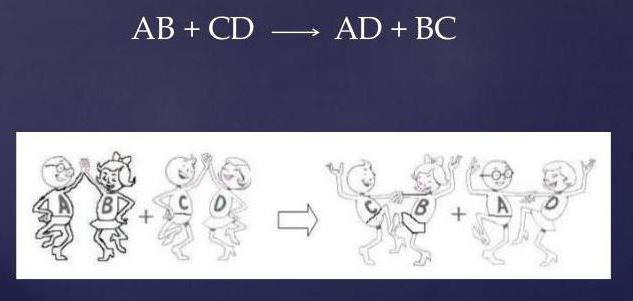
Взаимодействие между хлоридом кальция (соль) и серной кислотой протекает по обменному механизму.
- два соединения на входе (исходные вещества);
- два соединения на выходе (продукты);
- полное отсутствие простых веществ.
Обмениваясь друг с другом реакционными группами, реагенты видоизменяются, а уравнение принимает вид:
CaCl2 + H2SO4 = CaSO4 + 2HCl.
Как видно, два сложных вещества, меняясь ионами, образуют совершенно иные соединения: новую соль (CaSO4) и соляную кислоту (HCl).
Видео:ЩАВЕЛЕВАЯ КИСЛОТАСкачать

Возможность протекания до конца
Ответить на сей вопрос можно запросто, записав для CaCl2, H2SO4 уравнение реакции в молекулярном виде. От вида продуктов и будет всё зависеть. До конца процесс идет в случае образования:
- труднорастворимого вещества (осадка);
- летучего соединения (газа);
- малодиссоциирущего реагента (воды, слабого электролита).
В рассматриваемом для CaCl2, H2SO4 случае среди продуктов реакции имеется сульфат кальция – малорастворимое соединение, выпадающее в осадок, согласно таблице.
Следовательно, обменный процесс пройдет до конца.
Видео:8 класс химические свойства оксидов, оснований, кислот, солей и ионные уравненияСкачать

Сокращенная ионная форма записи между CaCl2, H2SO4
Расписав все растворимые соединения на ионы и сократив повторяющиеся реакционные группы, получим два искомых уравнения:
- полная ионная форма записи между CaCl2, H2SO4
ca 2+ + 2cl — + 2h + + so4 2- = caso4 + 2h + + 2cl —
- сокращенный вид уравнения
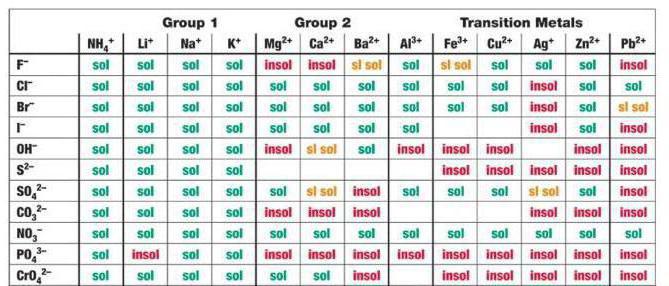
Следует помнить, что на ионы расписываются только растворимые соли, кислоты, основания (это легко определяется по специальным таблицам). Слабые электролиты типа угольной или уксусной кислоты всегда пишутся в молекулярной форме.
Теперь вы знаете, как происходит взаимодействие между хлоридом кальция (соль) и серной кислотой.
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Хлорид кальция: способы получения и химические свойства
Хлорид кальция CaCl2 — соль щелочноземельного металла кальция и хлороводородной кислоты. Белый, плавится без разложения. Хорошо растворяется в воде (гидролиза нет).
Относительная молекулярная масса Mr = 110,98; относительная плотность для тв. и ж. состояния d = 2,51; tпл = 782º C; tкип = 1960º C;
Видео:Исчезновение (растворение) осадка, выделение газа. | Лабораторный опыт № 1. Опыт 2.Скачать

Способ получения
1. Хлорид кальция можно получить путем взаимодействия кальция и хлора :
2. В результате взаимодействия карбоната кальция и соляной кислоты образуется хлорид кальция, углекислый газ и вода:
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Качественная реакция
Качественная реакция на хлорид кальция — взаимодействие его с нитратом серебра, в результате реакции происходит образование белого творожного осадка:
1. При взаимодействии с нитратом серебра , хлорид кальция образует нитрат кальция и осадок хлорид серебра:
Видео:8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

Химические свойства
1. Хлорид кальция реагирует с простыми веществами:
1.1. В результате реакции между хлоридом кальция и водородом при 600 — 700º С и катализаторах Pt, Fe, Ni образуется гидрид кальция и соляная кислота:
1.2. Хлорид кальция взаимодействует с алюминием при 600 — 700º С и образует на выходе кальций и хлорид алюминия:
3CaCl2 + 2Al = 3Ca + 2AlCl3
2. Хлорид кальция вступает в реакцию со многими сложными веществами :
2.1. Хлорид кальция вступает в реакции с основаниями :
2.1.1. Хлорид кальция взаимодействует с концентрированным раствором гидроксида натрия . При этом образуются гидроксид кальция и хлорид натрия:
CaCl2 + 2NaOH = Ca(OH)2↓ + 2NaCl
2.2. Хлорид кальция реагирует с кислотами:
2.2.1. Твердый хлорид кальция реагирует с концентрированной серной кислотой при кипении , образуя сульфат кальция и газ хлороводород :
2.3. Хлорид кальция вступает в взаимодействие с солями:
2.3.1. В результате реакции между хлоридом кальция и карбонатом натрия образуется карбонат кальция и хлорид натрия:
2.3.2. Хлорид кальция реагирует с фторидом аммония и образует фторид кальция и хлорид аммония:
2.3.3. Хлорид кальция может реагировать с сульфатом калия при 800º С с образованием сульфата кальция и хлорида калия:
📹 Видео
Степень электролитической диссоциации. Сильные и слабые электролиты. 9 класс.Скачать

Химия ОГЭ Выпуск 7 2 Свойства кислот, оснований, солей в свете ТЭД Ионные уравненияСкачать

Определите разницу числа анионов и катионов в растворе хлорида кальция, если числоСкачать

Неметаллы. Тема 11. Хлороводород. Соляная кислота. ХлоридыСкачать

10 раствор Хлористого КальцияСкачать

Профессор Кашковский про обработку щавелевой кислотой на сахарном сиропеСкачать

Получение пирофорного железа Щавелевая кислота гидроксид калия железный купорос Желтый осадок Искры!Скачать

Щавелевая кислота. Как её использовать и зачем.Скачать

Химия. Кислоты неорганические и органическиеСкачать

Химия, 9-й класс, Практическая работа № 2 Решение экспериментальных задач по теме: МеталлыСкачать

Пчелаводство ,обработка пчел от клеща, испаритель для щавеливой кислотыСкачать

Взаимодействие карбоната кальция с соляной кислотой I ЕГЭ по химииСкачать