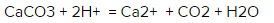Каким будет ионное уравнение реакции CaCO3 + 2HCl = CaCl2 + CO2 + H20?
Объясните как составить ионное уравнение этой реакции?
- Как составить ионное уравнение реакции CaCO3 (карбоната кальция) и 2HCl (хлорной кислоты)?
- СаСО3 + 2НСl = СаСl2 + Н2О + СО2 в ионном виде?
- Составьте равнении реакций пжлстСа = > ; СаН = > ; Са(ОН) = > ; СаСО = > ; СаСl = > ; Са(РО4)2?
- Составить уравнения реакции, в молекулярном, полном ионном виде, и сокращенном ионном виде?
- В каких случаях реакции идут практически до конца : КОН + NaCl = ?
- SnCl2 + H2SO3 + НСl =?
- Вычислите содержание чистого СаСО₃ в %, если при взаимодействии 30 г СаСО₃ с НСI было получен 11 г СО₂?
- В каких случаях реакции идут практически до конца : КОН + NaCl = ?
- 1)NH4CI + NaOH = решение + ионный вид?
- Записать в ионом виде?
- Напишите уравнения реакций , с помощью которых можно осуществить превращения :а) СаСО³ — — — — СаО — — — — Са(ОН)² — — — — СаСо³ — — — — Са(НсО³)² — — — — СаСО³ ;б) С — — — — СО² — — — — СО — — — — СО?
- Уравнения реакций, помогите пожалуйста СН2 = СН2 + НСl CН3 — СН = СН2 = НСl СН3 — СН = СН — СН3 + НСl?
- СН3СООН + СиСО3 = дописать полный ионный вид сокращенный ионный вид?
- Карбонат кальция: способы получения и химические свойства
- Способ получения
- Качественная реакция
- Химические свойства
- 🎥 Видео
Видео:Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Как составить ионное уравнение реакции CaCO3 (карбоната кальция) и 2HCl (хлорной кислоты)?
Тип реакции: кислотно-основный.
В результате реакции карбонат кальция и 2 молекул хлорной кислоты, HCl нейтрализуется с образованием слабой неустойчивой кислоты H2CO3, которая не может оставаться в таком виде, потому распадается на углекислый газ CO2 и воду H2O.
Чтобы составить ионную реакцию, нужно сделать следующее:
- Проанализировать компоненты молекулярной реакции.
- Разложить на ионы газы, жидкости и растворы, а твердые вещества не трогать.
- Убрать с обоих сторон одинаковые ионы, записать конечный вид ионной реакции CaCO3 и 2HCl.
Итак, вот молекулярное уравнение:
Теперь нужно разобрать каждую составляющую этого уравнения, чтобы составить правильное ионное уравнение:
- CaCO3 не растворяется (ведь это обычный мел);
- HCl — кислота, растворяющаяся в воде;
- CaCl2 — хлорид кальция, растворяющийся в воде.
- H20 — это вода, в ионной реакции она не участвует;
- CO2 — газ, в данной ионной реакции он не участвует.
Теперь можно разложить составляющие на ионы (раскладывается только 2HCL и CaCl2):
CaCO3 (твердый элемент) + 2Cl- + 2H+ = Ca2+ + 2Cl- + CO2 + H2O
Что мы имеем? В обеих частях уравнения есть ионы хлора, потому их можно сократить. И вот что мы получаем в итоге:
Если вы любознательны и хотите знать больше, читайте также вопросы:
Видео:Реакции ионного обмена. 9 класс.Скачать

СаСО3 + 2НСl = СаСl2 + Н2О + СО2 в ионном виде?
Химия | 5 — 9 классы
СаСО3 + 2НСl = СаСl2 + Н2О + СО2 в ионном виде.
СаСО3 + 2НСL = CaCl2 + H2O + CO2
Ca2 + + CO3 2 — + 2H + + 2Cl — = Ca 2 + + 2Cl — + H2O + CO2.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Составьте равнении реакций пжлстСа = > ; СаН = > ; Са(ОН) = > ; СаСО = > ; СаСl = > ; Са(РО4)2?
Составьте равнении реакций пжлст
Са = > ; СаН = > ; Са(ОН) = > ; СаСО = > ; СаСl = > ; Са(РО4)2.
Видео:Реакции ионного обменаСкачать

Составить уравнения реакции, в молекулярном, полном ионном виде, и сокращенном ионном виде?
Составить уравнения реакции, в молекулярном, полном ионном виде, и сокращенном ионном виде.
Видео:Реакции ионного обмена. Все типы №14Скачать

В каких случаях реакции идут практически до конца : КОН + NaCl = ?
В каких случаях реакции идут практически до конца : КОН + NaCl = .
Напишите уравнения реакции в молекулярном, ионном и сокращенном ионном видах.
Видео:Реакции ионного обмена. 9 класс.Скачать

SnCl2 + H2SO3 + НСl =?
SnCl2 + H2SO3 + НСl =.
Видео:Химия | Молекулярные и ионные уравненияСкачать

Вычислите содержание чистого СаСО₃ в %, если при взаимодействии 30 г СаСО₃ с НСI было получен 11 г СО₂?
Вычислите содержание чистого СаСО₃ в %, если при взаимодействии 30 г СаСО₃ с НСI было получен 11 г СО₂.
Видео:9 класс. Реакции ионного обмена. Ионные уравнения.Скачать

В каких случаях реакции идут практически до конца : КОН + NaCl = ?
В каких случаях реакции идут практически до конца : КОН + NaCl = .
Напишите уравнения реакции в молекулярном, ионном и сокращенном ионном видах.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

1)NH4CI + NaOH = решение + ионный вид?
1)NH4CI + NaOH = решение + ионный вид.
2)CaCO3 + H2SO4 = решение + ионный вид.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА и условия их протекания | Как составлять молекулярные и ионные уравненияСкачать

Записать в ионом виде?
Записать в ионом виде.
Видео:Реакции ионного обменаСкачать

Напишите уравнения реакций , с помощью которых можно осуществить превращения :а) СаСО³ — — — — СаО — — — — Са(ОН)² — — — — СаСо³ — — — — Са(НсО³)² — — — — СаСО³ ;б) С — — — — СО² — — — — СО — — — — СО?
Напишите уравнения реакций , с помощью которых можно осуществить превращения :
а) СаСО³ — — — — СаО — — — — Са(ОН)² — — — — СаСо³ — — — — Са(НсО³)² — — — — СаСО³ ;
б) С — — — — СО² — — — — СО — — — — СО² — — — — С
Рассмотрите процессы окисления — восстановления * цифры ² и ³ должны быть снизу ( тут по другому нельзя).
Видео:Ионные уравнения реакций. По сокращенному ионному уравнению составляем полное ионное и молекулярное.Скачать

Уравнения реакций, помогите пожалуйста СН2 = СН2 + НСl CН3 — СН = СН2 = НСl СН3 — СН = СН — СН3 + НСl?
Уравнения реакций, помогите пожалуйста СН2 = СН2 + НСl CН3 — СН = СН2 = НСl СН3 — СН = СН — СН3 + НСl.
Видео:Реакции ионного обмена (РИО) | Химия ЕГЭ, ЦТСкачать

СН3СООН + СиСО3 = дописать полный ионный вид сокращенный ионный вид?
СН3СООН + СиСО3 = дописать полный ионный вид сокращенный ионный вид.
На этой странице находится ответ на вопрос СаСО3 + 2НСl = СаСl2 + Н2О + СО2 в ионном виде?, из категории Химия, соответствующий программе для 5 — 9 классов. Чтобы посмотреть другие ответы воспользуйтесь «умным поиском»: с помощью ключевых слов подберите похожие вопросы и ответы в категории Химия. Ответ, полностью соответствующий критериям вашего поиска, можно найти с помощью простого интерфейса: нажмите кнопку вверху страницы и сформулируйте вопрос иначе. Обратите внимание на варианты ответов других пользователей, которые можно не только просмотреть, но и прокомментировать.
Видео:Химия 9 класс (Урок№6 - Реакции ионного обмена и условия их протекания.)Скачать

Карбонат кальция: способы получения и химические свойства
Карбонат кальция CaCO3 — соль кальция и угольной кислоты. Белый, при прокаливании разлагается, плавится без разложения под избыточным давлением CO2. Практически не растворяется в воде.
Относительная молекулярная масса Mr = 100,09; относительная плотность для тв. и ж. состояния d= 2,93; tпл = 1242º C при избыточном давлении.
Видео:Реакции ионного обмена, задание №30 ЕГЭ | Екатерина Дацук | ХИМИЯ ЕГЭСкачать

Способ получения
1. Карбонат кальция можно получить путем взаимодействия хлорида кальция и карбоната кальция , образуется карбонат кальция и хлорид натрия:
2. В результате взаимодействия при комнатной температуре оксида кальция и углекислого газа происходит образование карбоната кальция:
3. Гидроксид кальция вступает в взаимодействие с углекислым газом и образует карбонат кальция и воду:
Видео:Ионные уравнения реакций. Составляем полные и сокращенные ионные уравнения. Часть 1.Скачать

Качественная реакция
Качественная реакция на карбонат кальция — взаимодействие его с раствором сильных кислот. В результате реакции происходит бурное выделение углекислого газа, образование которого можно проверить, если пропустить его через известковую воду, которая мутнеет из-за образования осадка:
1. При взаимодействии с хлороводородной кислотой, карбонат кальция образует хлорид кальция, углекислый газ и воду:
Видео:75. Ионные реакции в растворах электролитовСкачать

Химические свойства
1. Карбонат кальция разлагается при температуре выше 900 — 1200º С, с образованием оксида кальция и углекислого газа:
2. Карбонат кальция вступает в реакцию со многими сложными веществами :
2.1. Карбонат кальция реагирует с оксидами :
2.1.1. Карбонат лития вступает в взаимодействие с оксидом кремния при 800º С и образует на выходе силикат кальция и углекислый газ:
2.2. Карбонат кальция реагирует с кислотами :
2.2.1. При взаимодействии с разбавленной хлороводородной кислотой карбонат кальция образует хлорид кальция, углекислый газ и воду:
2.2.2. Карбонат кальция реагирует с разбавленной плавиковой кислотой . Взаимодействие карбоната кальция с плавиковой кислотой приводит к образованию фторида кальция, воды и углекислого газа:
2.2.3. Карбонат кальция взаимодействует с сероводородной кислотой при 900º С и образует сульфид кальция, воду и углекислый газ:
3. Карбонат кальция реагирует с простыми веществами:
3.1. Карбонат кальция при 800 — 850º С вступает в реакцию с углеродом (коксом) образуя оксид кальция и угарный газ:
CaCO3 + C = CaO + 2CO
🎥 Видео
Химия. Молекулярные и ионные уравненияСкачать

Ионные уравнения | Химия 8 класс #42 | ИнфоурокСкачать

Реакции ионного обмена: от простых реакций до самых жёстких заданий на ЕГЭ! | Химия ЕГЭ | УмскулСкачать