- Основные термины и понятия
- Виды химических реакций
- Окислительно-восстановительный процесс
- Классический алгоритм
- Решение методом полуреакций
- Использование онлайн-расчёта
- Химические уравнения.
- Решение задач для подготовки к ЕГЭ по химии (11 класс)
- Краткое описание документа:
- Дистанционное обучение как современный формат преподавания
- Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Дистанционные курсы для педагогов
- Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
- Другие материалы
- Оставьте свой комментарий
- Автор материала
- Дистанционные курсы для педагогов
- Подарочные сертификаты
- 🎦 Видео
Видео:Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

Основные термины и понятия
Составление уравнений химических реакций невозможно без знания определённых обозначений, показывающих, как проходит реакция. Объединение атомов, имеющих одинаковый ядерный заряд, называют химическим элементом. Ядро атома состоит из протонов и нейтронов. Первые совпадают с числом атомного номера элемента, а значение вторых может варьироваться. Простейшими веществами называют элементы, состоящие из однотипных атомов.
Любой химический элемент описывается с помощью символов, условно обозначающих структуру веществ. Формулы являются неотъемлемой частью языка науки. Именно на их основе составляют уравнения и схемы. По своей сути они отражают количественный и качественный состав элементов. Например, запись HNO3 сообщает, что в соединении содержится одна молекула азотной кислоты, а оно само состоит из водорода, азота и кислорода. При этом в состав одного моля азотной кислоты входит по одному атому водорода и азота и 3 кислорода.
Символика элементов, условное обозначение, представляет собой химический язык. В значке содержится информация о названии, массовом числе и порядковом номере. Международное обозначение принято, согласно периодической таблице Менделеева, разработанной в начале 1870 года.
Взаимодействующие между собой вещества называются реагентами, а образующиеся в процессе реакции — продуктами. Составление и решение химических уравнений фактически сводится к определению результатов реакций, поэтому просто знать формулы веществ мало, нужно ещё уметь подбирать коэффициенты. Располагаются они перед формулой и указывают на количество молекул или атомов, принимающих участие в процессе. С правой стороны от химического вещества ставится индекс, указывающий место элемента в системе.
Записывают уравнения в виде цепочки, в которой указываются все стадии превращения вещества начиная с левой части. Вначале пишут формулы элементов в исходном состоянии, а затем последовательно их преобразование.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

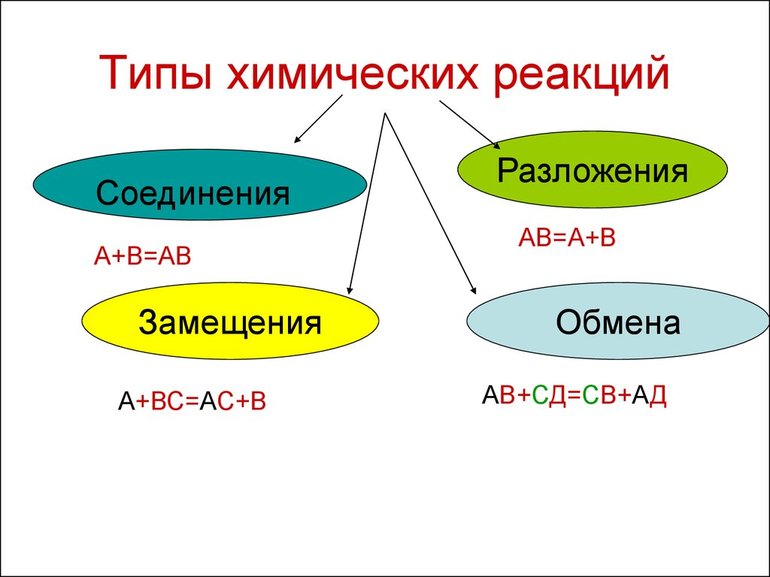
Виды химических реакций
Химические явления характеризуются тем, что из двух и более элементов образуются новые вещества. Уравнения описывают эти процессы. Впервые с объяснениями протекания реакций знакомят в восьмом классе средней образовательной школы на уроках неорганической химии. Ученикам демонстрируют опыты, в которых явно наблюдаются различия в протекании реакций.
Всего существует 4 типа химического взаимодействия веществ:
- Соединение. В реакцию могут вступать 2 простых вещества: металл и неметалл или неметалл и неметалл. Например, алюминий с серой образуют сульфид алюминия. Кислород, взаимодействуя с водородом, превращается в воду. Объединятся могут 2 оксида с растворимым основанием, как оксид кальция с водой: CaO + H2O = Ca (OH)2 или основной оксид с кислотным: CaO + SO3 = CaSO4.
- Разложение. Это процесс обратный реакции соединения: было одно вещество, а стало несколько. Например, при пропускании электрического тока через воду получается водород и кислород, а при нагревании известняка 2 оксида: CaCO3 = CaO + CO2.
- Замещение. В реакцию вступают 2 элемента. Один из них простой, а второй сложный. В итоге образуются 2 новых соединения, при котором атом простого вещества заменяет сложный, как бы вытесняя его. Условие протекания процесса: простое вещество должно быть более активным, чем сложное. Например, Zn + 2HCl = ZnCl2 + H2. Величину активности можно узнать из таблицы ряда электрохимических напряжений.
- Обмен. В этом случае между собой реагируют 2 сложных элемента, обменивающиеся своими составными частями. Условием осуществления такого типа реакции является обязательное образование воды, газа или осадка. Например, CuO + 2HCl = CuCl2 + H2O. Чтобы узнать, смогут ли вещества прореагировать, используют таблицу растворимости.
Основными признаками химических реакций является изменение цвета, выделение газа или образование осадка. Различают их по числу веществ, вступивших в реакцию и образовавшихся продуктов. Правильное определение типа реакции особо важно при составлении химических уравнений, а также определения свойств и возможностей веществ.
Видео:Составление уравнений реакций горения. 11 класс.Скачать

Окислительно-восстановительный процесс
Составление большинства реакций сводится к подбору коэффициентов. Но при этом могут возникнуть трудности с установлением равновесия, согласно закону сохранения массы веществ. Чаще всего такая ситуация возникает при решении заданий, связанных с расстановкой количества атомов в уравнениях окислительно-восстановительных процессов.
Под ними принято понимать превращения, протекающие с изменением степени окисления элементов. При окислении происходит процесс передачи атомом электронов, сопровождающийся приобретением им положительного заряда или ионом, после чего он становится нейтральным. При этом также происходит процесс восстановления, связанный с присоединением элементарных частиц атомом.
Для составления уравнений необходимо определить восстановитель, окислитель и число участвующих в реакции электронов. Коэффициенты же подбирают с помощью метода электронно-ионного баланса (полуреакций). Его суть состоит в установлении равенства путём уравнивания количества электронов, отдаваемых одним элементом и принимаемым другим.
Видео:Химия 11 класс (Урок№5 - Классификация химических реакций.)Скачать

Классический алгоритм
В основе решения задач этим методом — закон сохранения массы. Согласно ему, совокупная масса элементов до реакции и после остаётся неизменной. Другими словами, происходит перегруппировка частиц. Если рассматривать решение химического уравнения поэтапно, оно будет состоять из трёх шагов:
- Написания формул элементов, вступающих в реакцию с левой стороны.
- Указания справа формулы образующихся веществ.
- Уравнивания числа атомов с добавлением коэффициентов.
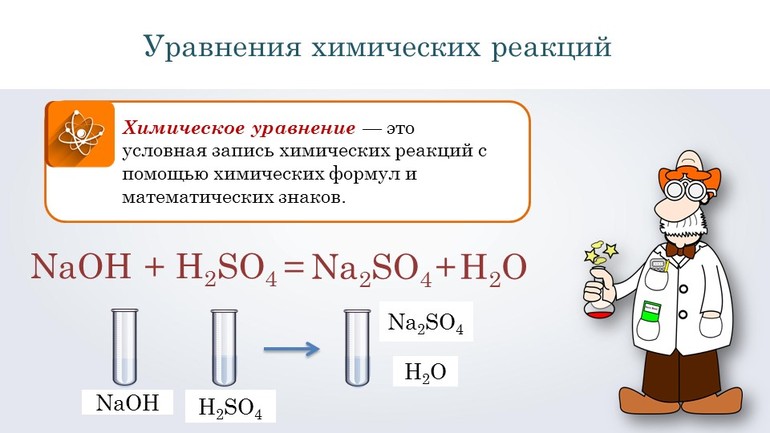
Перед тем как переходить к сложным соединениям, лучше всего потренироваться на простых. Например, нужно составить уравнение, описывающее взаимодействие двух сложных веществ: гидроксида натрия и серной кислоты. При таком соединении образуется сульфат натрия и вода.
Согласно алгоритму, в левой части уравнения необходимо записать реагенты, а в правой продукты реакции: NaOH + H2SO 4 → Na 2SO4 + H2O. Теперь следует уравнять коэффициенты. Начинают с первого элемента. В примере это натрий. В правой части содержится 2 его атома, а в левой один, поэтому необходимо возле реагента поставить цифру 2. Затем нужно уровнять водород. В результате получится выражение: 2 NaOH + H2SO 4 → Na2 SO4 +2H2O.
Ещё одним наглядным примером является процесс реакции тринитротолуола с кислородом. При их взаимодействии образуется: C7H5N3O6 + O2 → CO2 + H2O + N2. Исходя из того, что слева находится нечётное число атомов H и N, а справа чётное, нужно их уравнять: 2C7H5N3O6 + O2 → CO2 + H2O + N2.
Теперь становится понятным, что 14 и 10 атомов углерода и водорода должны образовать 14 долей диоксида и 5 молекул воды. При этом 6 атомов азота превратятся в 3. Итоговое уравнение будет выглядеть как 2C7H5N3O6 + 10,5O2 → 14CO2 + 5H2O + 3N2.
Перед тем как начинать тренировку по составлению уравнений, следует научиться расставлять валентность. Это параметр, равный числу соединившихся атомов каждого элемента. Фактически это способность к соединению. Например, в формуле NH3 валентность атома азота равна 3, а водорода 1.
Видео:Химия 11 класс: Ионные уравненияСкачать

Решение методом полуреакций
Алгоритм для решения примеров химических уравнений проще рассмотреть на конкретном задании. Пускай необходимо описать процесс окисления пирита азотной кислоты с малой концентрацией: FeS2 + HNO3. Решать этот пример необходимо в следующей последовательности:
- Определить продукты реакции. Так как кислота является сильным окислителем, сера получит максимальную степень оксидации S6+, а железо Fe3+. HNO3 может восстановиться до одного из двух состояний NO2 или NO.
- Исходя из состава ионов и правила, что вещества, переходящие в газовую форму или плохо растворимые, записываются в молекулярном виде, верным будет записать: FeS2 — Fe3+ + 2SO2−4. Гидролизом можно пренебречь.
- В записи уравнивают кислород. Для этого в левую часть добавляют 8 молекул воды, а в правую 16 ионов водорода: FeS2 + 8H20 — Fe3+ + 2SO2−4 + 16H+. Так как заряда в левой части нет, а в правой он равный +15, то серное железо должно будет отдать 15 электронов. Значит, уравнение примет вид: FeS2 + 8H20 — 15e → Fe3+ + 2SO2−4 + 16H+.
- Теперь переходят к реакции восстановления нитрата иона: NO-3 →NO. Для её составления нужно отнять у оксида азота 2 атома кислорода. Делают это путём прибавления к левой части 4 ионов водорода, а правой — 2 молекул воды. В итоге получится: NO-3 + 4H+ → NO + 2H2O.
- Полученную формулу уравнивают добавлением к левой части 3 электронов: NO-3 + 4H+ 3e → NO + 2H2O.
- Объединяют найденные выражения и записывают результат: FeS2 + 8H20 + 5NO-3 + 20H+ → Fe3+ + 2SO2−4 + 16H+ + 5NO + 10H2O.
Уравнение можно сократить на 16H + и 8H2O. В итоге получится сокращённое выражение окислительно-восстановительной реакции: FeS2 + 5NO — 3 + 4 H + = Fe3 + + 2SO 2- 4 + 5NO + 2H2O.
Такой алгоритм считается классическим, но для упрощения понимания лучше использовать способ электронного баланса. Процесс восстановления переписывают как N5+ + 3e → N2+. Степень же окисления составить сложнее. Сере нужно приписать степень 2+ и учесть, что на 1 атом железа приходится 2 атома серы: FeS2 → Fe3++ 2S6+. Запись общего баланса будет выглядеть: FeS2 + 5N5+ = Fe3+ + 2S6+ + 5N2+.
Пять молекул потратятся на окисление серного железа, а ещё 3 на образование Fe (NO3)3. После уравнения двух сторон запись реакции примет вид, аналогичный полученному с использованием предыдущего метода.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Использование онлайн-расчёта
Простые уравнения решать самостоятельно довольно просто. Но состоящие из сложных веществ могут вызвать трудности даже у опытных химиков. Чтобы получить точную формулу и не подбирать вручную коэффициенты, можно воспользоваться онлайн-калькуляторами. При этом их использовать сможет даже пользователь, не особо разбирающийся в науке.
Чтобы расстановка коэффициентов в химических уравнениях онлайн происходила автоматически, нужно лишь подключение к интернету и исходные данные. Система самостоятельно вычислит продукты реакции и уравняет обе стороны формулы. Интересной особенностью таких сайтов является не только быстрый и правильный расчёт, но и описание правил с алгоритмами, по которому выполняются действия.
После загрузки калькулятора в веб-обозревателе единственное, что требуется от пользователя — правильно ввести реагенты в специальные формы латинскими буквами и нажать кнопку «Уравнять». Иногда возникает ситуация, когда запись сделана верно, но коэффициенты не расставляются. Это происходит, если суммы в уравнении могут быть подсчитаны разными способами. Характерно это для реакций окисления. В таком случае нужно заменить фрагменты молекул на любой произвольный символ. Таким способом можно не только рассчитать непонятное уравнение, но и выполнить проверку своих вычислений.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Химические уравнения.
Химическое уравнение – это условное изображение химической реакции с помощью химических формул веществ, числовых коэффициентов и математических символов.
При записи химических уравнений должен строго соблюдаться закон сохранения массы: массы вступивших в реакцию веществ, равны массе продуктов реакции.
Химическая реакция – процесс, при котором вещества, обладающие определенным составом и свойствами, превращаются в другие вещества – с другим составом и свойствами. При этом в составе атомных ядер изменений не происходит.
Химические реакции всегда сопровождаются физическими эффектами – поглощением или выделением теплоты, изменениями агрегатного состояния и окраски веществ.
Пример составления химического уравнения:
слева 2 атома Fe – справа 1 атом Fe (множитель 2)
слева 3 атома O – справа 1 атом O (множитель 3)
Затем подбирается коэффициент для H2O:
слева 2 атома H – справа 2 атома H (множитель 1), но т.к. справа 3 атома O, то множитель для H2O получаем 3. Н в правой части уравнения имеет множитель 6, для равновесия Н, в левой части используем множитель 3.
Итоговое химическое уравнение:
Выпадение осадка в результате химической реакции обозначается в химическом уравнении стрелкой вниз ↓. Это означает, что соединение нерастворимо:
Выделение газа в результате химической реакции обозначается в химическом уравнении стрелкой вверх ↑.
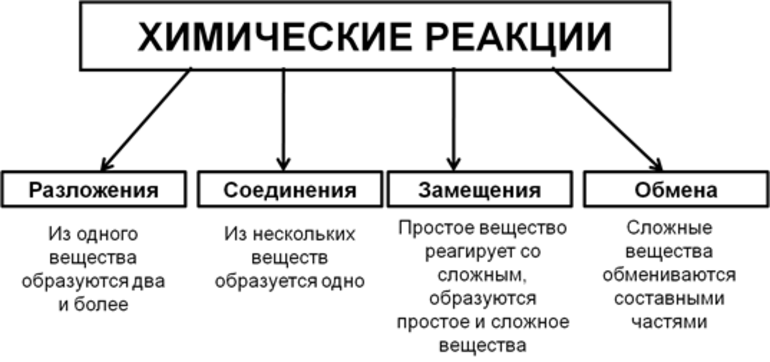
Виды химических реакций.
Реакции соединения: хотя бы два элемента образуют один продукт:
Реакции разложения: вещество распадается на два или более простых элемента (соединения):
Реакция замещения: обязательно участвуют атомы какого-нибудь простого вещества, которые замещают атомы одного из элементов в сложном веществе:
Цинк заместил водород в его соединении с хлором (HCl). Водород при этом выделяется в виде газа.
Реакция обмена: реагенты и продукты реакции являются сложными веществами:
Видео:Урок 10. Сложные уравнения и неравенства. Решение уравнений высоких степеней. Вебинар | МатематикаСкачать

Решение задач для подготовки к ЕГЭ по химии (11 класс)
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
«Актуальность создания школьных служб примирения/медиации в образовательных организациях»
Свидетельство и скидка на обучение каждому участнику
Решение задач для подготовки к ЕГЭ по химии.
ТИП I. НЕРАСТВОРИМОСТЬ ОТДЕЛЬНЫХ КОМПОНЕНТОВ.
Задача 1. Смесь алюминия и железа обработали избытком соляной кислоты, при этом выделилось 8,96 л газа (н.у.). Это же количество смеси обработали избытком раствора гидроксида натрия, выделилось 6,72 л газа (н.у.). Найти массовую долю железа в исходной смеси.
1) Составим уравнения реакций взаимодействия металлов с
кислотой и щелочью, при этом нужно учесть, что железо не реагирует с раствором щелочи:
2Al + 6HCl = 2AlCl3+ 3H2 ↑ (1)
Fe + 2HCl = FeCl2 +H2↑ (2)
2Al + 2NaOH + 6H2O == 2Na[Al(OH)4] + 3H2↑ (3)
2) Поскольку со щелочью реагирует только алюминий, то мож-
но найти его количество вещества:
ν(Н2) = V/VM = 6,72 (л) / 22,4 (л/моль) = 0,3 моль,
следовательно, ν(Al) = 0,2 моль.
3) Поскольку для обеих реакций были взяты одинаковые количества смеси, то в реакцию с
соляной кислотой вступило такое же количество алюминия, как и в реакцию со щелочью,
По уравнению (1) находим:
4) Найдем количество вещества водорода, выделившегося в результате реакции металлов с кислотой:
νобщ(Н2) = V / VМ = 8,96 (л) / 22,4 (л/моль) = 0,4 моль.
5) Найдем количество вещества водорода, выделившегося при взаимодействии железа с кислотой, и затем количество вещества железа:
ν(Н2) = νобщ(Н2) – ν(Н2) = 0,4 – 0,3 = 0,1 моль,
6) Найдем массы Al, Fe, массу смеси и массовую долю железа в смеси:
m(Al) = 27 (г/моль) * 0,2 (моль) = 5,4 г,
m(Fe) = 56 (г/моль) * 0,1 (моль) = 5,6 г,
mсмеси(Al, Fe) = 5,4 + 5,6 = 11 г,
ω(Fe) = mв-ва / mсм = 5,6 / 11 = 0,5091 (50,91 %).
Ответ. ω(Fe) = 50,91 %.
ТИП II. ПАРАЛЛЕЛЬНЫЕ РЕАКЦИИ
Речь идет об одновременно происходящих реакциях, с реагентом (реагентами) взаимодействуют все компоненты смеси. Для определения порций отдельных компонентов придется использовать алгебраический алгоритм. Поскольку в дальнейшем предстоят расчеты по уравнениям реакций, в качестве неизвестной величины лучше всего выбрать количество вещества.
Алгоритм 1. Решение через систему уравнений с двумя неизвестными
(подходит для любой задачи такого типа)
1. Составить уравнения реакций.
2. Количества веществ (ν) в исходной смеси обозначить через х, у моль и, согласно молярным соотношениям по уравнениям реакций, выразить через х, у моль количества веществ в
3. Составить математические уравнения. Для этого следует выразить массу (или объем)
веществ через х, у и молярную массу (молярный объем) по формулам:
4. Составить систему уравнений и решить ее.
5. Далее решать согласно условиям задачи
Задача 1. Пластинку из магниево-алюминиевого сплава массой 3,9 г поместили
в раствор соляной кислоты. Пластинка растворилась, и выделилось 4,48 л газа. Найти массовые доли металлов в сплаве.
1) Запишем уравнения реакции:
Mg + 2HCl = MgCl2 +H2↑
2Al+ 6HCl = 2AlCl3 +3H2↑
2) Обозначим количества веществ:
ν(Mg) = x моль; ν(Н2) = х моль;
ν(Al) = y моль; ν(Н2) = 1,5 у моль.
3) Составим математические уравнения: найдем массы магния, алюминия и их смеси, а также ко-
личество вещества выделившегося водорода:
m( смеси ) = 24 х + 27y;
ν(Н2) = V/VM = 4,48 (л) / 22,4 (л/моль) = 0,2 моль.
4) Составим систему уравнений и решим ее:
24(0,2 – 1,5у) + 27у = 3,9,
х = 0,2 – 1,5*0,1 = 0,05.
5) Найдем массы магния и алюминия и их массовые доли в смеси:
m(Mg) = 0,05 (моль) * 24 (г /моль) = 1,2 г,
m(Al) = 0,1 (моль) * 27 (г /моль) = 2,7 г,
ω(Mg) = m(Mg) / m(см.) = 1,2 (г) / 3,9 (г) = 0,3077,
ω (Al) = m(Al) / m( см .) = 2,7 / 3,9 = 0,6923.
Ответ . ω (Mg) = 30,77 %; ω (Al) = 69,23 %.
Задача 2. К раствору, содержащему 5,48 г смеси сульфата и силиката натрия, прибавили избыток хлорида бария, в результате образовалось 9,12 г осадка. Найти массы солей в исходной смеси.
1) Составим уравнения реакций:
Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl,
Na2SiO3 + BaCl2 =BaSiO3↓+ 2NaCl.
2) Обозначим количества веществ:
ν(Na2SO4) = x моль,
ν(Na2SiO3) = у моль,
ν(BaSiO3) = у моль.
3) Составим формулы для массы веществ:
m( исх . см .) = m(Na2SO4) + m(Na2SiO3),
m(обр. см.) = m(BaSO4) + m(BaSiO3).
4) Составим систему уравнений и решим ее:
m(Na2SO4) = 0,03 (моль)æ142 (г/моль) = 4,26 г,
m(Na2SiO3) = 5,48 – 4,26 = 1,22 г.
Ответ. m(Na2SO4) = 4,26 г; m(Na2SiO3) = 1,22 г.
Алгоритм 2. Решение через уравнение с одним неизвестным
(подходит только для задач, в которых можно найти общее количество продукта, образующегося во всех параллельных реакциях)
1. Составить уравнения реакций.
2. Найти количество образовавшегося вещества.
3. Обозначить количество вещества, получившегося в результате одной реакции, через
х моль, тогда количество вещества, получившегося в результате второй реакции, будет равно:
(ν – х). Выразить, согласно уравнениям реакций, количества веществ в исходной смеси.
4. Выразить массы веществ, составить и решить уравнение с одним неизвестным.
Из двух задач, решенных по алгоритму 1, этим способом можно решить только задачу 1. (в разделе
ТИП II. ПАРАЛЛЕЛЬНЫЕ РЕАКЦИИ
Решение задачи 1
1) Составим уравнения реакций:
Mg+ 2HCl = MgCl2 + H2 ↑ (1)
2Al+ 6HCl = 2AlCl3 +3H2↑ (2)
2) Найдем количество вещества образовавшегося водорода:
ν(Н2) = V / VМ = 4,48 (л) / 22,4 (л/моль) = 0,2 моль.
3) Обозначим количество вещества водорода, получившегося по реакции (2),
ν(Н2) = х моль, тогда количество вещества водорода, получившегося по реакции (1),
равно: ν(Н2) = 0,2 – х.
Согласно уравнениям реакций в исходной смеси было:
ν(Mg) = 0,2 – x; ν(Al) = 2x / 3.
4) Выразим массы:
m(Mg) = 24(0,2 – x) = 4,8 – 24x,
m(Al) = 27æ2x /3 = 18х.
Составим уравнение с одним неизвестным:
4,8 – 24х + 18х = 3,9;
ν(Mg) = 0,2 – 0,15 = 0,05 моль;
ν(Al) = 2/3 * 0,15 = 0,1 моль.
5) Найдем массы магния и алюминия и их массовые доли в смеси:
m(Mg) = 0,05 (моль) * 24 (г /моль) = 1,2 г,
m(Al) = 0,1 (моль) * 27 (г /моль) = 2,7 г,
ω(Mg) = m(Mg) / m(см.) = 1,2 (г) / 3,9 (г) = 0,3077,
ω (Al) = m(Al) / m( см .) = 2,7 / 3,9 = 0,6923.
Ответ . ω (Mg) = 30,77 %; ω (Al) = 69,23 %.
ТИП III. КОМБИНИРОВАННЫЕ ЗАДАЧИ
Задача 1. При обработке 17,4 г смеси алюминия, железа и меди избытком соляной кисло-
ты выделилось 8,96 л (н.у.) . Не растворившийся в соляной кислоте остаток растворился
в концентрированной азотной кислоте с выделением 4,48 л газа (н.у.). Определить состав
исходной смеси (в %).
1) Составим уравнения реакций:
Fe+ 2HCl = FeCl2 + H2↑
2Al+ 6HCl = 2AlCl3 +3H2↑
Cu+ 4HNO3 == С u(NO3)2 + 2NO2↑+ 2H2O.
2) Найдем количество вещества оксида азота(IV) и количество
вещества и массу меди:
ν(NO2) = V / VМ = 4,48 л / 22,4 (л/моль) = 0,2 моль,
m(Cu) = M * ν == 64 (г/моль) * 0,1 (моль) = 6,4 г.
3) Найдем массу смеси железа и алюминия:
m(Fe, Al) = 17,4 (г) – 6,4 (г) = 11 г.
4) Обозначим количества веществ:
ν(Fe) = x моль, ν(Н2) = х моль;
ν(Al) = y моль, ν(Н2) = 1,5 у моль.
5) Выразим массы Fe и Al через x и y; найдем количество вещества водорода:
m(Fe) = 56x; m(Al) = 27y;
ν(Н2) = V / VМ = 8,96 (л) / 22,4 (л/моль) = 0,4 моль.
6) Составим систему уравнений и решим ее:
56(0,4 – 1,5у) + 27у = 11,
х = 0,4 – 1,5*0,2 = 0,1.
7) Найдем массы железа и алюминия, затем массовые доли веществ в смеси:
m(Fe) = 0,1 (моль) * 56 (г/моль) = 5,6 г,
m(Al) = 0,2 (моль) * 27 (г/моль) = 5,4 г;
ω(Cu) = m(Cu) / m(см.) = 6,4 (г) / 17,4 (г) = 0,368,
ω(Fe) = m(Fe) / m(см.) = 5,6 (г) / 17,4 (г) = 0,322,
ω (Al) = m(Al) / m( см .) = 5,4 ( г ) / 17,4 ( г ) = 0,31.
Ответ . ω ( С u) = 36,8 %; ω (Fe) = 32,2 %; ω (Al) = 31 %.
Краткое описание документа:
В данной разработке рассматриваются три типа решения задач:
1тип — нерастворимость отдельных компонентов;
2 тип — параллельные реакции;
3 тип — комбинированные задачи.
Разработка может помочь рассмотреть задачи и подготовиться к ЕГЭ обучающимся 11 класса. Также данные задачи можно использовать на уроках и для подготовки к олимпиадам..
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 949 человек из 80 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Курс добавлен 23.11.2021
- Сейчас обучается 48 человек из 28 регионов
Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 33 человека из 19 регионов
Ищем педагогов в команду «Инфоурок»
Видео:Интенсив "Сокрушительная битва"|Электрические цепи-2. 11 классСкачать

Дистанционные курсы для педагогов
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 565 471 материал в базе
Другие материалы
- 12.11.2014
- 1963
- 2
- 12.11.2014
- 949
- 0
- 12.11.2014
- 701
- 0
- 11.11.2014
- 782
- 1
- 11.11.2014
- 902
- 11
- 11.11.2014
- 1051
- 1
- 11.11.2014
- 1644
- 18
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 12.11.2014 17458
- DOCX 19.8 кбайт
- 130 скачиваний
- Рейтинг: 5 из 5
- Оцените материал:
Настоящий материал опубликован пользователем Пухова Алия Руслановна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 7 лет и 3 месяца
- Подписчики: 0
- Всего просмотров: 21811
- Всего материалов: 4
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Видео:Химия 8 класс VS Химия 11 класс || Тася ФламельСкачать

Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Новые курсы: управление детским садом, коучинг, немецкий язык и другие
Время чтения: 18 минут
ЕГЭ в 2022 году будут сдавать почти 737 тыс. человек
Время чтения: 2 минуты
Тринадцатилетняя школьница из Индии разработала приложение против буллинга
Время чтения: 1 минута
Объявлен конкурс дизайн-проектов для школьных пространств
Время чтения: 2 минуты
В Рособрнадзоре рассказали, как будет меняться ЕГЭ
Время чтения: 2 минуты
Профессия педагога на третьем месте по популярности среди абитуриентов
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
🎦 Видео
Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Как решают уравнения в России и СШАСкачать

Окислительно-восстановительные реакции с нуля!| Екатерина Строганова | 100балльный репетиторСкачать

Проверь свои знания по математике за 11 классСкачать

Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Органическая химия 🤪 #химия #органическаяхимия #ограника #репетитор #10классСкачать

Тест по ХИМИИ средней сложностиСкачать