Самостоятельная работа по физике Уравнение Клапейрона-Менделеева. Изопроцессы 10 класс с ответами. Представлено 5 вариантов самостоятельных работ. В каждом варианте по 2 задания.
- 1 вариант
- 2 вариант
- 3 вариант
- 4 вариант
- 5 вариант
- 10 класс уравнение Менделеева- Клапейрона тест по физике (10 класс) на тему
- Скачать:
- Предварительный просмотр:
- По теме: методические разработки, презентации и конспекты
- Самостоятельная работа по теме «Уравнение состояния идеального газа. Газовые законы»
- 🔥 Видео
Видео:Урок 156. Уравнение состояния идеального газа. Квазистатические процессыСкачать

1 вариант
1. В баллоне объемом 100 л находится 2 г кислорода при температуре 47 °С. Каково давление газа в баллоне?
2. Во сколько раз увеличится объем пузырька воздуха, поднявшегося при постоянной температуре с глубины 8 км на поверхность? Атмосферное давление нормальное.
Видео:62. Уравнение Клапейрона-МенделееваСкачать

2 вариант
1. При изотермическом процессе объем газа увеличился в 6 раз, а давление уменьшилось на 50 кПа. Определите конечное давление газа.
2. Найдите объем водорода массой 1 кг при температуре 27 °С и давлении 100 кПа.
Видео:Задачи на уравнение Менделеева-Клапейрона. Ч.1. Краткая теория + решение задачиСкачать

3 вариант
1. Какова плотность азота при температуре 27 °С и давлении 100 кПа?
2. В процессе изобарного нагревания объем газа увеличился в 2 раза. На сколько градусов нагрели газ, если его начальная температура равна 273 °С?
Видео:Физика 10 класс (Урок№20 - Уравнение состояния идеального газа. Газовые законы.)Скачать

4 вариант
1. В процессе изохорного охлаждения давление газа уменьшилось в 3 раза. Какой была начальная температура газа, если конечная температура стала равной 27 °С?
2. В баллоне объемом 200 л находился гелий под давлением 100 кПа при температуре 17 °С. После подкачивания гелия его давление поднялось до 300 кПа, а температура увеличилась до 47 °С. На сколько увеличилась масса гелия?
Видео:Решение графических задач на тему Газовые законыСкачать

5 вариант
1. При давлении 10 5 Па и температуре 15 °С воздух имеет объем 2 л. При каком давлении воздух данной массы займет объем 4 л, если температура его станет равной 20 °С?
2. В процессе изобарного охлаждения объем идеального газа уменьшился в 2 раза. Какова конечная температура газа, если его начальная температура равна 819 °С? Масса газа постоянна.
Ответы на самостоятельную работу по физике Уравнение Клапейрона-Менделеева. Изопроцессы 10 класс
1 вариант
1. 1662 Па
2. 801
2 вариант
1. 10 кПа
2. 12,45 м 3
3 вариант
1. 1,1 кг/м 3
2. 546 К
4 вариант
1. 900 К
2. 57,76 г
5 вариант
1. 0,49 · 10 5 Па
2. 546 К
Видео:Газовые Законы и Правила. Уравнение Менделеева-Клапейрона. Пример расчета объема газа при Р атм.Скачать

10 класс уравнение Менделеева- Клапейрона
тест по физике (10 класс) на тему
Видео:Уравнение состояния идеального газа. 10 класс.Скачать

Скачать:
| Вложение | Размер |
|---|---|
| 10_klass_ur-e_m-k.doc | 100.5 КБ |
Видео:Физика. МКТ: Уравнение Менделеева-Клапейрона для идеального газа. Центр онлайн-обучения «Фоксфорд»Скачать

Предварительный просмотр:
Для приведения в движение гребных винтов торпеды применяют воздух, сжатый до 190 ∙ 10 5 Па, в баллонах вместимостью 6 ∙ 10 -1 м 3 . При какой температуре находится воздух, если масса его 130 кг, а молярная масса 29 ∙ 10 -3 кг/моль?
Определите плотность азота при температуре 27°С и давлении 100 кПа.
Углекислый газ в количестве 1000 молей при давлении 1Мпа имеет температуру 100°С. Найдите объём газа
При давлении 10 5 Па и температуре 27°C плотность некоторого газа 0,162 кг/м 3 . Определите какой это газ.
Плотность некоторого газа 2,5 при температуре 10 и нормальном атмосферном давлении. Найти молярную массу этого вещества.
Определить давление кислорода в баллоне объемом 1 л при температуре27С. Масса кислорода 1 кг.
Для приведения в движение гребных винтов торпеды применяют воздух, сжатый до 10 5 Па, в баллонах вместимостью 6 ∙ 10 -1 м 3 . При какой температуре находится воздух, если масса его 150 кг, а молярная масса 29 ∙ 10 -3 кг/моль?
Каким может быть наименьший объем баллона, содержащего кислород массой 6,4 кг , если его стенки при 20 С выдерживают давление 1568Н/см?
Найти формулу некоторого соединения углерода с водородом, если известно, что это вещество массой 0,66г в газообразном состоянии при температуре27 в объеме 1 дм 3 создает давление 100кПа?
Определить давление кислорода в баллоне объемом V = 1 м 3 при температуре t=27 °С. Масса кислорода m = 0,2 кг.
Масса 327 мл газа при 13 0 С и давлении 1,04*10 5 Па равна 828 г. Вычислить молекулярную массу газа.
Определить плотность азота при температуре 27 0 С и давлении 760 мм рт. ст.
Баллон емкостью V= 12 л содержит углекислый газ. Давление газа Р = 1 МПа, температура Т = 300 К. Определить массу газа.
Какова плотность водорода при нормальном атмосферном давлении и температуре 20°С.
При температуре Т = 309 К и давлении Р = 0,7 МПа плотность газа ρ = 12 кг/м 3 . Определить молярную массу газа.
Какова плотность водорода при нормальном атмосферном давлении и температуре 20°С.
Определите плотность азота при температуре 300 К и давлении 2 атм.
Определите массу водорода, находящегося в баллоне вместимостью 20 л под давлением 830 кПа при температуре 17 °С.
Баллон вместимостью 40 л содержит углекислый газ массой 1,98 кг. Баллон выдерживает давление не выше 3 ∙ 10 6 Па. При какой температуре возникает опасность взрыва?
В сосуде вместимостью 500 см 3 содержится 0,89 г водорода при температуре 17 °С. Определите давление газа.
Какой объем занимает газ в количестве 10 3 моль при давлении 10 6 Па и температуре 100 °С?
Имеется 12 л углекислого газа под давлением 9 ∙ 10 5 Па и при температуре 288 К. Определите массу газа.
Азот (N2) 28,016 Аммиак (NH3) 17,031 Аргон (Ar) 39,944 Ацетилен (C2H2) 26,04 Ацетон (C3H6O) 58,08 Н-бутан (C4H10) 58,12 Изо-бутан ( C4HJ0) 58,12 Н-бутиловый спирт ( C4HJ0O) 74,12 Вода (H2O) 18,016 Водород (H2) 2,0156 Воздух (сухой) 28,96 Н-гексан (C6HJ4) 86,17 Гелий (He) 4,003 Н-гептан (C7HJ6) 100,19 Двуокись углерода (CO2) 44,01 Н-декан ( C10H22) 142,30 Дифенил ( C12H10) 154,08 Дифениловый эфир ( CJ2H10O) 168,8 Дихлорметан ( CH2Cl2) 84,94 Диэтиловый эфир (C4H10O) 74,12 Закись азота (N2O) 44,016 Йодистый водород (HJ) 127,93 Кислород (O2) 32,00 Криптон (Kr) 83,7 Ксенон (Xe) 131,3 Метан (CH4) 16,04 Метиламин (CH5N) 31,06 Метиловый спирт (CH4O) 32,04 Неон (Ne) 20,183 Нитрозилхлорид (NOCl) 65,465 Озон (O3) 48,00 Окись азота (NO) 30,008 Окись углерода (CO) 28,01 Н-октан ( C8H18) 114,22 Н-пентан ( C5H12) 72,14 Изо-пентан ( C5H12) 72,14 Пропан ( C3H8) 44,09 Пропилен ( C3H6) 42,08 Селеновая кислота (H2Se) 80,968 Сернистый газ (SO2) 64,06 Сернистый ангидрид (SO3) 80,06 Сероводород (H2S) 34,08 Фосфористый водород (PH3) 34,04 Фреон 11 (CF3CI) 137,40 Фреон-12 (CF2CI2) 120,92 Фреон-13 (CFCI3) 114,47 Фтор (F2) 38,00 Фтористый кремний (SiF4) 104,06 Фтористый метил (CH3F) 34,03 Хлор (Cl2) 70,914 Хлористый водород (HCl) 36,465 Хлористый метил (CH3Cl) 50,49 Хлороформ (CHCl3) 119,39 Циан (C2N2) 52,04 Цианистая кислота (HCN) 27,026 Этан (C2H6) 30,07 Этиламин (C2H7N) 45,08 Этилен (C2H4) 28,05 Этиловый спирт (C2H6O) 46,07 Хлористый этил (C2H5Cl) 64,52
1 атм ≡ 1.033227565 ат
1 атм ≡ 10332.275649687 кГс/м²
1 атм ≡ 1.033227453 кГс/см²
1 атм ≡ 101.325011003 кПа
1 атм ≡ 0.101325011 МПа
1 атм ≡ 101325.011003072 Н/м²
1 атм ≡ 10.1325011 Н/см²
760мм рт. ст. ≈ 10 5 Па
Видео:Газовые законы. Изопроцессы | Физика 10 класс #34 | ИнфоурокСкачать

По теме: методические разработки, презентации и конспекты
Уравнение Менделеева — Клапейрона
Методическое пособие по физике и химии.
Интегрированный урок (физика + информатика) . «Решение задач на уравнение Менделеева-Клапейрона и газовые законы»
В процессе разработки данного урока «Решение задач на уравнение Менделеева- Клапейрона и газовые законы»,я использовала следующие виды информационных технологий: анимационные, презентационные и .
Уравнение Менделеева-Клапейрона. Газовые законы.
Урок по теме: «Уравнение Менделеева-Клапейрона»
Тезисы работы_Емелюковой.doc:Урок по теме: «Уравнение Менделеева-Клапейрона»Тип урока: Комбинированный урок с использованием современных информационных технологий, метода проектов. Цель урока.
Физика. Презентация к уроку «Решение задач на уравнение Менделеева-Клапейрона»
Этот урок позволяет сравнить подходы решения задач на уравнение Менделеева- Клапейрона с точки зрения физики и химии.
Презентация на тему «Уравнение Менделеева — Клапейрона»
Презентация «Уравнение Менделеева — Клапейрона» представляет изучение нового материала и первичного закрепления по теме: « Уравнение состояния идеального газа» с прим.
Задачи по теме «Уравнение Менделеева -Клапейрона» , 10 класс
Задачи по физике для 10 класса.Тема » Уравнение Менделеева — Клапейрона".
Видео:Урок 158. Задачи на газовые законы - 1Скачать

Самостоятельная работа по теме «Уравнение состояния идеального газа. Газовые законы»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Рабочие листы и материалы для учителей и воспитателей
Более 300 дидактических материалов для школьного и домашнего обучения
Самостоятельная работа № 6
Тема «Уравнение состояния идеального газа. Газовые законы»
Задания обязательного уровня
Относительной молекулярной массой вещества называется…
Число молекул любого количества вещества определяется по формуле:
1) n = 

3. Количество вещества обозначается:
4. Постоянная Авогадро равна:
1) 1,38∙10 -23 

5. Процесс в газе, который происходит при постоянной массе и неизменном давлении называется…
6. Уравнение изохорного процесса:
1) 

7. График закона Бойля – Мариотта

8. Формула закона Клапейрона – Менделеева:
1) p = nkT ; 2) E = 

9. Единица измерения молярной массы вещества:
1) кг/моль; 2) моль; 3) моль/кг; 4) кг.
10. Термодинамическая температура вычисляется по формуле:
1) t = T + 273; 2) t = 273 – T ; 3) T = t + 273; 4) T = 273 — t
Задания дополнительного уровня
При давлении 2∙10 5 Па объем воздуха 4 л. Найти его объем при давлении 3∙10 5 Па.
В сосуде объемом 83 л находится 20 г водорода при температуре 27 0 С. Определить его давление.
13 * . Изменится ли средняя квадратичная скорость молекул азота, если температура газа увеличится в 4 раза?
Задания обязательного уровня
1. Молярной массой вещества называют…
2. Количество вещества вычисляется по формуле:
1) ν = 


3. Число молекул любого количества вещества обозначают:
1) n ; 2) N A ; 3) M ; 4) N
4. Постоянная Больцмана равна:
1) 1,38∙10 -23 

5. Процесс в газе, который происходит при постоянной массе газа и неизменной температуре называется…
6. Уравнение закона Гей – Люссака:
1) 

7. График изохорного процесса:

8. Объединенный газовый закон:
1) p = nkT ; 2) E = 

9. Единица измерения количества вещества:
1) кг/моль; 2) моль; 3) моль/кг; 4) кг.
10. Средняя кинетическая энергия поступательного движения молекул вычисляется по формуле:
1) υ = 

Задания дополнительного уровня
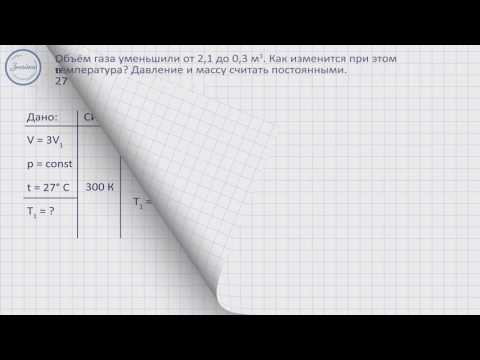
Газ занимал объем 3∙10 -3 м 3 при температуре 460 К. После изобарного сжатия температура газа понизилась до 130 К. До какого объема сжали газ?
12. Определить температуру газа в сосуде при давлении 5∙10 5 Па, если его концентрация 6∙10 25 м -3 .
13 * . В резервуаре объемом 3000 л находится пропан (С 3 Н 8 ), количество вещества которого 140 моль, а температура 300 К. Какое давление оказывает газ на стенки сосуда?
Задания обязательного уровня
1. Один моль – это …
2. Молярная масса вещества вычисляется по формуле
1) M = m 0 N A ; 2) M = 

3. Концентрация молекул обозначается:
4. Универсальная газовая постоянная равна:
1) 1,38∙10 -23 

5. Уравнение закона Шарля:
1) 

6. График закона Гей – Люссака:

7. Перемешивание газов жидкостей и твердых тел называют …
8. Основное уравнение МКТ:
1) 

9. Единица измерении термодинамической температуры:
1) 0 C ; 2) м/с; 3) Дж; 4) К
10.Средняя квадратичная скорость движения молекул вычисляется по формуле:
1) υ = 


Задания дополнительного уровня
11. Давление газа в сосуде при температуре 10 0 С равно 4∙10 5 Па. Каким станет давление в сосуде при повышение температуры до 200 0 С?
12. Вычислить кинетическую энергию молекул газа, находящихся под давлением 180 кПа, если его концентрация 3∙10 25 м -3 .
13 * . Концентрация молекул газа уменьшилась в 2 раза, а средний квадрат скорости движения молекул увеличился в 4 раза. Изменилось ли давление газа? Как?
Задания обязательного уровня
1. Идеальным газом называют такой газ, в котором …
2. Относительная молекулярная масса вычисляется по формуле:
1) M = m 0 N A ; 2) ν = 

3. Масса молекулы обозначается:
4. Процесс в газе, который происходит при постоянной массе газа и неизменном объеме называется …
5. Уравнение закона Бойля – Мариотта:
1) 

6. График изобарного процесса:

7. Формула, выражающая зависимость давления газа от его температуры:
1) p = nkT ; 2) p = 
8. Единица измерения средней квадратичной скорости движения молекул:
1) Дж; 2) м/с; 3) м 3 ; 4) м/с 2
9. Число молекул любого количества вещества определяется по формуле:
1) N A = 

10. Постоянная Лошмидта равна:
1) 1,38∙10 -23 

Задания дополнительного уровня
11. Кислород при температуре 31 0 С и давлении 2∙10 5 Па изохорно охладили, после чего давление стало равно 10 5 Па. До какой температуры охладили кислород?
12. Определить массу молекулы водорода при температуре 0 0 С, если ее средняя квадратичная скорость равна 1800 м/с
13 * . При изотермическом процессе давление газа уменьшилось в 3 раза. Изменилась ли концентрация молекул газа в сосуде? Как?
Задания обязательного уровня
Количество вещества равно… .
Средняя квадратичная скорость движения молекул определяется по формуле
1) ν = 


Какое явление, названное затем его именем, впервые наблюдал Роберт Броун
беспорядочное движение отдельных молекул;
беспорядочное движение отдельных атомов;
беспорядочное движение мелких твердых частиц в жидкости;
все три явление перечисленные в ответах а-в
Универсальная газовая постоянная равна
1) 1,38∙10 -23 

Уравнение закона Бойля-Мариотта
1) 

График закона Шарля

Объединенный газовый закон
1) p = nkT ; 2) pV = 


Единица измерения средней кинетической энергии поступательного движения молекул
1) 0 C ; 2) м/с; 3) Дж; 4) К
Молярная масса вещества вычисляется по формуле
1) M = m 0 N A ; 2) M r = 

Постоянная Авогадро обозначается
1) n ; 2) N A ; 3) M ; 4) N
II . Задания дополнительного уровня
Газ занимал объем 5∙10 -3 м 3 при температуре 360 К. Какой стала температура газа после изобарного сжатия газа до объема 2∙10 -3 м 3 ?
Какое количество вещества содержится в газе, если при давлении 200 кПа и температуре 240 К его объем равен 40 л?
13 * . При изобарном процессе концентрация молекул газа в сосуде увеличилась в 5 раз. Изменилась ли средняя кинетическая энергия молекул?
Задания обязательного уровня
Средняя кинетическая энергия поступательного движения молекул вычисляется по формуле
1) E = 

Первое положение МКТ
Термодинамическая температура обозначается
1) t; 2) m; 3) T; 4) k
Уравнение Менделеева — Клапейрона
1) p = nkT ; 2) pV = 


Единица измерения массы молекулы вещества
1) кг; 2) кг / моль; 3) Дж; 4) моль
Постоянная Авогадро равна
1) 1,38∙10 -23 

Уравнение закона Гей – Люссака
1) 

График изотермического процесса

Относительная молекулярная масса вещества вычисляется по формуле
1) M = m 0 N A ; 2) M r = 

Задания дополнительного уровня
При сжатии газа его объем уменьшился с 8 до 5 л, а давление стало равным 60 кПа. Найти первоначальное давление газа.
12. Определить давление газа на стенки сосуда, если его концентрация 2∙10 25 м -3 , средняя квадратичная скорость движения молекул 2000 м/с, а масса молекулы 3∙10 -27 кг.
13 * . Метеорологический шар, заполненный водородом, поднялся на высоту, где температура воздуха 0 0 С. Давление внутри шара 1,5∙10 5 Па. Какова плотность водорода внутри шара?
Задания обязательного уровня
Постоянной Авогадро называют …
2. Количество вещества вычисляется по формуле:
1) N = 


3. Постоянная Больцмана равна:
1) 6,02∙10 23 

4. Молярная масса вещества обозначается:
1) n ; 2) N A ; 3) M ; 4) N
5. Единица измерения давления газа:
1) кг; 2) м 3 ; 3) Дж; 4) Па
6. Второе положение МКТ.
7. График закона Гей – Люссака:

Уравнение изотермического процесса:
1) 

9. Основное уравнение МКТ:
1) 

10.Средняя кинетическая энергия поступательного движения молекул вычисляется по формуле
1) R = N A k; 2) υ = 

II .Задания дополнительного уровня
11. При сжатии газа, давление которого 50 кПа, его объем уменьшился с 7 до 3 л. Каким стало давление газа?
В баллоне вместимостью 0,03 м 3 находится газ под давлением 1,35∙10 6 Па при температуре 455 0 С. Какой объем занимал бы этот газ при нормальных условиях?
13 * . В первом сосуде находится водород, во втором – кислород. Чему равно отношение 
Задания обязательного уровня
2. Давление газа вычисляется по формуле:
1) р = 


3. Постоянная Лошмидта равна:
1) 1,38∙10 -23 

4. Универсальная газовая постоянная обозначается:
1) k ; 2) N A ; 3) R ; 4) T
5. Единица измерения объема газа:
1) кг; 2) м 3 ; 3) Дж; 4) Па
6. Третье положение МКТ.
7. График изобарного процесса:

Уравнение изобарного процесса:
1) 

9. Формула, выражающая зависимость давления газа от его температуры:
1) p = nkT ; 2) p = 
10. Число молекул любого количества вещества определяется по формуле:
1) N = 

II .Задания дополнительного уровня
11. Газ находится в сосуде при температуре 25 0 С равно 4∙10 5 Па. Каким было первоначальное давление газа, если при повышении температуры до 100 0 С, его давление стало равно 4∙10 5 Па?
12. При какой температуре средняя кинетическая энергия поступательного движения молекул газа будет равно 5,71∙10 -20 Дж?
13 * . Какое давление производят пары ртути в баллоне ртутной лампы объемом 3∙10 -3 м 3 при 200 К, если в ней содержится 1000 молекул?
🔥 Видео
Уравнение состояния идеального газа | Физика 10 класс #33 | ИнфоурокСкачать

Успеть за 300 секунд, #3: Уравнение Клапейрона-МенделееваСкачать

Урок 2.Уравнение Менделеева-Клапейрона. Решение задач. База. ЕГЭСкачать

Эта тема ВСЕГДА встречается на экзамене ЦТ — Изопроцессы (Физика для чайников)Скачать

Физика 10 класс: Уравнение Клапейрона-МенделееваСкачать

Физика 10 класс. Газовые законы. Решение задачСкачать
Физика 10 класс. Газовые законыСкачать

Газовые законы | ХимияСкачать










