- Содержание:
- Последовательные реакции
- Параллельные реакции
- Сопряженные реакции
- Цепные реакции
- Уравнения химических реакций
- Простые уравнения по химии
- Простые химические реакции
- Сложные уравнения реакций
- Сложные уравнения химических реакций
- Реакции в кислой среде
- Реакции в щелочной среде
- Реакции в нейтральной среде
- Особые случаи составления уравнений окислительно-восстановительных реакций
- Первый случай
- Второй случай
- Третий случай
- Четвертый случай
- Пятый случай
- Шестой случай
- Седьмой случай
- Составление уравнений реакций самоокисления-самовосстановления
- Составление уравнений реакций внутримолекулярного окисления-восстановления
- Составление уравнений реакций окисления металлов кислотами и щелочами
- Окислительно-восстановительные эквиваленты
- Похожие страницы:
- Leave a Comment
- Профессор Знаев
- ОСНОВНОЕ МЕНЮ
- НАЧАЛЬНАЯ ШКОЛА
- РУССКИЙ ЯЗЫК
- ЛИТЕРАТУРА
- АНГЛИЙСКИЙ ЯЗЫК
- НЕМЕЦКИЙ ЯЗЫК
- ИСТОРИЯ
- БИОЛОГИЯ
- ГЕОГРАФИЯ
- МАТЕМАТИКА
- ИНФОРМАТИКА
- Самая длинная реакция
- 🔥 Видео
Содержание:
Самые сложные химические реакции – реакции, которые протекают в две и более стадии. Как правило, в ходе сложной реакции образуются активные промежуточные вещества. Сложные реакции классифицируют на несколько типов:
- последовательные взаимодействия;
- параллельные взаимодействия;
- сопряженные взаимодействия;
- цепные взаимодействия.
Видео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Последовательные реакции
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Параллельные реакции
В данной реакции несколько продуктов образуются одновременно.
Видео:Самая сложная задача из самой сложной олимпиады [3Blue1Brown]Скачать
![Самая сложная задача из самой сложной олимпиады [3Blue1Brown]](https://i.ytimg.com/vi/S6_R5j8hzbY/0.jpg)
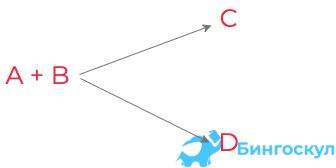
Сопряженные реакции
Схемы сопряженных реакций выглядят следующим образом:
А + В → С
А + D → Е
Данные реакции часто проходят в разных условиях. Например, первое взаимодействие проходит произвольно, а второе – при наличии первой реакции. Молекула А в двух взаимодействиях – актор, молекула В – индуктор, а молекула А во второй реакции – акцептор. Пример сопряженного взаимодействия – реакция бензола с пероксидом водорода в присутствии солей двухвалентного железа.
Видео:Сложные уравнения. Как решить сложное уравнение?Скачать

Цепные реакции
Данные реакции включают в себя ряд связанных между собой стадий. На частицах, которые синтезируются на каждом этапе, основаны все последующие стадии. Они проходят в присутствии свободных радикалов. Для цепной реакции свойственно три стадии.
1. Зарождение цепи
2. Развитие цепи
В результате данной стадии увеличивается количество продукта, которые приходятся на активную частицу.
Данная стадия может наступать при соприкосновении частиц со стенками емкости, в которой проводится реакция.
Формирование молекул соляной кислоты – это пример неразветвленной сложной химической реакции, где одной прореагировавшей активной частице соответствует одна образовавшаяся. Разветвленные реакции характеризуются формированием большого количества активных частиц (взаимодействие кислорода и водорода).
1. Инициация цепи
2. Развитие цепи
Важнейшие сложные реакции в химии – каталитические реакции. В их результате происходит циклическое образование и расходование промежуточных веществ. При катализе промежуточные вещества — устойчивые образования, которые могут существовать без реакции достаточно долго. Таким образом, сложные реакции – это важнейшие реакции в химии.
Видео:8 класс. Составление уравнений химических реакций.Скачать

Уравнения химических реакций
Уравнения химических реакций это запись с помощью специальных формул, их называют условными потому, что выполняется письменно на листе бумаги.
В химическом уравнении могут выводиться не только химическая реакция но и числовые коэффициенты, математические символы.
Применяется на практике для производства различных расчетов, связанных с той или иной реакцией.
Видео:Самые сложные задания с ЕГЭ по химии 2023 | Екатерина СтрогановаСкачать

Простые уравнения по химии
При составлении уравнения окислительно-восстановительной реакции необходимо определить: восстановитель и окислитель и число отдаваемых и принимаемых ими электронов.
Число электронов, отдаваемых восстановителем и принимаемых окислителем, определяется изменением валентности атомов и ионов до и после реакции.
Коэффициенты в уравнениях для восстановителя и окислителя находятся по правилу:
Общее число электронов, отданных восстановителем, должно равняться общему числу электронов, принятых окислителем.
При составлении уравнения реакции следует написать формулы исходных веществ (на первом месте — восстановитель, на втором — окислитель), а затем знак равенства и образующиеся продукты.
В качестве примера рассмотрим реакцию окисления алюминия кислородом.
1) Находим восстановитель и окислитель. В данном случае алюминий — восстановитель, а кислород — окислитель.
2) Пишем формулы исходных веществ и ставим знак равенства:
3) Подписываем под восстановителем число отдаваемых им электронов — три, под окислителем — число принимаемых электронов — четыре:
4) Находим коэффициенты для восстановителя и окислителя; для этого число, стоящее под окислителем, ставим перед восстановителем, а число, стоящее под восстановителем, ставим перед окислителем:
5) Пишем в правой части уравнения формулы образующихся веществ:
При некотором навыке не понадобится переписывать урав нение несколько раз и все вышеуказанные операции можно производить с одним и тем же уравнением.
Простые химические реакции
Ниже приводим уравнения окислительно-восстановительных процессов простых реакций, в которых нижние цифры обозначают число электронов, отдаваемых восстановителем и принимаемых окислителем:
Видео:Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

Сложные уравнения реакций
При составлении уравнений реакций окисления-восстановления необходимо помнить, что эти процессы зависят от характера среды, в которой они протекают.
Нередко окислитель или восстановитель проявляют свои характерные свойства только в определенной среде: кислой, щелочной или нейтральной. От среды зависит скорость реакции.
В неко торых случаях среда изменяет даже направление процесса.
В данном случае кислая среда благоприятствует течению процесса справа налево, т. е. в сторону образования J2 и Н2O.
Происходит это потому, что в результате восстановления сложного аниона JO3 — образуются практически недиссоциированные молекулы воды; щелочная же среда сдвигает равновесие реакции слева направо, т. е. в сторону образования йодноватой кислоты HJO3 и HJ, так как избыток гидроксильных ионов ОН — , соединяясь с ионами водорода, образует также молекулы воды.
Для создания в растворе кислой среды обычно пользуются серной кислотой. Соляная и азотная кислоты применяются реже, так как первая способна, проявляя восстановительные свойства, окисляться, а вторая сама является сильным окислителем и потому может вызывать дополнительные побочные процессы.
Для создания щелочной среды применяется, главным образом, NaOH или КОН.
Приступая к составлению сложных уравнений реакций с участием среды, следует, так же как и в уравнениях простейших реакций, в левой части написать исходные вещества, затем найти коэффициенты и написать формулы получающихся веществ.
Сложные уравнения химических реакций
При написании уравнений этих реакций необходимо руководствоваться следующими правилами:
1. В кислой среде ионы водорода с кислородом (О -II ) образуют очень слабо диссоциированные молекулы воды.
2. В кислой или нейтральной среде ионы металлов (одно-, двух- и трехзарядные) с кислотными остатками образуют соли.
3. Ионы металлов, дающие не растворимые в воде гидроокиси, в щелочной среде образуют соответствующие гидроокиси, например Сu(ОН)2.
4. Ионы металлов (двух-, трех- и четырехзарядные), способные давать амфотерные гидроокиси, образуют в щелочной среде гидроксисоли.
В процессе реакции могут образовываться сложные и простые ионы типа: ЭО3 — , ЭО 2 4 — , ЭО 3 4 — , ЭO4 — , ЭО 2 3 — , Э 2+ , Э 3+ , Э — , Э 2- и т. д.
Так, например, ионы NO 2- , SO 2 3 — , РО 3 3 — , отдавая каждый по 2 электрона, переходят соответственно в ионы NO3 — , SO 2 4 — , РО 3 4 — , а ионы МnО4 — , СrO 2 4 — , СlO3 — , принимая соответственно 5, 3 и 6 электронов, превращаются в ионы Мn 2+ , Сr 3+ , Сl — .
Об окончании окислительно-восстановительной реакции судят по изменению цвета, выпадению осадка или по выделению газа.
Например, красно-фиолетовые МnО4 — при переходе в Мn 2+ становится бледно-розовым (почти бесцветным), оранжево-красный Сr2O 2 7 — при переходе в Сr 3+ становится зеленым.
Реакция 2H2S + SO2 = ↓3S + 2H2O сопровождается выпадением осадка серы.
Реакция Zn + H2SO4 = ↑ Н2 + ZnSO4 сопровождается выделением газа — водорода.
Реакции в кислой среде
Составим уравнение реакции сернистокислого натрия (сульфита натрия) с марганцовокислым калием (перманганатом калия) в кислой среде, придерживаясь следующей последовательности:
1. Напишем в левой части уравнения формулы исходных веществ:
2. Определим восстановитель и окислитель и необходимые коэффициенты для них.
При нахождении окислительно-восстановительных свойств указанных веществ рассуждаем следующим образом.
В молекуле Na2SO3 натрий находится в виде Na + , т. е. он уже окислился (отдал свой электрон), повышать же свою валентность он не может, так как более чем 1 валентность для натрия не существует.
Поэтому мы можем твердо сказать, что натрий не может быть восстановителем. Но раз он является ионом, следовательно, может проявлять окислительные свойства, т. е. быть окислителем. Теоретически это так.
Однако насколько натрий (как и все щелочные элементы) в свободном состоянии является сильным восстановителем, настолько он в виде иона является слабым окислителем.
Это объясняется, во-первых, тем, что при переходе нейтрального атома натрия в ионное состояние (Na + ) затрачивается небольшая работа (энергия), т. е. ионизационный потенциал натрия первого порядка равен всего 5,09 электрон-вольт, тогда как, например, у кислорода он равен 13,57 эв.
Поэтому ион натрия хотя и обладает сродством к электрону, но небольшим, так как энергия, выделяющаяся при присое динении электрона к положительному иону натрия, равна энергии ионизации с обратным знаком.
Во-вторых, электроны значительно сильнее будут в нашем случае притягиваться к семивалентному марганцу в ионе МnO4-, чем к одновалентному иону Na + , что подтверждается величинами нормальных окислительно-восстановительных потенциалов (последние более подробно будут рассмотрены в главе «Количественная характеристика окислительно-восстановительных реакций»).
Поэтому натрий в данном случае (в присутствии более сильного окислителя) не может являться и окислителем.
Сера в ионе SO 2 3 — обладает промежуточной валентностью и, в зависимости от условий реакции, может отдавать и принимать электроны. Наиболее характерны для нее восстановительные свойства, в особенности при взаимодействии с сильным окислителем, каковым является КМnO4.
Кислород (O -11 ), находящийся в соединении SO 2 3 — , казалось бы, может проявлять восстановительные свойства.
Однако свободный кислород является относительно сильным окислителем, и если он принял электроны, то отдает их с большим трудом в особых условиях и только весьма сильным окислителям.
Радиус иона кислорода (1,32 Å) меньше, чем у ионов серы (1,74 Å), селена (1,91 А) и теллура (2,11 Å). Следовательно, в нашем случае в присутствии более сильного восстановителя S(+IV) двухвалентный кислород не может быть восстановителем.
В молекуле КМnO4 ион калия (К + ) аналогично иону натрия в соединении Na2SO3 восстановительных свойств проявлять не может. Является он и очень слабым окислителем.
Напротив, семивалентный марганец в ионе МnО4 — является очень сильным окислителем и в зависимости от условий реакции, как было показано выше, может принимать различное число электронов, восстанавливаясь до двух-, четырех- и шестивалентного состояния.
Проявлять восстановительные свойства Мn(+VII)(МnO4 — ), конечно, не может, так как он находится в максимально валентном состоянии, выше которого не бывает.
Двухвалентный кислород, в соединении МnО4 — , аналогично кислороду, находящемуся в соединении SO 2 3 — , не может быть в нашем .случае восстановителем.
Серная кислота в реакции участвует разбавленная (в качестве среды), а потому окислительно-восстановительных свойств проявлять не может.
На основании вышеизложенных рассуждений, которые можно было бы при необходимости подтвердить при помощи количественной характеристики окислительно -восстанови тельных реакций, делаем заключение: в молекуле Na2SO3 ион SO 2 3 — — восстановитель, он отдает 2 электрона и переходит в ион SO 2 4 — ; в молекуле КМnO4 ион МnО4 — — окислитель, он в кислой среде принимает 5 электронов и переходит в ион Мn 2+ .
Поставим под восстановителем число 2, а под окислителем — число 5.
Находим коэффициенты для восстановителя и окислителя. Для этого число 2, стоящее под восстановителем, поставим перед окислителем, а число 5, стоящее под окислителем, поставим перед восстановителем:
При нахождении коэффициентов по этой схеме необходимо помнить, что в действительности в растворе мы имеем ионы SO3 и МnO4 — , а не S(+IV) и Мn(+VII).
3) Напишем в правой части уравнения формулы образующихся соединений, имея в виду, что ионы металлов с кислотными остатками образуют соли, а кислород с водородом — молекулы воды:
4) По числу кислотных остатков в правой части уравнения находим коэффициент для кислоты. В результате реакции получается 8 кислотных остатков SO 2 4 — , из них 5SO 2 4 — — за счет окислительно-восстановительного процесса (превращения 5SO 2 3 — → 5SO 2 4 — ), a 3SO 2 4 — —за счет молекул серной кислоты (8SO 2 4 — — 5SO 2 4 — = 3SO 2 4 — ). Таким образом, серной кислоты необходимо взять 3 молекулы:
5) По числу ионов водорода (6Н + ) в левой части уравнения находим коэффициент для воды. Уравнение примет окончательный вид:
Признаком правильности подбора коэффициентов является одинаковое количество атомов каждого элемента в обеих частях уравнения.
Разумеется, и в данном случае нет необходимости переписывать реакцию несколько раз, и все вышеуказанные операции следует производить с одним и тем же уравнением (в уме).
Составим уравнение реакции окисления сульфида свинца азотной кислотой. Азотная кислота, особенно концентрированная, является довольно сильным окислителем.
Сущность окисления различных веществ азотной кислотой состоит в том, что пятивалентный азот, входящий в состав аниона NO3 — может в зависимости от условий (концентрация кислоты, природа восстановителя, температура) принимать от 1 до 8 электронов.
Восстановление аниона NO3 — в различных условиях можно выразить следующими ионными уравнениями:
Металлы, расположенные в таблице окислительно-восстановительных потенциалов ниже водорода, окисляются азотной кислотой, причем разбавленная HNO3 восстанавливается до NO, а концентрированная — до NO2.
Такие энергичные металлы, как цинк, кальций и др., восстанавливают HNO3 до N2O. Теми же металлами весьма разбавленная азотная кислота восстанавливается с образованием аммонийных солей.
Железо, никель, кобальт и другие металлы, обладающие средней активностью, восстанавливают сильно разбавленную HNO3 до NO и даже (кобальт) до N2.
Золото, платину, иридий, родий, ниобий, тантал, вольфрам и другие аналогичные им металлы азотная кислота не окисляет.
Неметаллы (большинство) восстанавливают HNO3 до NO, Чтобы восстановление азотной кислоты шло как можно дальше, необходимо брать наиболее разбавленную кислоту, применять сильный восстановитель и реакцию вести на холоду.
Чем азотная кислота концентрированнее, а восстановитель слабее, тем азотная кислота восстанавливается меньше. Это объясняется тем, что концентрированная HNO3 окисляет образующиеся в ходе реакции низшие окислы азота в высшие.
Так, например, NO окисляется концентрированной HNO3 до NO2; NO2, реагируя с водой, дает NO и HNO3:
Ознакомившись с окислительными свойствами HNO3, возвратимся к рассмотрению уравнений реакций окисления PbS разбавленной и концентрированной HNO3.
Составим уравнение реакции окисления PbS разбавленной HNO3 при нагревании.
1) Напишем формулы исходных веществ:
2) Выясним их окислительно-восстановительные свойства и найдем необходимые коэффициенты для окислителя и восстановителя.
В молекуле PbS свинец (Рb +II ) в зависимости от условий реакции может проявлять, с одной стороны, окислительные свойства, правда, очень слабые, поскольку он находится в низшей валентности, а не в высшей; с другой стороны, он может отдавать еще 2 электрона и превращаться в четырехвалентный.
Но двухвалентный свинец может отдавать еще два электро-,на только в особых условиях, и для их отрыва требуется большая затрата энергии.
Напротив, двухвалентная сера (S -II ) содержит избыточные электроны и легко их отдает даже сравнительно слабому окислителю (не говоря уже про HNO3).
Поэтому двухвалентный свинец в нашем случае восстановителем не является.
Забегая несколько вперед, можно сказать следующее. Нормальный окислительно — восстановительный потенциал
Рb(2+)|Рb(+IV)равен + 1,69 в, или E0= + 1,69 в (прил. 6), нормальный окислительно-восстановительный потенциал S 2- |S равен + 0,141 в, или E0= + 0,141 в, т. е. первый потенциал в несколько раз больше второго. Нормальный окислительный потенциал NO3 — |NO равен +0,96 в, или Е0= + 0,96 в.
Окислительно-восстановительная реакция может протекать в выбранном нами направлении при условии, что электродвижущая сила (э. д. с.) ее является положительной величиной.
Если мы вычислим электродвижущую силу реакции, допустив, что восстановителем является двухвалентный свинец, а окислителем — NO3 — , то найдем, что она является отрицательной величиной:
э. д. с.= +0,96 — (+ 1,68) = -0,78 в.
Отрицательная величина электродвижущей силы реакции говорит нам о том, что азотная кислота не может окислить двухвалентный свинец в четырехвалентный.
Напротив, если восстановителем является двухвалентная сера (S 2- ), электродвижущая сила реакции положительна:
э. д. с. =+0,96 — (+0,141) = + 0,719 в.
Таким образом, двухвалентная сера S -II в разбавленной азотной кислоте отдает 2 электрона и превращается в электронейтральный атом S.
Ион NO3 — (в молекуле HNO3) принимает 3 электрона и переходит в NO. Коэффициентами здесь являются число 2 и 3. Отсюда:
3) Напишем в правой части уравнения формулы образующихся веществ:
4) По числу кислотных остатков (NO3 — ) в правой части уравнения находим необходимое количество молекул HNO3, которые требуются дополнительно на связывание образующихся в результате реакции продуктов (в нашем случае 3 иона Рb 2+ ).
Кроме того, 2 молекулы HNO3 пошли на окисление 3S -II ; всего расходуется 8 молекул HNO3:
5) По числу ионов водорода (8Н + ) в левой части уравнения находим коэффициент для воды.
Таким образом, уравнение принимает вид:
В этом уравнении формула HNO3 записана два раза лишь для того, чтобы показать, что 2 молекулы HNO3 необходимы для окисления, а 6 молекул выполняют роль среды.
Окончательно это уравнение может быть записано в обычном виде:
Окисление PbS концентрированной HNO3 при нагревании:
Сера (S -II ) в концентрированной азотной кислоте отдает 8 электронов и переходит в ион SO 2 4 — . Ион NO3 — принимает 1 электрон и превращается в NO2.
Окончательное уравнение записывается следующим образом:
Составим уравнение реакции окисления сернокислого железа марганцовокислым калием в кислой среде:
В молекуле FeSO4 железо является двухвалентным. В окислительно-восстановительной реакции оно может перейти в трехвалентное состояние, а последнее в некоторых случаях (как мы увидим несколько ниже) даже способно превращаться в шестивалентное.
Следовательно, двухвалентное железо (Fe 2+ ) в нашем случае может проявлять восстановительные свойства. Шестивалентная сера в ионе SO 2 4 — к дальнейшему повышению валентности не способна, т. е. не может проявлять восстановительных свойств.
Не может быть она и окислителем, несмотря на то, что является максимально валентной. Действительно, окислительные свойства шестивалентная сера в ионе SO 2 4 — проявляет обычно при условии, если в реакции участвует концентрированная серная кислота.
Врассматриваемом же нами случае для создания кислой среды используется разбавленная серная кислота, и,следовательно,шестивалентная сера (в ионе SO 2 4 — ) окислительных свойств проявлять не может. Кислород в ионе SO 2 4 — (по причинам, ранее указанным) не может быть восстановителем.
Таким образом в данной реакции ион Fe 2+ (в молекуле FeSO4) служит восстановителем; он отдает 1 электрон и переходит в ион Fe 3+ . Ион МnО4 — (в молекуле КМnO4) является окислителем; он принимает 5 электронов и переходит в ион Мn 2+ .
По общепринятому правилу, казалось бы, под восстановителем нужно поставить число 1, под окислителем 5 и найти обычным путем коэффициенты для восстановителя и окислителя.
Но в данном случае ионы Fe 3+ , соединяясь с ионами SO 2 4 — , образуют молекулы Fe2(SO4)3 — ионов Fe 3+ получается четное число; поэтому коэффициенты у восстановителя и окислителя нужно удвоить.
Ставим перед восстановителем число 10, а перед окислителем 2. Уравнение принимает окончательный вид:
Напишем уравнение реакции, в котором галоген, являясь окислителем, восстанавливается до отрицательно заряженного иона, например:
Так как в данном случае восстановитель отдает такое же число электронов (2), сколько их принимает окислитель (2), то коэффициенты у восстановителя и окислителя не пишем.
Если восстановителем является отрицательно заряженный ион галогена, а окислителем — тот же галоген в сложном ионе, то и тот, и другой переходят в нейтральные атомы, которые затем связываются в молекулы, например:
Ознакомившись с тем, как составляются уравнения окислительно-восстановительных реакций в молекулярной форме, рассмотрим составление ионных уравнений для подобных реакций.
В качестве примера составим в ионной форме уравнение реакции окисления хлористого олова двухромовокислым калием в кислой среде.
1) В левой части уравнения должны находиться исходные ионы, изменяющие свою валентность, и ион Н + , показывающий, что реакция протекает в кислой среде:
2) Ион Sn 2+ является здесь восстановителем; он отдает 2 электрона и переходит в ион Sn 4+ , Ион Cr2O 2 7 — является окислителем; он принимает 6 электронов и превращается в два иона трехвалентного хрома (2Сr 3+ ).
Коэффициентами должны были быть числа 2 и б, но так как они кратны между собой, то их можно для упрощения разделить на 2. Таким образом, перед окислителем следует поставить не два, а единицу, перед восстановителем не шесть, а три.
Это означает, что для восстановления одного иона Cr2O 2 7 — расходуется точно 3 иона Sn 2+ :
3) После этого запишем в правой части уравнения образующиеся в процессе реакции ионы и молекулы:
3Sn 2+ + Cr2O 2 7 — + Н + → 3Sn 4+ + 2Сr 3+ + 7Н2O.
4) Зная число атомов кислорода в левой части уравнения и учитывая, что совместно с ионами водорода кислоты они образуют молекулы воды, находим коэффициент для ионов Н:
3Sn 2+ + Cr2O 2 7 — + 14Н+ → 3Sn 4+ + 2Сr 3+ + 7Н2O.
То же уравнение в молекулярной форме может иметь следующий вид:
Легко видеть, что ионы Cl — , К + , SO 2 4 — , в процессе реакции не изменяющие свою валентность, могут быть заменены другими аналогичными ионами.
Реакции в щелочной среде
Составим уравнение реакции сульфита натрия с перманганатом калия в сильнощелочной среде при недостатке восстановителя, соблюдая последовательность, аналогичную разобранным выше примерам в кислой среде.
1) Напишем в левой части уравнения формулы исходных веществ:
2) Определим восстановитель и окислитель и необходимые коэффициенты для них. При рассмотрении реакций в кислой среде мы уже выяснили окислительно-восстановительные свойства сернисто-кислого натрия и марганцовокислого калия (в кислой среде).
В данной реакции участвуют те же исходные вещества (Na2SO3 и КМnO4), но только в сильно концентрированной щелочной среде. В связи с этим участвующие в реакции вещества проявляют несколько иные окислительно-восстановительные свойства.
В молекуле Na2SO3 ион SO 2 3 — является восстановителем, как и в кислой среде; он отдает 2 электрона и переходит в ион SO 2 4 — . В молекуле КМnO4 ион МnО4 — является окислителем; в сильно концентрированной щелочной среде и при недостатке восстановителя он принимает лишь 1 электрон и восстанавливается до МnО 2 4 — .
Ставим под восстановителем число 2, а под окислителем 1. Затем находим коэффициенты для восстановителя и окислителя.
Для этого число 2, находящееся под восстановителем, ставим перед окислителем, а число 1, находящееся под окислителем, ставим перед восстановителем. Следовательно, на 1 молекулу Na2SO3 требуется 2 молекулы КМnO4.
Таким образом, левая часть уравнения принимает следующий вид:
3) Напишем в правой части уравнения формулы получающихся соединений:
4) Находим коэффициент для щелочи. Для этого подсчитываем в правой и левой частях уравнения число ионов металла, не изменивших своей зарядности, и по разности находим коэффициент.
В правой части уравнения имеется 4К + , а в левой 2К + , по разности (4 — 2 = 2) находим коэффициент для щелочи:
5) Проверяем число ионов водорода в левой и правой частях уравнения и находим число образовавшихся молекул воды.
Приводим еще уравнения реакций окисления-восстановления с участием щелочи:
Составим в ионной форме уравнение реакции окисления хромисто-кислого натрия бромом в щелочной среде.
1) Пишем левую часть уравнения:
2) Ион СrO2 — является восстановителем; он отдает 3 электрона и переходит в щелочной среде в ион СrO 2 4 — Молекула Вr2 является окислителем; она принимает 2 электрона и превращается в два иона брома (2Вr — ).
Поставим под восстановителем 3, под окислителем 2 и найдем необходимые коэффициенты для восстановителя и окислителя:
3) Запишем в левой части уравнения исходные вещества с найденными коэффициентами, а в правой— oбразующиеся продукты:
4) По числу кислородов, находящихся в двух ионах СrO 2 4 — , находим число кислорода, которое необходимо взять из гидроксильных групп (4OН — ).
Кроме того, следует учесть, что освобождающиеся при этом ионы водорода (4Н + ) связываются также ионами гидроксила (4OН — ), образуя 4 молекулы воды. Всего, таким образом, потребуется восемь гидроксильных групп:
Приведенное уравнение в молекулярной форме имеет, например, следующий вид:
Реакции в нейтральной среде
Составим уравнение реакции сульфита натрия с перманганатом калия в нейтральной среде, придерживаясь ранее принятой последовательности.
1) Напишем формулы исходных веществ:
2) Определим восстановитель и окислитель и необходимые коэффициенты для них.
Окислительно-восстановительные свойства Na2SO3 остаются теми же, что в кислой и щелочной среде; наоборот, окислительно-восстановительные свойства марганцовокислого калия в нейтральной среде резко изменяются (по сравнению с кислой или щелочной средой), а именно: ион МnО4 — восстанавливается до четырехвалентного.
В результате ион SO 2 3 — молекулы Na2SO3 является восстановителем; он отдает 2 электрона и переходит в ион SO 2 4 — .
В молекуле КМnO4 ион МnО4 — является окислителем: он в нейтральной (или слабощелочной) среде принимает 3 электрона и восстанавливается до МnO2. Ставим под восстановителем число 2, под окислителем — 3.
Находим коэффициенты, для чего число 2, находящееся под восстановителем, ставим перед окислителем, а число 3, находящееся под окислителем, ставим перед восстановителем. В данном случае на 3 молекулы Na2SO3 требуется 2 молекулы КМnO4.
Левая часть уравнения принимает вид:
3) Напишем в правой части уравнения формулы получающихся соединений, имея в виду, что ионы металла натрия с кислотным остатком SO 2 4 — образуют соль Na2SO4, Mn +IV c кислородом (О -II ) образуют МnO2, а ион гидроксила с ионом калия образует едкое кали.
Отметим, что 1 ион гидроксила (ОН — ) образуется за счет освобождающегося кислорода (из КМnO4) и иона водорода воды, а второй — из воды.
Так как в реакции требуется только одна молекула воды, то коэффициент для воды равняется единице.
Окончательное уравнение принимает следующий вид:
Ниже приводятся еще несколько законченных уравнений окислительно-восстановительных реакций, протекающих в нейтральной среде с участием молекул воды:
В качестве примера окислительно-восстановительной реакции, протекающей в нейтральной среде без участия молекул воды, укажем на уравнение следующей реакции:
2Аl + 3СuСl2 = 3Сu + 2АlСl3. Наконец составим в ионной форме уравнение реакции окисления иона SO 2 3 — ионом Со 3+ в нейтральной среде.
1) Напишем в левой части уравнения исходные вещества:
2) Ион SO 2 3 — является восстановителем; отдает 2 электрона и переходит в ион SO 2 4 — . Ион Со 3+ принимает 1 электрон и превращается в ион Со 2+ .
Поставим под восстановителем число 2, под окислителем 1 и найдем коэффициенты для восстановителя и окислителя:
3) Запишем в левой части уравнения исходные вещества с найденными коэффициентами, а в правой — образующиеся продукты:
SO 2 3 — + 2Со 3+ + Н2O → SO 2 4 — + 2Со 2+ + 2Н + .
Кроме среды, важными факторами, влияющими на направление и скорость окислительно-восстановительных процессов, являются также концентрация реагирующих веществ, температура и катализатор.
Общая схема для любого окислительно-восстановительного процесса может быть представлена следующим образом:
Константа равновесия для приведенного процесса принимает следующее выражение:
Пользуясь приведенным уравнением, легко предвидеть смещение равновесия окислительно-восстановительной реакции в зависимости от концентрации реагирующих веществ.
Так, например, при увеличении концентрации окислителя или восстановителя равновесие будет смещаться слева направо, при увеличении же восстановленной или окисленной формы вещества равновесие будет смещаться в обратную сторону, т. е. справа налево.
Повышение температуры влечет за собой увеличение скорости окислительно-восстановительной реакции.
Так, например, равновесие реакции восстановления углекислого газа углем при повышении температуры сдвигается слева направо:
Наконец, температура может изменить не только скорость или положение равновесия той или иной окислительно-восстановительной реакции, но и самый характер ее.
Например, КМnО4 при достаточно высокой температуре распадается по уравнению:
Участвуя в окислительно-восстановительных реакциях при высокой температуре, КМnО4 будет не только в зависимости от среды расходоваться в том или ином количестве на окисление восстановителя, но и разрушаться, согласно проведенному уравнению.
В результате, помимо основного процесса, будет протекать целый ряд побочных реакций.
Другим примером, иллюстрирующим то же самое положение, может служить щавелевая кислота, также разлагающаяся при высокой температуре:
Теллур со щелочью, в зависимости от температуры, реагирует следующим образом:
На скорость окислительно-восстановительных реакций, кроме указанных факторов, влияет также катализатор.
Наиболее известны положительные катализаторы, т. е. ускоряющие течение реакций. Менее известны отрицательные катализаторы, замедляющие химические процессы.
Рассмотрим некоторые окислительно-восстановительные процессы, протекающие в присутствии катализатора.
Окисление щавелевой кислоты перманганатом калия значительно ускоряется в присутствии ионов Мn 2+ как катализатора. Образовавшиеся при этой реакции ионы Мn 2+ затем сами являются катализатором.
Химический процесс, в котором роль катализатора выполняет одно из исходных или образующихся в результате реакции вещество, называется автокатализом.
В лабораторных условиях кислород обычно получают из бертолетовой соли, которая в присутствии МnО2 как катализатора разлагается значительно быстрее.
Наблюдается также и ускорение разложения КМnО4 в присутствии МnО2.
В зависимости от катализатора два соединения, реагирующие между собой, могут образовать различные вещества:
В первой реакции катализатором являются ионы йода, а во второй — молибденовая кислота.
Примером отрицательных катализаторов могут служить спирт и глицерин, наличие которых в растворе сульфита натрия (Na2SО3) замедляет окисление Na2SО3 в Na2SО4 кислородом воздуха.
Еще одним примером отрицательного катализатора являются следы кислорода, замедляющие взаимодействие хлора с водородом под действием света.
Ускоряющее действие на окислительно-восстановительные процессы, помимо катализатора, оказывают и параллельно идущие реакции.
В тех случаях, когда одна окислительно-восстановительная реакция ускоряет другую, говорят о сопряженных, или индуцированных, реакциях (Н. А. Шилов, 1904).
Многие окислительно-восстановительные реакции являются сопря женными. Например, медленно протекающая реакция окисления иона хлора перманганатом:
5Сl — + МnО4 — + 8Н+ → 5Сl + Мn 2+ + 4Н2О
ускоряется одновременно идущей реакцией окисления двухвалентного иона железа перманганатом:
5Fe 2+ + МnО4 — + 8Н + → 5Fe 3+ + Мn 2+ + 4Н2О.
Аналогично, также сопряженно, протекает реакция окисления мышьяковистой кислоты H3AsO3 кислородом воздуха в присутствии сернистой кислоты H2SO3. Сернистая кислота окисляется кислородом воздуха, а мышьяковистая не окисляется.
Однако при совместном присутствии окисляются обе кислоты.
Особые случаи составления уравнений окислительно-восстановительных реакций
Рассмотренная выше методика составления уравнений окислительно-восстановительных реакций применима к огромному большинству простейших и сложных процессов.
Однако для того, чтобы более быстро составлять уравнения окислительно-восстановительных реакций, следует иметь в виду некоторые особые случаи.
Первый случай
Если в реакции число электронов, теряемых восстановителем, и число электронов, принимаемых окислителем, являются четными числами, то при нахождении коэффициентов число электронов делят на наибольший общий делитель.
Так, например, в реакции
коэффициентами у восстановителя и окислителя будут не 6 и 2, а 3 и 1.
Если же число электронов, теряемых восстановителем и приобретаемых окислителем, нечетное, а в результате реакции должно получиться четное число атомов, то коэффициенты удваиваются.
Например, в реакции
коэффициентами у окислителя и восстановителя будут не 1 и 5, а 2 и 10.
Второй случай
Иногда восстановитель или окислитель расходуется дополнительно на связывание образующихся в результате реакции продуктов.
1) 10НСl + 2KMnО4 + 6НСl = 5Сl2 + 2КСl + 2МnСl2 + 8Н2О.
В этой реакции 10 молекул НСl реагируют как восстановитель, а 6 молекул НСl расходуются на связывание получающихся веществ.
Здесь на 3 атома Сu-восстановителя необходимо 2 молекулы НNО3-окислителя; кроме того, на образование нитрата меди и воды требуется еще 6 молекул HNО3.
Третий случай
Окисляются одновременно и положительные и отрицательные ионы молекулы восстановителя.
В качестве примера рассмотрим окисление трехсернистого мышьяка концентрированной азотной кислотой. Разберем составление этого уравнения подробно.
1) Напишем формулы исходных веществ:
2) Определим: восстановитель и окислитель и необходимые коэффициенты:
3) Выпишем в правую часть уравнения формулы веществ, образующихся в результате реакции:
4) Произведем проверку числа атомов каждого элемента в исходных и полученных соединениях и расставим соответствующие коэффициенты:
5) Проверяя количество атомов кислорода или водорода (или любого элемента) в левой и правой частях уравнения, убеждаемся в том, что оно написано правильно.
Четвертый случай
Восстановителем и окислителем являются различные атомы одного и того же элемента, но входящие в состав разных веществ.
Примером может служить реакция между йодистым и йодноватокислым калием, протекающая в кислой среде:
Пятый случай
Иногда уравнение реакции окисления-восстановления обычным путем составить нельзя. В этом случае находятся индивидуальные способы решения, на основе тех же, уже рассмотренных нами, принципов. Например, в реакции:
восстановителем является Аl, он отдает 3ē; окислителем является железо (в Fe3O4). Но молекулу Fe3O4 следует рассматривать как FeO•Fe2O3, в которой FeO принимает 2ē, а Fe2O3 принимает 6ē , всего, следовательно, Fe3O4 приобретает 8 электронов.
Коэффициент при восстановителе здесь будет 8, а при окислителе 3. Таким образом, окончательное уравнение принимает следующий вид:
Реакция горения черного пороха в основном протекает по следующему уравнению:
В данной реакции восстановителем является атом углерода; он отдает 4ē и окисляется до СO2; окислителем является пятивалентный азот в соединении KNO3, который, восстанавливаясь до N2, принимает 5X2 = 10ē.
Но в этой реакции нейтральная сера также принимает 2ē.
В итоге окислитель принимает 12 электронов (10 + 2= 12). Согласно основному правилу составления уравнений окислительно-восстановительных реакций, общее число электронов, отданных восстановителем, должно быть равно общему числу электронов, принятых окислителем. Число теряемых электронов в нашем случае также равно 12(4X3 = 12).
Таким образом, коэффициент при восстановителе (углероде) будет «три», а при окислителе (KNO3) «два».
Окончательно уравнение принимает вид:
Шестой случай
Сильнейшим окислителем является аллотропическое видоизменение кислорода — озон.
Ниже приводим уравнения реакций с участием озона.
в реакции ионы 2Вr — являются восстановителем. Они отдают 2 электрона (каждый по одному) и переходят в нейтральную молекулу Вr2.
Молекула O3 принимает 2 электрона, превращаясь в O -II и O2.
При взаимодействии аммиака с озоном в зависимости от условий реакции могут быть получены и другие вещества (NH4NO2, NH4NO3 и т. д.).
Седьмой случай
Восстановителем или окислителем являются комплексные соединения. При этом может произойти:
1) изменение зарядности иона комплексообразователя;
2) разрушение комплекса с образованием простых веществ;
3) выделение комплексообразователя в виде нейтрального атома.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Составление уравнений реакций самоокисления-самовосстановления
В реакциях данного типа участвуют молекулы, атомы или ионы одного и того же вещества, способные проявлять и окислительные,и восстановительные свойства.
Правила составления уравнений этих реакций остаются неизменными.
В приведенных ниже примерах нижние цифры обозначают число электронов, отдаваемых и получаемых восстановителем и окислителем:
3) NaOCl + 2NaOCl=NaClO3 + 2NaCl.
Видео:Как выглядит самая сложная задача математики? Фрактал КоллатцаСкачать

Составление уравнений реакций внутримолекулярного окисления-восстановления
К процессам внутримолекулярного окисления-восстановления относятся реакции, при которых переход электронов происходит внутри одной и той же молекулы.
Сюда относятся некоторые простейшие реакции термической диссоциации, например:
К этому же типу принадлежат и некоторые реакции, про-текащие в растворах, например:
Видео:Уравнение, которое меняет взгляд на мир [Veritasium]Скачать
![Уравнение, которое меняет взгляд на мир [Veritasium]](https://i.ytimg.com/vi/DH1cv0Rdf2w/0.jpg)
Составление уравнений реакций окисления металлов кислотами и щелочами
Взаимодействие металла с кислотой сопровождается переходом металла в состояние иона —это есть реакция окисления металла ионами кислоты.
Так, например, Zn, взаимодействуя с соляной кислотой, отдает 2 электрона ионам водорода и переходит в ион Zn 2+ :
Из приложения 6 видно, что не выделяют водорода из кислот, т. е. не окисляются ионом водорода, только те атомы, которые стоят в ряду напряжений ниже пары Н2/2Н + . Такими являются атомы элементов:
Au, Ag, Hg, Сu, As, Sb, Bi, Ru, Rh, Os, Pt и др. Ионы этих элементов окисляют Н2 в 2Н + . Например:
Все атомы, стоящие выше пары Н2/2Н + , выделяют из кислот водород (т. е. окисляются ионами водорода кислоты). При этом интенсивность реакции тем больше, чем выше в таблице или в ряду напряжений стоит металл.
Если металл не окисляется ионом водорода кислоты, то он может взаимодействовать только с такими кислотами, которые содержат ион, являющийся более сильным окислителем.
К таким кислотам относятся азотная (концентрированная и разбавленная), серная (концентрированная), хлорноватистая и некоторые другие.
Так, например Ag взаимодействует с концентрированной азотной кислотой, потому что в HNO3 ион NO3 — обладает окислительными свойствами:
Золото и с HNO3 не взаимодействует, но окисляется царской водкой (смесью трех объемов концентрированной соляной кислоты и одного объема концентрированной азотной кислоты) по следующему суммарному уравнению:
Уравнение реакции окисления золота царской водкой может быть написано по стадиям:
1) взаимодействие соляной и азотной кислот с образованием атомарного хлора, хлористого нитрозила и воды:
2НС l + HNO3 + НС l = 2C l + NOC l + 2Н2O;
2) окисление золота полученными веществами (по первой реакции):
Au + 2С l + NOC l = AuC l 3 + NO;
3) в зависимости от соотношения концентраций соляной и азотной кислот возможно образование золотохлористоводородной кислоты и нитрозо-соли:
AuC l 3 + НС l = Н [AuC l4] , AuC l 3 + NOC l = (NO) [AuC l4]
Следует иметь в виду, что металлы, обычно не выделяющие из кислот водорода, в известных условиях (образуя труднорастворимые соединения или комплексы) могут взаимодействовать с ними.
Например, медь, не выделяющая водорода из большинства кислот, реагирует с H2S, выделяя водород и образуя труднорастворимую соль —сульфид меди:
Металлы, стоящие в ряду напряжений левее водорода, теоретически должны вытеснять его не только из кислот, но и из воды.
Но вследствие очень малой концентрации ионов водорода (Н + ), образующихся при диссоциации воды, только наиболее активные металлы реагируют с водой, например:
Металлы 2-ой группы Са, Sr, Ва ионами водорода холодной водой окисляются медленно, но горячей — довольно энергично с образованием водорода и сильного основания.
Уравнение реакции растворения цинка в щелочи нередко выражают так:
В действительности реакция протекает иначе. Металли ческий цинк практически не реагирует с водой вследствие образования на его поверхности гидроокиси цинка, препятствующей дальнейшему его окислению.
Однако в присутствии щелочи Zn(OH)2 растворяется, и цинк начинает выделять водород из воды.
Поэтому химизм растворения (вернее, окисления) цинка в щелочах правильнее выражать уравнениями:
Растворение алюминия в сильных щелочах обычно выражают при помощи одного из следующих уравнений:
Гидроокиси олова и свинца, имеющие также амфотерный характер, растворяются в щелочах. Но сами металлы Sn и Рb практически нерастворимы в щелочах, так как они являются сравнительно малоактивными металлами.
В ряду напряжений они стоят непосредственно перед водородом. Эти металлы очень медленно реагируют с разбавленными кислотами и практически не реагируют с водой, в которой концентрация ионов водорода еще меньше, чем даже в разбавленных кислотах.
Видео:Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

Окислительно-восстановительные эквиваленты
Эквивалентом называется весовое количество элемента, которое соединяется с восемью весовыми частями кислорода или с одной весовой частью водорода (точнее 1,008) или замещает их в соединениях.
Эквивалент элементов, образующих одновалентные ионы, равен атомному весу этих элементов. Элементы, обладающие различной валентностью, соответственно этому имеют и несколько эквивалентов.
Так, например, эквивалент S(IV) равен 32: 4 = 8, эквивалент S(VI) равен 32 : 6 = 5,3, а эквивалент S(2-) равен 32:2 = 16.
Между атомным весом (A), эквивалентом (Э) и валентностью (В) существуют следующие соотношения:
Грамм-эквивалентом элемента называется количество вещества (выраженное в граммах), численно равное эквивалентному весу данного элемента.
Например, эквивалент двухвалентного железа равен 56:2 = 28; грамм-эквивалент его равен 28 г.
Эквивалент соли, кислоты или основания равен сумме эквивалентов положительно и отрицательно валентных частей молекулы этих соединений.
Так, например, эквивалент сернокислого алюминия равен сумме эквивалентов алюминия (27:3 = 9) и кислотного остатка SO 2 4 — (96:2 = 48), т. е. 9 + 48 = 57.
Для расчета эквивалентного веса соли, кислоты или основания необходимо молекулярный вес данного вещества разделить на общее количество единиц валентности положительно или отрицательно валентной части молекулы.
Для нахождения окислительно-восстановительных грамм-эквивалентов необходимо грамм-молекулярный вес соединения разделить на число электронов, теряемых или приобретаемых восстановителем или окислителем (учитывая при этом среду).
Например, перманганат калия КМnO4 в присутствии восстановителя в кислом растворе принимает 5 электронов и восстанавливается до Мn 2+ . Его окислительно-восстановительный грамм-эквивалент в кислой среде равен:
Семивалентный марганец, входящий в КМnO4, в концентрированном щелочном растворе принимает 1 электрон и восстанавливается до щестивалентного.
Поэтому в концентрированном щелочном растворе окислительно-восстановительный грамм-эквивалент равен:
KmnO4/1 = 158,15/1 = 158,15
В нейтральном и слабощелочном растворе семивалентный марганец (в соединении КМnO4) принимает 3 электрона и восстанавливается до четырехвалентного. Окислительно-восстановительный грамм-эквивалент КМnO4 в данном случае равен:
KmnO4/3 = 158,15/3 = 52,72г.
Грамм-эквивалент хромовокислого калия: K2CrO4/3 = 194,20/3 = 64,73 г.
Грамм-эквивалент бромата калия:
KBrO3/6 = 167,02/6 = 27,84 г.
Грамм-эквивалент йодида калия в кислой среде:
KJ/6 = 166,02/6 = 27,67 г.
При окислении тиосульфата натрия Na2S2O3•5H2O йодом в слабо-кислой или нейтральной среде 2 молекулы N2S2O3, или 2S2О 2 3 — отдают 2 электрона молекуле J2, а 1 молекула Na2S2О3, или S2О 2 3 — , отдает 1 электрон. Поэтому величина грамм-эквивалента тиосульфата натрия здесь равна величине его грамм-молекулы:
Тот же тиосульфат натрия, окисляясь бромом, теряет 8 электронов —грамм-эквивалентный вес его в этой реакции равен:
При реакции двойной соли сульфата двухвалентного железа и сульфата аммония — FeSО4•(NH4)SО4•6H2О (соли Мора) с перманганатом калия ион Fe 2+ теряет 1 электрон — грамм-эквивалент двойной соли здесь равен ее грамм-молекуле:
Из приведенных примеров ясно, как нужно вычислять окислительно-восстановительные эквиваленты. В большинстве случаев для этого даже нет необходимости составлять полные уравнения реакций — достаточно знать, сколько электронов в данной реакции теряет восстановитель или принимает окислитель.
Следует заметить, что одно и то же вещество может участвовать в реакциях как обменных, так и окислительно-восстановительных.
Похожие страницы:
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
Видео:Самое сложное задание тестовой части ЕГЭ по Химии! А может и нет? ❤️Скачать

Профессор Знаев
ОСНОВНОЕ МЕНЮ
НАЧАЛЬНАЯ ШКОЛА
РУССКИЙ ЯЗЫК
ЛИТЕРАТУРА
АНГЛИЙСКИЙ ЯЗЫК
НЕМЕЦКИЙ ЯЗЫК
ИСТОРИЯ
БИОЛОГИЯ
ГЕОГРАФИЯ
МАТЕМАТИКА
ИНФОРМАТИКА
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Самая длинная реакция

Среди побед, которыми могут похвастаться химики-органики, величайшая — это, бесспорно, синтез молекулы белка. Притом белка первостепенной важности.
Речь идет о химическом синтезе инсулина — гормона, управляющего обменом углеводов в организме.
Даже специалистам-химикам еще неясны некоторые детали строения этой белковой молекулы. Инсулин — это поистине молекула-гигант, хотя число входящих в нее элементов очень ограниченно. Но они располагаются в ней в самых причудливых сочетаниях.
А потому для простоты примем, что молекула инсулина состоит из двух частей, двух цепочек — цепи А и цепи В. И связаны друг с другом эти цепи так называемой дисульфидной связью. Иначе говоря, между ними как бы перекинут мостик, состоящий из двух атомов серы.
План генерального наступления на инсулин был следующим. Отдельно синтезировать цепи А и В. Затем соединить их, да так, чтобы между ними обязательно протянулся дисульфидный мостик.
Теперь немного арифметики. Чтобы получить цепь А, химикам понадобилось провести около сотни различных последовательных реакций. Построение цепи В потребовало больше ста. И ушло на это много месяцев кропотливейшего, труда.
Но вот обе цепи, наконец, получены. Надо их связать. Именно здесь и встретились основные трудности. Не раз постигали исследователей жестокие разочарования. И все же в один прекрасный вечер в лабораторном дневнике появилась лаконичная запись: «Молекула инсулина полностью синтезирована».
Двести двадцать три последовательных этапа потребовалось ученым, чтобы искусственно получить инсулин. Вдумайтесь только в эту цифру: до сих пор еще ни одно из известных химических соединений не было приготовлено с таким трудом. Десять человек не покладая рук работали около трех лет…
Биохимики же сообщают весьма любопытную вещь: в живой клетке белок синтезируется всего за… 2–3 секунды.
Три года — и три секунды! Насколько все-таки синтетический аппарат живой клетки совершеннее современной химии!
🔥 Видео
Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

САМОЕ СЛОЖНОЕ В ХИМИИ ЗА 5 СЕКУНД #shorts #youtubeshorts #химияСкачать

Окислительно-восстановительные реакции с нуля!| Екатерина Строганова | 100балльный репетиторСкачать

Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

ХИМИЧЕСКИЕ УРАВНЕНИЯ | Как составлять уравнения реакций | Химия 8 классСкачать