В начале нашего столетия был синтезирован глицерид мелиссиновой кислоты из химического класса жиров с общей формулой С96Н188О6. Для записи химической формулы этого глицерида, оказавшейся самой длинной в то время, требуется написать 290 символов атомов в разной связи друг с другом. До начала первой мировой войны в химической лаборатории впервые был получен другой глицерид смешанных фосфорной и стеариновой кислот. Молекула этого вещества была сформирована уже из 596 атомов и в общем виде выражена через С195Н375О25Р.
Как только затихли артиллерийские залпы на фронтах и исследователи вернулись к мирным научным занятиям, сразу же было открыто новое химическое соединение, молекула которого состояла из 913 атомов. Это ундекацеротат робинозы с брутто-формулой С304Н582О27.
Уже в золотую эру органического синтеза, наступившую после второй мировой войны, не раз рекордные высоты покорялись химиками-органиками и науке становились известны все новые многоатомные молекулы. Рекордсменом 50-х годов стал октаоктаонта — этиловый эфир октаоктаконтакарбобензокси- (п-фенилен)-диаланина, имеющий формулу C1936H2114N176O441. В 60-х годах первенство захватил полибордиметилсилоксановый полимер состава Ci320H3963BO663Si660. Молекула этого вещества состоит из 6607 атомов.
Сегодня самой многоатомной частицей вещества из всех известных, состоящей в отличие от полимеров из неповторяющихся атомных звеньев, считается ДНК одного из бактериофагов с общей химической формулой C5750H7227N2215O4131S590. Эта молекула — монстр сформирована из 19913 атомов.
- Профессор Знаев
- ОСНОВНОЕ МЕНЮ
- НАЧАЛЬНАЯ ШКОЛА
- РУССКИЙ ЯЗЫК
- ЛИТЕРАТУРА
- АНГЛИЙСКИЙ ЯЗЫК
- НЕМЕЦКИЙ ЯЗЫК
- ИСТОРИЯ
- БИОЛОГИЯ
- ГЕОГРАФИЯ
- МАТЕМАТИКА
- ИНФОРМАТИКА
- Самая длинная реакция
- Как решать химические уравнения — схемы и примеры решения для разных реакций
- Основные термины и понятия
- Виды химических реакций
- Окислительно-восстановительный процесс
- Классический алгоритм
- Решение методом полуреакций
- Использование онлайн-расчёта
- 🌟 Видео
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Профессор Знаев
ОСНОВНОЕ МЕНЮ
НАЧАЛЬНАЯ ШКОЛА
РУССКИЙ ЯЗЫК
ЛИТЕРАТУРА
АНГЛИЙСКИЙ ЯЗЫК
НЕМЕЦКИЙ ЯЗЫК
ИСТОРИЯ
БИОЛОГИЯ
ГЕОГРАФИЯ
МАТЕМАТИКА
ИНФОРМАТИКА
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Самая длинная реакция

Среди побед, которыми могут похвастаться химики-органики, величайшая — это, бесспорно, синтез молекулы белка. Притом белка первостепенной важности.
Речь идет о химическом синтезе инсулина — гормона, управляющего обменом углеводов в организме.
Даже специалистам-химикам еще неясны некоторые детали строения этой белковой молекулы. Инсулин — это поистине молекула-гигант, хотя число входящих в нее элементов очень ограниченно. Но они располагаются в ней в самых причудливых сочетаниях.
А потому для простоты примем, что молекула инсулина состоит из двух частей, двух цепочек — цепи А и цепи В. И связаны друг с другом эти цепи так называемой дисульфидной связью. Иначе говоря, между ними как бы перекинут мостик, состоящий из двух атомов серы.
План генерального наступления на инсулин был следующим. Отдельно синтезировать цепи А и В. Затем соединить их, да так, чтобы между ними обязательно протянулся дисульфидный мостик.
Теперь немного арифметики. Чтобы получить цепь А, химикам понадобилось провести около сотни различных последовательных реакций. Построение цепи В потребовало больше ста. И ушло на это много месяцев кропотливейшего, труда.
Но вот обе цепи, наконец, получены. Надо их связать. Именно здесь и встретились основные трудности. Не раз постигали исследователей жестокие разочарования. И все же в один прекрасный вечер в лабораторном дневнике появилась лаконичная запись: «Молекула инсулина полностью синтезирована».
Двести двадцать три последовательных этапа потребовалось ученым, чтобы искусственно получить инсулин. Вдумайтесь только в эту цифру: до сих пор еще ни одно из известных химических соединений не было приготовлено с таким трудом. Десять человек не покладая рук работали около трех лет…
Биохимики же сообщают весьма любопытную вещь: в живой клетке белок синтезируется всего за… 2–3 секунды.
Три года — и три секунды! Насколько все-таки синтетический аппарат живой клетки совершеннее современной химии!
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Как решать химические уравнения — схемы и примеры решения для разных реакций
Видео:Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

Основные термины и понятия
Составление уравнений химических реакций невозможно без знания определённых обозначений, показывающих, как проходит реакция. Объединение атомов, имеющих одинаковый ядерный заряд, называют химическим элементом. Ядро атома состоит из протонов и нейтронов. Первые совпадают с числом атомного номера элемента, а значение вторых может варьироваться. Простейшими веществами называют элементы, состоящие из однотипных атомов.
Любой химический элемент описывается с помощью символов, условно обозначающих структуру веществ. Формулы являются неотъемлемой частью языка науки. Именно на их основе составляют уравнения и схемы. По своей сути они отражают количественный и качественный состав элементов. Например, запись HNO3 сообщает, что в соединении содержится одна молекула азотной кислоты, а оно само состоит из водорода, азота и кислорода. При этом в состав одного моля азотной кислоты входит по одному атому водорода и азота и 3 кислорода.
Символика элементов, условное обозначение, представляет собой химический язык. В значке содержится информация о названии, массовом числе и порядковом номере. Международное обозначение принято, согласно периодической таблице Менделеева, разработанной в начале 1870 года.
Взаимодействующие между собой вещества называются реагентами, а образующиеся в процессе реакции — продуктами. Составление и решение химических уравнений фактически сводится к определению результатов реакций, поэтому просто знать формулы веществ мало, нужно ещё уметь подбирать коэффициенты. Располагаются они перед формулой и указывают на количество молекул или атомов, принимающих участие в процессе. С правой стороны от химического вещества ставится индекс, указывающий место элемента в системе.
Записывают уравнения в виде цепочки, в которой указываются все стадии превращения вещества начиная с левой части. Вначале пишут формулы элементов в исходном состоянии, а затем последовательно их преобразование.
Видео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

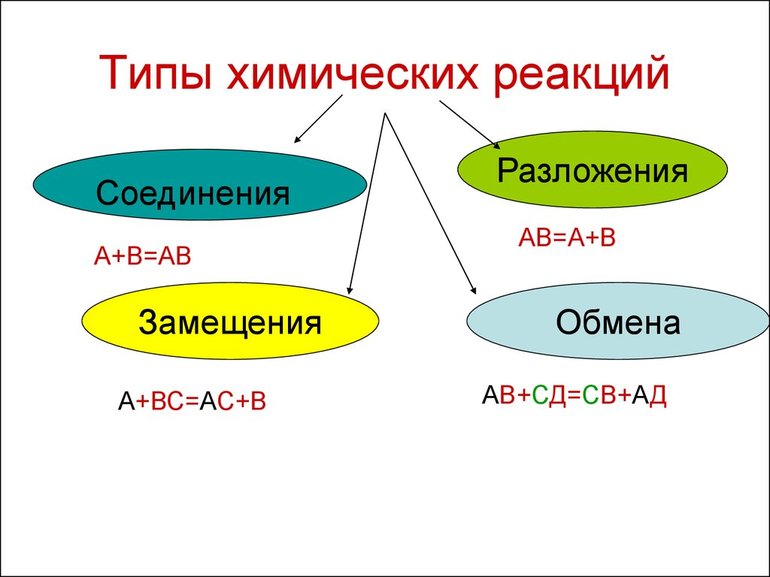
Виды химических реакций
Химические явления характеризуются тем, что из двух и более элементов образуются новые вещества. Уравнения описывают эти процессы. Впервые с объяснениями протекания реакций знакомят в восьмом классе средней образовательной школы на уроках неорганической химии. Ученикам демонстрируют опыты, в которых явно наблюдаются различия в протекании реакций.
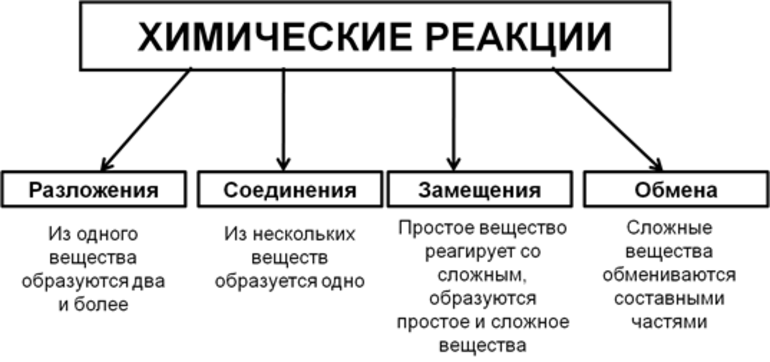
Всего существует 4 типа химического взаимодействия веществ:
- Соединение. В реакцию могут вступать 2 простых вещества: металл и неметалл или неметалл и неметалл. Например, алюминий с серой образуют сульфид алюминия. Кислород, взаимодействуя с водородом, превращается в воду. Объединятся могут 2 оксида с растворимым основанием, как оксид кальция с водой: CaO + H2O = Ca (OH)2 или основной оксид с кислотным: CaO + SO3 = CaSO4.
- Разложение. Это процесс обратный реакции соединения: было одно вещество, а стало несколько. Например, при пропускании электрического тока через воду получается водород и кислород, а при нагревании известняка 2 оксида: CaCO3 = CaO + CO2.
- Замещение. В реакцию вступают 2 элемента. Один из них простой, а второй сложный. В итоге образуются 2 новых соединения, при котором атом простого вещества заменяет сложный, как бы вытесняя его. Условие протекания процесса: простое вещество должно быть более активным, чем сложное. Например, Zn + 2HCl = ZnCl2 + H2. Величину активности можно узнать из таблицы ряда электрохимических напряжений.
- Обмен. В этом случае между собой реагируют 2 сложных элемента, обменивающиеся своими составными частями. Условием осуществления такого типа реакции является обязательное образование воды, газа или осадка. Например, CuO + 2HCl = CuCl2 + H2O. Чтобы узнать, смогут ли вещества прореагировать, используют таблицу растворимости.
Основными признаками химических реакций является изменение цвета, выделение газа или образование осадка. Различают их по числу веществ, вступивших в реакцию и образовавшихся продуктов. Правильное определение типа реакции особо важно при составлении химических уравнений, а также определения свойств и возможностей веществ.
Видео:ЭТОТ метод поможет на уроках ХИМИИ / Химия 9 классСкачать

Окислительно-восстановительный процесс
Составление большинства реакций сводится к подбору коэффициентов. Но при этом могут возникнуть трудности с установлением равновесия, согласно закону сохранения массы веществ. Чаще всего такая ситуация возникает при решении заданий, связанных с расстановкой количества атомов в уравнениях окислительно-восстановительных процессов.
Под ними принято понимать превращения, протекающие с изменением степени окисления элементов. При окислении происходит процесс передачи атомом электронов, сопровождающийся приобретением им положительного заряда или ионом, после чего он становится нейтральным. При этом также происходит процесс восстановления, связанный с присоединением элементарных частиц атомом.
Для составления уравнений необходимо определить восстановитель, окислитель и число участвующих в реакции электронов. Коэффициенты же подбирают с помощью метода электронно-ионного баланса (полуреакций). Его суть состоит в установлении равенства путём уравнивания количества электронов, отдаваемых одним элементом и принимаемым другим.
Видео:Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Классический алгоритм
В основе решения задач этим методом — закон сохранения массы. Согласно ему, совокупная масса элементов до реакции и после остаётся неизменной. Другими словами, происходит перегруппировка частиц. Если рассматривать решение химического уравнения поэтапно, оно будет состоять из трёх шагов:
- Написания формул элементов, вступающих в реакцию с левой стороны.
- Указания справа формулы образующихся веществ.
- Уравнивания числа атомов с добавлением коэффициентов.
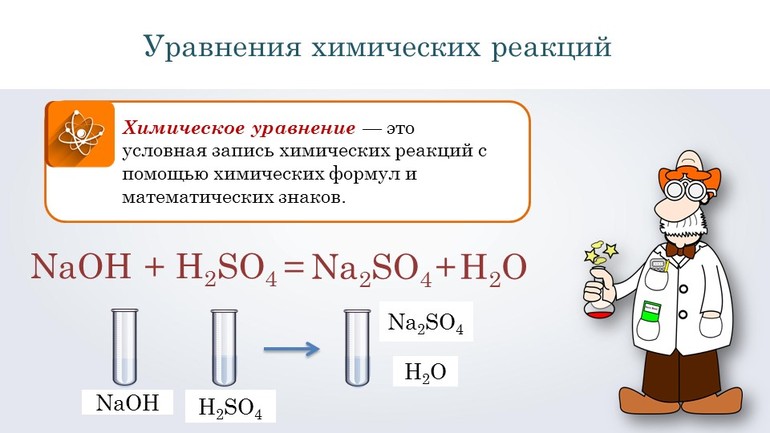
Перед тем как переходить к сложным соединениям, лучше всего потренироваться на простых. Например, нужно составить уравнение, описывающее взаимодействие двух сложных веществ: гидроксида натрия и серной кислоты. При таком соединении образуется сульфат натрия и вода.
Согласно алгоритму, в левой части уравнения необходимо записать реагенты, а в правой продукты реакции: NaOH + H2SO 4 → Na 2SO4 + H2O. Теперь следует уравнять коэффициенты. Начинают с первого элемента. В примере это натрий. В правой части содержится 2 его атома, а в левой один, поэтому необходимо возле реагента поставить цифру 2. Затем нужно уровнять водород. В результате получится выражение: 2 NaOH + H2SO 4 → Na2 SO4 +2H2O.
Ещё одним наглядным примером является процесс реакции тринитротолуола с кислородом. При их взаимодействии образуется: C7H5N3O6 + O2 → CO2 + H2O + N2. Исходя из того, что слева находится нечётное число атомов H и N, а справа чётное, нужно их уравнять: 2C7H5N3O6 + O2 → CO2 + H2O + N2.
Теперь становится понятным, что 14 и 10 атомов углерода и водорода должны образовать 14 долей диоксида и 5 молекул воды. При этом 6 атомов азота превратятся в 3. Итоговое уравнение будет выглядеть как 2C7H5N3O6 + 10,5O2 → 14CO2 + 5H2O + 3N2.
Перед тем как начинать тренировку по составлению уравнений, следует научиться расставлять валентность. Это параметр, равный числу соединившихся атомов каждого элемента. Фактически это способность к соединению. Например, в формуле NH3 валентность атома азота равна 3, а водорода 1.
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Решение методом полуреакций
Алгоритм для решения примеров химических уравнений проще рассмотреть на конкретном задании. Пускай необходимо описать процесс окисления пирита азотной кислоты с малой концентрацией: FeS2 + HNO3. Решать этот пример необходимо в следующей последовательности:
- Определить продукты реакции. Так как кислота является сильным окислителем, сера получит максимальную степень оксидации S6+, а железо Fe3+. HNO3 может восстановиться до одного из двух состояний NO2 или NO.
- Исходя из состава ионов и правила, что вещества, переходящие в газовую форму или плохо растворимые, записываются в молекулярном виде, верным будет записать: FeS2 — Fe3+ + 2SO2−4. Гидролизом можно пренебречь.
- В записи уравнивают кислород. Для этого в левую часть добавляют 8 молекул воды, а в правую 16 ионов водорода: FeS2 + 8H20 — Fe3+ + 2SO2−4 + 16H+. Так как заряда в левой части нет, а в правой он равный +15, то серное железо должно будет отдать 15 электронов. Значит, уравнение примет вид: FeS2 + 8H20 — 15e → Fe3+ + 2SO2−4 + 16H+.
- Теперь переходят к реакции восстановления нитрата иона: NO-3 →NO. Для её составления нужно отнять у оксида азота 2 атома кислорода. Делают это путём прибавления к левой части 4 ионов водорода, а правой — 2 молекул воды. В итоге получится: NO-3 + 4H+ → NO + 2H2O.
- Полученную формулу уравнивают добавлением к левой части 3 электронов: NO-3 + 4H+ 3e → NO + 2H2O.
- Объединяют найденные выражения и записывают результат: FeS2 + 8H20 + 5NO-3 + 20H+ → Fe3+ + 2SO2−4 + 16H+ + 5NO + 10H2O.
Уравнение можно сократить на 16H + и 8H2O. В итоге получится сокращённое выражение окислительно-восстановительной реакции: FeS2 + 5NO — 3 + 4 H + = Fe3 + + 2SO 2- 4 + 5NO + 2H2O.
Такой алгоритм считается классическим, но для упрощения понимания лучше использовать способ электронного баланса. Процесс восстановления переписывают как N5+ + 3e → N2+. Степень же окисления составить сложнее. Сере нужно приписать степень 2+ и учесть, что на 1 атом железа приходится 2 атома серы: FeS2 → Fe3++ 2S6+. Запись общего баланса будет выглядеть: FeS2 + 5N5+ = Fe3+ + 2S6+ + 5N2+.
Пять молекул потратятся на окисление серного железа, а ещё 3 на образование Fe (NO3)3. После уравнения двух сторон запись реакции примет вид, аналогичный полученному с использованием предыдущего метода.
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Использование онлайн-расчёта
Простые уравнения решать самостоятельно довольно просто. Но состоящие из сложных веществ могут вызвать трудности даже у опытных химиков. Чтобы получить точную формулу и не подбирать вручную коэффициенты, можно воспользоваться онлайн-калькуляторами. При этом их использовать сможет даже пользователь, не особо разбирающийся в науке.
Чтобы расстановка коэффициентов в химических уравнениях онлайн происходила автоматически, нужно лишь подключение к интернету и исходные данные. Система самостоятельно вычислит продукты реакции и уравняет обе стороны формулы. Интересной особенностью таких сайтов является не только быстрый и правильный расчёт, но и описание правил с алгоритмами, по которому выполняются действия.
После загрузки калькулятора в веб-обозревателе единственное, что требуется от пользователя — правильно ввести реагенты в специальные формы латинскими буквами и нажать кнопку «Уравнять». Иногда возникает ситуация, когда запись сделана верно, но коэффициенты не расставляются. Это происходит, если суммы в уравнении могут быть подсчитаны разными способами. Характерно это для реакций окисления. В таком случае нужно заменить фрагменты молекул на любой произвольный символ. Таким способом можно не только рассчитать непонятное уравнение, но и выполнить проверку своих вычислений.
🌟 Видео
Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

8 класс. Химия. Как расставить коэффициенты в уравнении?Скачать

Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Окислительно-восстановительные реакции. 1 часть. 9 класс.Скачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

8 класс. Составление уравнений химических реакций.Скачать

ЧТО ТАКОЕ уравнение химической реакции? Все намного проще чем ты думал! #shorts #yotubeshortsСкачать

Учимся составлять электронный баланс/овр/8классСкачать

СПОРИМ, что ты не знал это правило? Как составить Уравнение Реакции #shorts #youtubeshortsСкачать