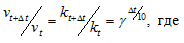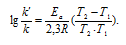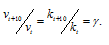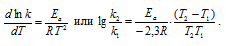тест по химии (11 класс) на тему
Тест — Скорость химических реакций.Химическое равновесие
Видео:Влияние концентрации на скорость химических реакций. 10 класс.Скачать

Скачать:
| Вложение | Размер |
|---|---|
| test_-_skorost_khimicheskikh_reaktsiy.khimicheskoe_ravnovesie.doc | 150.5 КБ |
Видео:Задачи на скорость реакции в зависимости от концентрации реагентовСкачать

Предварительный просмотр:
Х–11 Тест «Скорость химических реакций. Химическое равновесие» Вариант №1
При выполнении заданий А1-А10 из предложенных вариантов ответов выберите тот, который вы считаете правильным. 1 балл за каждое верно выполненное задание.
А1. Фактор, не влияющий на скорость химической реакции:
1) Давление 2) Катализатор 3) Концентрация 4) Форма сосуда, в котором протекает реакция
А2. Фактор, влияющий на смещение химического равновесия:
1) Вид химической связи 2) Катализатор 3) Природа реагирующих веществ 4) Температура
А3. С увеличением концентрации азота в 2 раза скорость прямой реакции, уравнение которой N 2 (г)+O 2 (г)↔2NO(г)
1) Не изменится 2) Увеличится в 2 раза 3) Увеличится в 4 раза 4) Уменьшится в 4 раза
А4. С увеличением давления в 5 раз скорость прямой реакции, уравнение которой 2NO(г)+O 2 (г)↔2NO 2 (г), увеличится в:
1) 5 раз 2) 25 раз 3) 75 раз 4) 125 раз
А5. При повышении температуры на 10°С (температурный коэффициент равен 2) скорость химической реакции увеличивается:
1) в 2 раза 2) в 4 раза 3) в 8 раз 4) в 16 раз
А6. С увеличением давления равновесие обратимой реакции, уравнение которой C 2 H 4(г) +H 2 O (г) ↔C 2 H 5 OH (г)
1) Не изменится 2) Сместится в сторону продуктов реакции 3) Сместится в сторону исходных веществ
А7. Для смещения химического равновесия обратимой реакции 2SO 2 (г)+O 2 (г)↔2SO 3 (г)+Q в сторону исходных веществ необходимо :
1) Увеличить давление 2) Повысить температуру 3) Понизить температуру 4) Ввести катализатор
А8. Максимальная скорость химической реакции при взаимодействии веществ, формулы которых
1) Zn(гранулы) + HCl 2) Zn(пыль) + HCl 3) Pb + HCl 4) Fe + HCl
А9. Повышение температуры смещает химическое равновесие вправо в обратимой реакции, уравнение которой:
1) 2H 2 + O 2 ↔ 2H 2 O + Q 2) SO 2 + H 2 O ↔ H 2 SO 3 + Q
3) 2NO + O 2 ↔ 2NO 2 + Q 4) C 4 H 10 ↔ C 4 H 8 + H 2 – Q
А10. Скорость химической реакции, уравнение которой Mg + 2HCl = MgCl 2 + H 2 ↑, при уменьшении концентрации кислоты за каждые 10 с на 0,04 моль/л равна:
1) 0,00004 моль/(л•с) 2) 0,0004 моль/(л•с) 3) 0,004 моль/(л•с) 4) 0,04 моль/(л•с)
В заданиях В1-В2 установите соответствие. Ответ запишите в виде последовательности цифр.
2 балла за верно выполненное задание.
В1. Установите соответствие между уравнением реакции и формулой для определения скорости реакции:
Формула для определения скорости реакции
А) C(т) + O 2 (г) = CO 2 (г)
Б) С(т) + CO 2 (г) = 2CO(г)
В) Mg(т) + 2HCl(ж) = MgCl 2 (г) + H 2 (г)
В2. Установите соответствие между фактором и смещением равновесия для реакции, уравнение которой C 2 H 4 (г)+H 2 (г)↔C 2 H 6 (г) + Q
А) Повышение давления
1) Сместится вправо
Б) Увеличение температуры
2) Сместится влево
В) Увеличение концентрации C 2 H 4
Г) Уменьшение концентрации C 2 H 6
Д) Применение катализатора
Для задания С1 дайте полный развернутый ответ.
С1(5 баллов). Почему, если смешать твердый нитрат свинца (Pb(NO 3 ) 2 ) и йодид калия (KI), признаки реакции можно наблюдать через несколько часов, а если слить растворы этих солей, признаки реакции появятся сразу. Напишите уравнение реакции.
С2(5 баллов) . Запишите схему химической реакции, скорость которой можно рассчитать по формуле
С3(6баллов) . Вычислите, какое количество теплоты выделилось, если сгорело 25 кг угля? Термохимическое уравнение реакции: С + О 2 = СО 2 + 402,24 кДж
Х–11 Тест «Скорость химических реакций. Химическое равновесие» Вариант №2
При выполнении заданий А1-А10 из предложенных вариантов ответов выберите тот, который вы считаете правильным. 1 балл за каждое верно выполненное задание.
А1. Фактор, не влияющий на скорость химической реакции:
1) Давление 2) Катализатор 3) Способ получения реагентов 4) Температура
А2. Фактор, не влияющий на смещение химического равновесия:
1) Давление 2) Концентрация 3) Температура 4) Природа реагирующих веществ
А3. С увеличением концентрации хлора в 2 раза скорость реакции, уравнение которой CO(г)+Cl 2 (г)=COCl 2 (г)
1) Не изменится 2) Увеличится в 2 раза 3) Увеличится в 4 раза 4) Уменьшится в 4 раза
А4. С уменьшением давления в 3 раз скорость прямой реакции, уравнение которой N 2 (г)+O 2 (г)↔2NO(г), уменьшится в:
1) 3 раза 2) 9 раз 3) 27 раз 4) 81 раз
А5. Для увеличения скорости химической реакции в 32 раза (температурный коэффициент равен 2) надо повысить температуру на :
1) 30 °С 2) 40 °С 3) 50 °С 4) 60 °С
А6. С увеличением концентрации SO 2 равновесие обратимой реакции, уравнение которой 2SO 2(г) +O 2(г) ↔2SO 3(г) + Q
1) Не изменится 2) Сместится в сторону продуктов реакции 3) Сместится в сторону исходных веществ
А7. Для смещения химического равновесия обратимой реакции N 2 (г)+3H 2 (г)↔2NH 3 (г)+Q в сторону продуктов реакции необходимо :
1) Увеличить концентрацию NH 3 2) Повысить температуру 3) Повысить давление
А8. Максимальная скорость химической реакции при взаимодействии веществ, формулы которых
1) С 2 H 5 OH(ж) + О 2 2) С 2 H 5 OH(г) + О 2 3) N 2 + O 2 4) CuO + H 2 SO 4
А9. Понижение давления смещает химическое равновесие вправо в обратимой реакции, уравнение которой:
1) CH 4 (г) + Н 2 O(ж) ↔ 3H 2 + СО 2) СO 2 (г) + H 2 O(ж) ↔ H 2 СO 3 (г)
3) 3Н 2 (г) + N 2 (г) ↔ 2NH 3 (г) 4) 2CO(г) + O 2 (г) ↔ 2CO 2 (г)
А10. Скорость химической реакции, уравнение которой CuO + H 2 SO 4 = CuSO 4 + H 2 O, при уменьшении концентрации кислоты за каждые 10 с на 0,03 моль/л равна:
1) 0,1 моль/(л•с) 2) 0,001 моль/(л•с) 3) 0,002 моль/(л•с) 4) 0,003 моль/(л•с)
В заданиях В1-В2 установите соответствие. Ответ запишите в виде последовательности цифр.
2 балла за верно выполненное задание.
В1. Установите соответствие между уравнением реакции и формулой для определения скорости реакции:
Формула для определения скорости реакции
А) СO 2 (г) + H 2 O(ж) ↔ H 2 СO 3 (г)
Б) 2CO(г) + O 2 (г) ↔ 2CO 2 (г)
В) CH 4 (г) + Н 2 O(ж) ↔ 3H 2 + СО
В2. Установите соответствие между фактором и смещением равновесия для реакции, уравнение которой 4HCl(г)+O 2 (г)↔2H 2 O(г) +2Cl 2 (г) + Q
А) Повышение температуры
1) Сместится вправо
Б) Увеличения давления
2) Сместится влево
В) Увеличение концентрации О 2
Г) Уменьшение концентрации HCl
Д) Применение катализатора
Для задания С1 дайте полный развернутый ответ.
С1(5 баллов). Приведите примеры химических реакций, иллюстрирующих влияние катализатора на направление химического процесса: а) для неорганических веществ; б) для органических соединений. Напишите уравнение реакции.
С2(5 баллов) . Запишите схему химической реакции, скорость которой можно рассчитать по формуле
С3(6баллов) . Используя термохимическое уравнение: 2Н 2 + О 2 = 2Н 2 О + 484 кДж, определите массу образовавшейся воды, если в ходе реакции выделилось 520 кДж теплоты.
Х–11 Тест «Скорость химических реакций. Химическое равновесие» Вариант №3
При выполнении заданий А1-А10 из предложенных вариантов ответов выберите тот, который вы считаете правильным. 1 балл за каждое верно выполненное задание.
А1. Фактор, не влияющий на скорость химической реакции:
1) Давление 2) Катализатор 3) Концентрация 4) Форма сосуда, в котором протекает реакция
А2. Фактор, влияющий на смещение химического равновесия:
1) Катализатор 2) Концентрация 3) Тип связи 4) Природа реагирующих веществ
А3. С увеличением концентрации кислорода в 2 раза скорость реакции, уравнение которой СH 4 (г)+2O 2 (г)=CO 2 (г) + 2H 2 O(г)
1) Не изменится 2) Увеличится в 2 раза 3) Увеличится в 4 раза 4) Уменьшится в 4 раза
А4. С увеличением давления в 4 раз скорость прямой реакции, уравнение которой 2СО(г)+O 2 (г)↔2СO 2 (г), увеличится в:
1) 4 раза 2) 16 раз 3) 64 раза 4) 128 раз
А5. При повышении температуры на 20 °С (температурный коэффициент равен 3) скорость химической реакции увеличится в :
1) 3 раза 2) 9 раз 3) 27 раз 4) 81 раз
А6. С увеличением температуры равновесие обратимой реакции, уравнение которой СO 2(г) +С (г) ↔2СO (г) – Q
1) Не изменится 2) Сместится в сторону продуктов реакции 3) Сместится в сторону исходных веществ
А7. Для смещения химического равновесия обратимой реакции 2NО(г)+О 2 (г)↔2NО 2 (г)+Q в сторону исходных веществ необходимо :
1) Увеличить концентрацию NО 2 2) Понизить температуру 3) Повысить давление
А8. Максимальная скорость химической реакции при взаимодействии веществ, формулы которых
1) BaCl 2 (т) + H 2 SO 4 2) BaCl 2 (р-р) + H 2 SO 4 3) BaO + H 2 SO 4 4) CaCO 3 + H 2 SO 4
А9. Понижение температуры смещает химическое равновесие вправо в обратимой реакции, уравнение которой:
1) 2NO(г) + O 2 (г) ↔ 2NO 2 (г) + Q 2) С 2 H 6 (г) ↔ 2C(т) + 3H 2 (г) –Q
3) 2HBr(г) ↔ H 2 (г) + Br 2 (ж) – Q 4) 2HI(г) ↔ H 2 (г) + I 2 (т)
А10. Скорость химической реакции, уравнение которой CaCO 3 + 2HCl = CaCl 2 + CO 2 + H 2 O, при уменьшении концентрации кислоты за каждые 20 с на 0,05 моль/л равна:
1) 2,5 моль/(л•с) 2) 0,25 моль/(л•с) 3) 0,025 моль/(л•с) 4) 0,0025 моль/(л•с)
В заданиях В1-В2 установите соответствие. Ответ запишите в виде последовательности цифр.
2 балла за верно выполненное задание.
В1. Установите соответствие между уравнением реакции и формулой для определения скорости реакции:
Формула для определения скорости реакции
А) S(т) + O 2 (г) ↔ SO 2 (г)
1)
Б) 2HBr(г) ↔ H 2 (г) + Br 2 (ж)
В) N 2 (г) + O 2 (г) ↔ 2NO(г)
В2. Установите соответствие между фактором и смещением равновесия для реакции, уравнение которой 2CO(г)+O 2 (г)↔2CO 2 (г) + Q
А) Увеличения давления
1) Сместится вправо
Б) Увеличение концентрации О 2
2) Сместится влево
В) Повышение температуры
Г) Применение катализатора
Д) Увеличение концентрации CO 2
Для задания С1 дайте полный развернутый ответ.
С1(5 баллов). Почему реакция между кислотой и гладкой гранулой цинка идет медленнее, чем с этой же кислотой и шероховатой гранулой. Напишите уравнение реакции.
С2(5 баллов) . Запишите схему химической реакции, скорость которой можно рассчитать по формуле
С3(6баллов) . Какое количество теплоты выделится при сжигании 25г водорода, взятого при нормальных условиях? Термохимическое уравнение реакции: 2Н 2 + О 2 = 2Н 2 О + 484 кДж
Х–11 Тест «Скорость химических реакций. Химическое равновесие» Вариант №4
При выполнении заданий А1-А10 из предложенных вариантов ответов выберите тот, который вы считаете правильным. 1 балл за каждое верно выполненное задание.
А1. Фактор, не влияющий на скорость химической реакции:
1) Размер пробирки 2) Катализатор 3) Концентрация 4) Природа реагирующих веществ
А2. Фактор, не влияющий на смещение химического равновесия:
1) Катализатор 2) Концентрация 3) Давление 4) Температура
А3. С увеличением концентрации оксида углерода (II) в 2 раза скорость реакции, уравнение которой 2СО(г)+O 2 (г)=2CO 2 (г)
1) Не изменится 2) Увеличится в 2 раза 3) Увеличится в 4 раза 4) Уменьшится в 4 раза
А4. С уменьшением давления в 2 раз скорость прямой реакции, уравнение которой N 2 (г)+3H 2 (г)↔2NH 3 (г), уменьшится в:
1) 2 раза 2) 8 раз 3) 16 раз 4) 32 раза
А5. Для увеличения скорости химической реакции в 27 раза (температурный коэффициент равен 3) надо повысить температуру на :
1) 30 °С 2) 40 °С 3) 50 °С 4) 60 °С
А6. С увеличением давления равновесие обратимой реакции, уравнение которой СO (г) +2Н 2(г) ↔2СН 3 ОН (г) + Q
1) Не изменится 2) Сместится в сторону продуктов реакции 3) Сместится в сторону исходных веществ
А7. Для смещения химического равновесия обратимой реакции в сторону продуктов реакции необходимо СH 3 COOH(ж)+C 2 H 5 OH(ж)↔CH 3 COOC 2 H 5 (ж) + H 2 O(ж)
1) Увеличить концентрацию C 2 H 5 OH 2) Увеличить концентрацию H 2 O 3) Повысить давление
А8. Максимальная скорость химической реакции при взаимодействии веществ, формулы которых
1) H 2 (г) + О 2 (г) 2) S(т) + О 2 (г) 3) N 2 (г) + O 2 (г) 4) С 5 Н 12 (г) + О 2 (г)
А9. Повышение давления смещает химическое равновесие вправо в обратимой реакции, уравнение которой:
1) 2NO 2 (г) ↔ N 2 O 4 (г) 2) N 2 (г) + O 2 (г) ↔ 2NO(г)
3) CaCO 3 (т) ↔ CaO(т) + CO 2 (г) 4) СН 4 (г) ↔ С(т) + 2Н 2 (г)
А10. Скорость химической реакции, уравнение которой Zn + 2HCl = ZnCl 2 + H 2 , при уменьшении концентрации кислоты за каждые 30с на 0,06 моль/л равна:
1) 0,001 моль/(л•с) 2) 0,002 моль/(л•с) 3) 0,004 моль/(л•с) 4) 0,02 моль/(л•с)
В заданиях В1-В2 установите соответствие. Ответ запишите в виде последовательности цифр.
2 балла за верно выполненное задание.
В1. Установите соответствие между уравнением реакции и формулой для определения скорости реакции:
Видео:257. Как изменится скорость хим реакции, если увеличить концентрацию одного из реагирующих веществСкачать

Факторы, вызывающие изменение скорости и константы реакции
Задача 373.
Как изменится скорость реакции 2NO + O2 ⇔ 2NO2 если объем реакционного сосуда увеличить в 2 раза: а) уменьшится в 4 раза; б) уменьшится в 8 раз; в) возрастет в 4 раза; г) возрастет в 8 раз?
Решение:
Уравнение реакции имеет вид: 2NO + O2 ⇔ 2NO2.
До изменения объёма скорость реакции можно выразить уравнением:
v — скорость реакции, k — константа скорости реакции, [NO] и [O2] – концентрации исходных веществ.
Вследствие увеличения объёма в системе в 2 раза, соответственно концентрация каждого из реагирующих веществ уменьшится в 2 раза. Следовательно, теперь скорость реакции будет равна:
Тогда, сравнивая выражения v и v’, находим, что скорость реакции уменьшится в 8 раз
Ответ: б).
Задача 374.
Чем объясняется повышение скорости реакции при введении в систему катализатора: а) уменьшением энергии активации; б) увеличением средней кинетической энергии молекул; в) возрастанием числа столкновений; г)
остом числа активных молекул?
Решение:
Действие катализатора объясняется тем, что при его участии в реакционной системе возникают нестойкие промежуточные соединения (активированные комплексы), распад которых приводит к образованию продуктов реакции. При этом энергия активации реакции значительно понижается и активными становятся некоторые молекулы (реакционные частицы), энергия которых была недостаточна для осуществления реакции в отсутствии катализатора. В результате, при применении катализатора в реакционной системе общее число активных молекул (частиц) и скорость реакции значительно возрастает.
Таким образом, катализатор приводит к уменьшению энергии активации реакции и росту числа активных молекул (частиц).
Ответ: а); г).
Задача 375.
Какие из перечисленных воздействий приведут к изменению константы скорости реакции: а) изменение давления; б) изменение температуры; в) изменение объема реакционного сосуда; г) введение в систему катализатора; д) изменение концентрации реагирующих веществ?
Решение:
а) Согласно закону действующих масс скорость химической реакции прямо пропорциональна произведению концентрации реагирующих веществ в степенях, равных стехиометрическим коэффициентам. Например, для реакции mA + nB ⇔ AmBn зависимость скорости реакции от концентрации реагентов А и В выразится в виде:
V = k[A] m . [B] n , где
А, В – молярные концентрации реагирующих веществ;
m, n – стехиометрические коэффициенты;
k – константа скорости реакции — величина, которая зависит от природы реагирующих веществ и равная единице, когда концентрации реагирующих веществ равны единице.
В случае гетерогенных химических реакций в выражение ЗДМ не входит концентрация веществ находящихся в твёрдой фазе, поскольку процесс протекает лишь на их поверхности.
При изменении давления в реакционной системе, в которой присутствуют газообразные вещества, происходит изменение концентрации газообразных реагентов. Значит, при изменении концентрации изменится значение скорости реакции, а значение константы скорости реакции не изменится.
б) Зависимость скорости реакции (или константы скорости реакции) от температуры может быть выражена уравнением:
Здесь vt и kt — скорость и константа скорости реакции при температуре t °С; vt + 10 и kt + 10 те же величины при температуре (t + 100 °С ); 
Зависимость константы скорости реакции (k) от энергии активации (Ea) выражается уравнением Аррениуса: 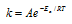
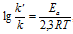
Ea — энергия активации, k и k’ — константы скорости реакции, Т – температура в К (298). Учитывая зависимость константы скорости реакции от изменения температуры, получим:
Из чего следует, что чем меньше энергия активации и выше температура, тем больше константа скорости реакции и k’/k.
Таким образом, изменение температуры реакционной среды приводит к изменению константы скорости реакции.
в) Изменение объёма жидкой или газообразной системы приводит к изменению конценрации газообразных веществ и веществ, находящихся в жидкой фазе. Следовательно, при изменении концентрации реагирующих веществ, исходя из выражения ЗДМ реакции, изменится только значение скорости процесса, а величина k останется постоянной. Величина константы скорости реакции зависит от природы реагентов и не зависит от изменения концентрации их в реакционной системе.
г) Введение в систему катализатора приводит к увеличению скорости реакции, но концентрации веществ остаются прежними, значит, изменится и значение константы скорости реакции, оно целочисленно станет больше. Катализатор снижает энергию активации реакции, что можно описать с помощью уравнения Аррениуса: 
Ea‘ и Ea» — изменение энергии активации в реакционной системе после введения катализатора.
д) Изменение концентрации реагирующих веществ, исходя из выражения ЗДМ реакции, изменится только значение скорости процесса, а величина k останется постоянной.
Вывод:
Константа скорости реакции – это величина, зависящая от природы реагирующих веществ, от температуры и от присутствия катализаторов, но не зависит от концентрации реагирующих веществ.
Ответ: б); г).
Задача 376.
Какое влияние оказывает перемешивание на скорость протекания гетерогенной химической реакции: а) во всех случаях увеличивает скорость реакции; б) в некоторых случаях увеличивает скорость реакции; в) не влияет на скорость реакции?
Решение:
В ходе гетерогенной реакции можно выделить три стадии:
1. Подвод реагирующего вещества;
2. Химические реакции на поверхности;
3. Отвод продукта реакции то поверхности.
Скорость гетерогенной реакции – это количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице площади поверхности фазы.
При перемешивании системы скорость переноса веществ и отвода продуктов реакции увеличивается, соответственно, должна увеличиваться и скорость реакции. Действительно, при перемешивании, скорость реакции увеличивается, если химическая стадия реакции требует небольшой энергии активации. Так реакция горения угля C(тв) + О2(г) ⇔ СО2(г) протекает тем быстрее, чем интенсивнее идёт конвекция в системе. Однако, есть реакции, скорость которых не увеличивается при перемешивании, например, реакция окисления железа кислородом влажного воздуха не ускоряется при увеличении подачи воздуха к поверхности металла, поскольку здесь энергия активации химической стадии процесса значительна.
Стадия, определяющая скорость протекания реакции, называется лимитирующей стадией. В реакции горения угля лимитирующей стадией является перенос вещества, а в реакции окисления железа собственно химическая реакция. Таким образом, перемешивание (конвекция) в некоторых случаях увеличивает скорость гетерогенной реакции, а именно, если стадия переноса веществ является лимитирующей, т.е. энергия активации стадии подвода и отвода веществ невелика.
Ответ: б).
Задача 377.
Увеличение скорости реакции с повышением температуры, вызывается главным образом: а) увеличением средней кинетической энергии молекул; б) возрастанием числа активных молекул; в) ростом числа столкновений?
Решение:
Зависимость скорости реакции (или константы скорости реакции) от температуры может быть выражена уравнением:
Здесь vt и kt — скорость и константа скорости реакции при температуре t °С; v(t + 10) и k(t + 10) те же величины при температуре (t + 100 °С ); 
Естественно, при повышении температуры системы увеличивается и кинетическая энергия молекул (частиц) и возрастает число столкновений молекул (частиц) реагирующих веществ. Но от этого правила наблюдаются отклонения для гетерогенных реакций, так как скорость их мало изменяется с температурой, и для биохимических реакций, для которых при повышении температуры всего лишь на один градус скорость реакции увеличивается в десятки и сотни раз.
Аррениус дал более точное выражение для зависимости константы скорости реакции от температуры:
Как показывает практика, элементарный акт реакции протекает не при всяком столкновении молекул (частиц) реагирующих веществ: реагируют только те молекулы (частицы), которые обладают достаточной энергией, чтобы разорвать или ослабить связи в исходных молекулах (частицах) и тем самым создать возможность образования новых молекул (частиц). Поэтому каждая реакция характеризуется определённым барьером энергии; для преодоления барьера необходима энергия активации – избыточная энергия, которой должны обладать молекулы (частицы) для того чтобы их столкновение было эффективным. С ростом температуры число активных молекул (частиц) быстро увеличивается, что и приводит к резкому возрастанию скорости реакции.
Видео:259. Как изменится скорость хим реакции, если увеличить давлениеСкачать

С увеличением концентрации азота в 2 раза скорость прямой реакции уравнение которой n2 o2 2no
2.4 РЕШЕНИЕ ТИПОВЫХ ЗАДАЧ ПО ТЕМЕ “ХИМИЧЕСКАЯ КИНЕТИКА И ХИМИЧЕСКОЕ РАВНОВЕСИЕ”
(для нехимических специальностей)
1. Во сколько раз изменится скорость прямой реакции N 2 (г)+3Н2(г)
Увеличение давления в системе в 2 раза равносильно уменьшению объема системы в 2 раза. При этом концентрации реагирующих веществ возрастут в 2 раза. Согласно закону действия масс, начальная скорость реакции равна v н = k · [ N 2 ] · [ H 2 ] 3 . После увеличения давления в 2 раза концентрации азота и водорода увеличатся в 2 раза, и скорость реакции станет равна v к = k · 2[ N 2 ] · 2 3 [ H 2 ] 3 = k · 32[ N 2 ] · [ H 2 ] 3 . Отношение v к. / v н показывает, как изменится скорость реакции после изменения давления. Следовательно, v к / v н = k · 32[ N 2 ] · [ H 2 ] 3 /( k · [ N 2 ] · [ H 2 ] 3 )=32. Ответ: скорость реакции увеличится в 32 раза.
2. В реакции С( т)+2 H 2 (г) 
Согласно закону действия масс, начальная скорость реакции равна v н = k · [ H 2 ] 2 . После уменьшения концентрации водорода в 3 раза скорость станет равна v к = k · (1/3) 2 [ H 2 ] 2 =1/9 k [ H 2 ] 2 . После изменения концентрации водорода скорость изменится следующим образом: v к / vн=1/9 k [ H 2 ] 2 /( k [ H 2 ] 2 )=1/9. Ответ: скорость реакции уменьшится в 9 раз.
3. Во сколько раз возрастет скорость реакции при повышении температуры с 10 до 30 o С ( γ =3)?
При увеличении температуры с 10 до 30 o С скорость реакции в соответствии с правилом Вант-Гоффа возрастает:
v 2 / v 1 = γ ( t 2- t 1)/10 , где t 2 =30 o C , t 1 =10 o C , а v 2 и v 1 – скорости реакции при данных температурах. Получаем v 2 / v 1 =3 (30–10)/10 =3 2 = 9 т.е. скорость реакции увеличится в 9 раз. Ответ: 9.
4. Равновесие реакции 2 H 2 (г)+ O 2 (г)
1) повышении температуры; 2) уменьшении давления; 3) увеличении давления?
Все вещества в системе – газы. В соответствии с принципом Ле Шателье , повышение давления приводит к смещению равновесия в сторону реакции, приводящей к меньшему количеству молей газов, т.е. в сторону образования Н2О. Следовательно, повышение давления в системе смещает равновесие реакции вправо. Ответ: при увеличении давления.
5. В какую сторону сместится равновесие реакции 2 SO 2 (г)+ O 2 (г)
6. Определите константу равновесия реакции
NOCl 2 (г)+ NO (г) 
Константа равновесия обратимой химической реакции равна отношению произведения равновесных концентраций продуктов к произведению равновесных концентраций исходных веществ. Значение каждой из концентраций должно быть возведено в степень, равную стехиометрическому коэффициенту перед соответствующим веществом в уравнении реакции. Поэтому
📽️ Видео
задачи по химии "Зависимость скорости химической реакции от концентрации реагирующих веществ"Скачать

Скорость химической реакцииСкачать

Скорость химических реакций. 9 класс.Скачать

Все о скорости химической реакции | Химия ЕГЭ 10 класс | УмскулСкачать

123. Решение задач на нахождение скорости хим. реакции по известным концентрациям и времени.Скачать

Скорость реакции. Химия – ПростоСкачать

Влияние температуры на скорость химических реакций. 10 класс.Скачать

Урок № 2. Скорость химических реакций. Химическое равновесиеСкачать

Химия | Cкорость химической реакцииСкачать

81. Факторы, влияющие на скорость реакции (часть 2)Скачать

Зависимость скорости реакции от концентрации реагентовСкачать

Всё о скорости химической реакции | Химия ЕГЭ 2022 | УмскулСкачать

Скорость химической реакции/ Страницы 147 - 154/ № 1 - 85/Скачать

Химическое равновесие. Константа равновесия. 10 класс.Скачать

Расчет скорости химической реакции по текущим концентрациям реагентов. Химия для поступающих.Скачать

Решение задач по теме Скорость химической реакцииСкачать