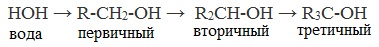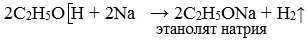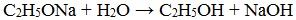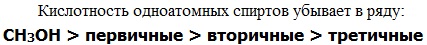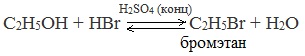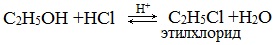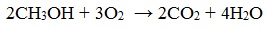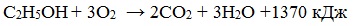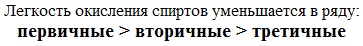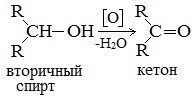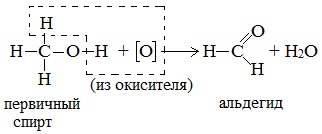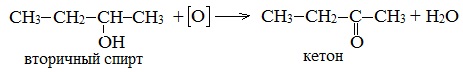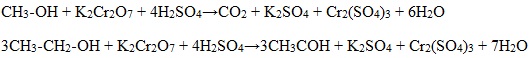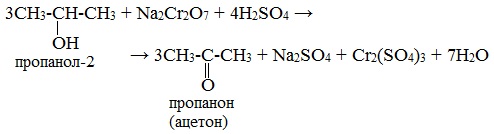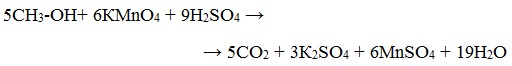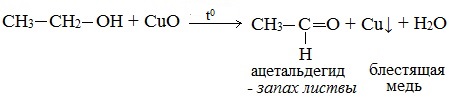Химические свойства спиртов ROH определяются наличием полярных связей 
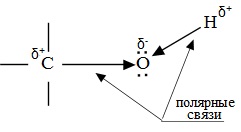
O–H (с отщеплением водорода)
Это могут быть реакции замещения, в которых происходит замена ОН или Н, или реакция отщепления (элиминирования), когда образуется двойная связь.
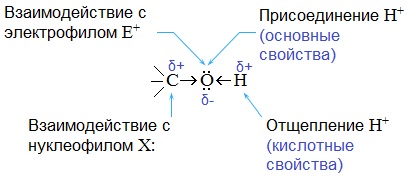
Полярный характер связей С–О и О–Н способствует гетеролитическому их разрыву и протеканию реакций по ионному механизму. При разрыве связи О–Н с отщеплением протона (Н + ) проявляются кислотные свойства гидроксисоединения, а при разрыве связи С–О — свойства основания и нуклеофильного реагента.
С разрывом связи О–Н идут реакции окисления, а по связи С–О – восстановления.
Различают два основных типа реакций спиртов с участием функциональной группы –ОН:
1) Реакции с разрывом связи О-Н:
а) взаимодействие спиртов со щелочными металлами с образованием алкоголятов;
б) реакции спиртов с органическими и минеральными кислотами с образованием сложных эфиров;
в) окисление спиртов под действием дихромата или перманганата калия до карбонильных соединений.
2) Реакции сопровождающиеся разрывом связи С-О:
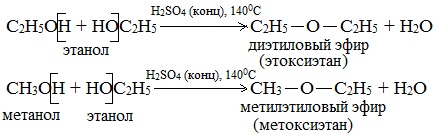
а) каталитическая дегидратация с образованием алкенов (внутримолекулярная дегидратация) или простых эфиров (межмолекулярная дегидратация);
б) замещение группы –ОН галогеном, например при действии галогеноводородов с образованием алкилгалогенидов.
Спирты – амфотерные соединения.
Реакции замещения
Кислотно-основные свойства  Кислотные свойства уменьшаются в ряду, а основные возрастают:
Кислотные свойства уменьшаются в ряду, а основные возрастают: 
Кислотные свойства
1. Взаимодействие со щелочными и щелочноземельными металлами (Li, Na, K, Ca, Ba, Sr)
Реакции с разрывом связи О-Н
При действии на спирты активных металлов в безводной среде атом водорода гидроксильной группы замещается на металл:
Образующиеся соединения (соли спиртов) называются алкоголятами — производные метилового спирта – метил ат ами, производные этилового спирта – этил ат ами.
Видеоопыт «Взаимодействие спиртов с металлическим натрием»
Алкоголяты химически не стабильны и при действии воды они полностью гидролизуются с образованием исходного спирта и щелочи:
Эта реакция показывает, что спирты по сравнению с водой являются более слабыми кислотами (сильная кислота вытесняет слабую). При взаимодействии с растворами щелочей спирты не образуют алкоголяты.
Спирты не взаимодействуют с водными растворами щелочей.
Основные свойства
2.Взаимодействие с галогенводородными кислотами
Реакции с разрывом связи С-О
Замещение гидроксила ОН на галоген происходит в реакции спиртов с галогеноводородами в присутствии катализатора – сильной минеральной кислоты (например, конц. H2SO4). При этом спирты проявляют свойства слабых оснований:
Видеоопыт «Взаимодействие этилового спирта с бромоводородом»
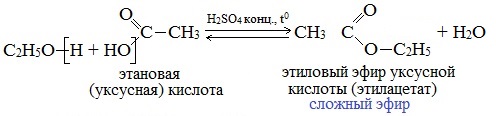
Реакции этерификации
Реакции с разрывом связи О-Н
Спирты вступают в реакции с минеральными и органическими кислотами, образуя сложные эфиры. Реакция обратима (обратный процесс – гидролиз сложных эфиров).
Отличительной особенностью этой реакции является то, что атом Н отщепляется от спирта, а группа ОН – от кислоты:
Реакционная способность одноатомных спиртов в этих реакциях убывает от первичных к третичным.
Реакции отщепления
1. Дегидратация (отщепление воды)
Реакции с разрывом связи С-О
При действии на спирты водоотнимающих реагентов, например, концентрированной серной кислоты, происходит отщепление воды – дегидратация.
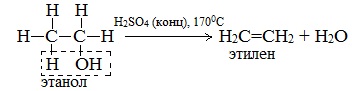
Она может протекать по двум направлениям: с участием одной молекулы спирта (внутримолекулярная дегидратация, приводящая к образованию алкенов) или с участием двух молекул спирта (межмолекулярная дегидратация, приводящая к получению простых эфиров).
При переходе от первичных спиртов к третичным увеличивается склонность к отщеплению воды и образованию алкенов и уменьшается способность образовывать простые эфиры.
а) Межмолекулярная дегидратация спиртов с образованием простых эфиров R-O-R’. Эти реакции могут протекать с участием одного спирта или смеси двух и более спиртов:
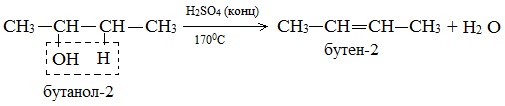
б) Внутримолекулярная дегидратация спиртов с образованием алкенов. Протекает при более высокой температуре. В отличие от межмолекулярной дегидратации в процессе этих реакций происходит отщепление молекулы воды от одной молекулы спирта:
Такие реакции отщепления называются реакциями элиминирования.
Первый член гомологического ряда алканолов – метанол СН3ОН – не вступает в реакции внутримолекулярной дегидратации.
Дегидратация вторичных и третичных спиртов происходит по правилу Зайцева:
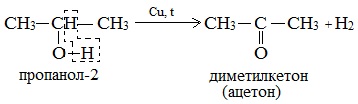
2. Дегидрирование
Реакции с разрывом связей О-Н и С-Н
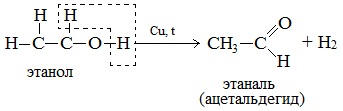
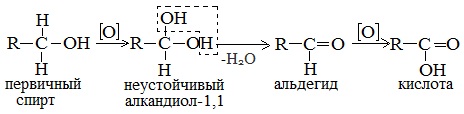
а) При дегидрировании первичных спиртов образуются альдегиды:
Реакция происходит при пропускании нагретых до 300 0 С паров спирта без доступа воздуха над металлическими катализаторами (Cu или металлы платиновой группы – Pd, Pt, Ni). Ni является типичным катализатором дегидрирования или гидрирования, т.е. отщепления или присоединения водорода.
В организме человека этот процесс происходит под действием (алкогольдегидрогеназы).
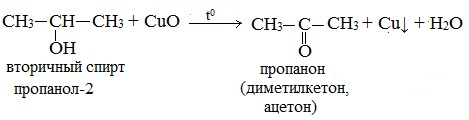
б) При дегидрировании вторичных спиртов образуются кетоны:
Третичные спирты не подвергаются дегидрированию.
Реакции окисления
Для спиртов характерны реакции горения с образованием углекислого газа и воды, а также реакции окисления, приводящие к получению альдегидов, кетонов и карбоновых кислот.
В лабораторных условиях для окисления спиртов обычно используют подкисленные растворы перманганата или дихромата калия, оксид меди и т.д.
1. Горение (полное окисление)
Спирты горят на воздухе с выделением большого количества тепла. С увеличением массы углеводородного радикала – пламя становится всё более коптящим.
При сгорании спиртов выделяется большое количество тепла:
Благодаря высокой экзотермичности реакции горения этанола, он считается перспективным и экологически чистым заменителем бензинового топлива в двигателях внутреннего сгорания. В этом случае энергия химических связей переходит в тепловую энергию, а затем в механическую, что позволяет двигаться автомобилям. В лабораторной практике этанол применяется как горючее для «спиртовок».
2. Неполное окисление
1). В присутствии окислителей [O] – K 2 Cr 2 O 7 или KMnO 4 спирты окисляются до карбонильных соединений:
Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот.
При окислении вторичных спиртов образуются кетоны.
Видеоопыт «Окисление этилового спирта раствором перманганата калия»
Видеоопыт «Окисление этилового спирта кристаллическим перманганатом калия»
Видеоопыт «Каталитическое окисление этанола»
Видеоопыт «Окисление этанола (тест на алкоголь)»
Третичные спирты более устойчивы к действию окислителей. Они окисляются только в жестких условиях (кислая среда, повышенная температура), что приводит к разрушению углеродного скелета молекулы и образованию смеси продуктов (карбоновых кислот и кетонов с меньшей молекулярной массой).
Качественные реакции на спирты
1. Окисление спиртов дихроматом (Na2Cr2O7) или перманганатом (КMnО4)
Качественная реакция на первичные и вторичные спирты!
В кислой среде
Для первичных и вторичных одноатомных спиртов качественной реакцией является взаимодействие их с раствором дихромата натрия. Для повышения скорости реакции ее проводят при нагревании, для создания кислой среды добавляют серную кислоту.
Первичные спирты окисляются дихроматом натрия до альдегидов.
Растворы дихроматов имеют оранжевый цвет и содержат хром в степени окисления +6. В кислой среде они переходят в растворы солей хрома в степени окисления +3 и приобретают зеленый цвет.
На изменении цвета соединений хрома также основана работа алкотестеров, когда пары спирта, содержащиеся в выдыхаемом водителем воздухе, восстанавливают дихромат в стеклянной трубочке.
Вторичные спирты окисляются дихроматом натрия до кетонов.
Третичные спирты в реакции с дихроматами не вступают.
Т.к. перманганат калия в кислой среде более сильный окислитель, чем дихромат, то окисление спирта не останавливается на стадии альдегида и продолжается дальше до карбоновой кислоты.
Раствор перманганата калия содержит марганец в степени окисления +7 и имеет розово-фиолетовый цвет. Если спирт взять в достаточном количестве, то произойдет обесцвечивание раствора. В кислой среде марганец перейдет в степень окисления +2.
Также как и дихроматом натрия, перманганатом калия вторичные спирты могут окисляться до кетонов. Далее возможна деструкция, т.е. разрушение органической молекулы и получение смеси веществ, которые не имеют практического применения.
В жёстких условиях с перманганатом калия третичные спирты окисляются с расщеплением связей С-С и образованием смеси веществ.
Метиловый спирт окисляется перманганатом калия до углекислого газа.
2. Окисление спиртов оксидом меди (II)
Качественная реакция на первичные спирты!
Первичные спирты окисляются оксидом меди (II) до альдегидов.
Видеоопыт «Окисление этилового спирта оксидом меди (II)»
Видеоопыт «Качественная реакция на этанол»
Вторичные спирты окисляются оксидом меди (II) до кетонов.
Третичные спирты оксидом меди (II) не окисляются.
Реакции неполного окисления спиртов по своим результатам аналогичны реакциям дегидрирования.
Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

1. Какие из приведенных утверждений о промышленном способе метанола верны?
А. Применение катализатора в процессе синтеза метанола обус ловлено необходимостью смещения равновесия в сторону продукта реакции. Б. С целью значительного повышения выхода метанола приме няют принцип циркуляции непрореагировавших исходных веществ.
1) верно только А
2) верно только Б
3) верны оба утверждения 4) оба утверждения неверны
2. С разрывом связи О-Н у спиртов происходят реакции, уравнения которых
1) С2Н5ОН—> С2Н4+Н2О
2) 2СН3ОН+2К—> 2СН3ОК+Н2
3) С2Н5ОН+СН3СООН—> СН3СООС2Н5+Н2О
4) С2Н5ОН+НBr—> C2H5Br+H2O
5) 2C2H5OH+2Na—> 2C2H5ONa+H2
6) C2H5OH+NH3–> C2H5NH2+H2O
3. 3,3-диметилбутаналь образуется при окислении
1) (CH3)3C-CH2-CH2OH
2) CH3CH2C(CH3)2-CH2OH
3) CH3CH(CH3)CH(CH3)-CH2OH
4) CH3-CH2-CH(CH3)-CH2OH
Видео:7.4. Спирты: Химические свойства. ЕГЭ по химииСкачать

34 . Кислородсодержащие органические вещества
Характерные химические свойства предельных одноатомных и многоатомных спиртов; фенола; альдегидов, предельных карбоновых кислот, сложны х эфиров.
1. Метаналь может реагировать с
2. Аммиачный раствор оксида серебра является реактивом на:
3. Олеиновая кислота может вступать в реакции с
4) хлоридом хрома ( III)
6) карбонатом натрия
4. Этандиол-1,2 может реагировать с
1) гидроксидом меди ( II)
2) оксидом железа ( II)
5. Продуктами гидролиза сложных эфиров состава С 5 Н 10 О 2 могут быть
пентаналь и метанол
пропановая кислота и этанол
этанол и бутаналь
бутановая кислота и метанол
этановая кислота и пропанол
формальдегид и пентанол
6. Продуктами гидролиза сложных эфиров состава С 6 Н 12 О 2 могут быть
пропановая кислота и пропанол
этаналь и диметиловый эфир
бутан и метилацетат
этановая кислота и бутанол
пентановая кислота и метанол
пропаналь и этандиол
7. Продуктами гидролиза сложных эфиров состава С 7 Н 14 О 2 могут быть
этанол и пропановая кислота
пропаналь и диметиловый эфир
метановая кислота и гексанол
бутановая кислота и пропаналь
гексановая кислота и бутанол
пентановая кислота и этанол
8. Для предельных одноатомных спиртов характерны реакции
9. Метаналь может реагировать с
10. С муравьиной кислотой взаимодействуют:
11. Метанол взаимодействует с веществами:
2) карбонат натрия
4) гидроксид железа(Ш)
6) метановая кислота
12. Олеиновая кислота может вступать в реакции с
4) хлоридом цинка
6) гидроксидом натрия
13. Фенол реагирует с
3) гидроксидом натрия
6) оксидом кремния(1 V )
14. В каких рядах кислоты расположены в порядке увеличения кислотных свойств?
1) пропионовая — -> уксусная —> муравьиная
2) хлоруксусная —> уксусная —> муравьиная
3) уксусная —> хлоруксусная —> дихлоруксусная
4) дихлоруксусная —> хлоруксусная —>уксусная
5) масляная —> уксусная—> муравьиная
6) муравьиная —>уксусная —> 2,2-диметилпропановая
15. Какие реакции спиртов происходят за счет разрыва связи С — О?
16. К реакциям окисления, характеризующим свойства кислородсодержащих соединений, относятся
1) RCHO + Ag 2 О —>RCOOH + 2Ag
3) 2ROH —> R- О -R + H 2 0
4) RCH 2 OH + CuO —> RCHO + Cu + H 2 О
6) 2RCHO + О 2 —>2R-COOH
17. Окисление ацетальдегида происходит в результате реакций, уравнения которых:
18. Метановая кислота взаимодействует с:
2) оксидом серебра (NH 3 р-р)
3) сульфатом меди (II)
4) оксидом магния
19. Этановая кислота взаимодействует с
1) гидроксидом меди (II)
5) нитратом железа (III)
20. Фенол взаимодействует с веществами:
3) гидроксид калия
21. Пропионовая кислота взаимодействует с веществами:
4) карбонат натрия
22. Пропаналь взаимодействует с
4) гидроксидом меди (II)
23. В отличие от метанола фенол
1) взаимодействует с гидроксидом натрия
2) вступает в реакции поликонденсации
3) взаимодействует с альдегидами
4) при окислении образует формальдегид
5) вступает в реакции этерификации
6) реагирует с хлоридом железа (III)
24. С разрывом связи О-Н у спиртов происходят реакции, уравнения которых
25. В отличие от одноатомных предельных спиртов фенолы
1) взаимодействуют с бромной водой
2) не реагируют со щелочами
3) вступают в реакции с хлоридом железа (III)
4) подвергаются межмолекулярной дегидратации
5) образуют сложные эфиры с карбоновыми кислотами
6) вступают в реакции поликонденсации
26. В отличие от этилового спирта фенол
1) взаимодействует с гидроксидом кальция
2) легко окисляется даже кислородом воздуха
📺 Видео
Спирты: химические свойства | Химия ЕГЭ для 10 класса | УмскулСкачать

СМАЕВ ГРОБИТ СЕРДЦЕ ХИМИЕЙ / разоблачениеСкачать

ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Все химические свойства спиртов | Химия ЕГЭ для 10 класса | УмскулСкачать

Химия 10 класс (Урок№6 - Одноатомные предельные спирты.)Скачать

Спирты. Ч.5-2. Химические свойства. Реакции по С-О связи в предельных одноатомных спиртах.Скачать

Спирты. Ч.5-4. Качественные реакции. Способы идентификации предельных одноатомных спиртов.Скачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

7.1. Спирты: Номенклатура, классификация, изомерия. ЕГЭ по химииСкачать

Органика. Механизм реакции этерификации (карбоновая кислота + спирт)Скачать

8.3. Многоатомные спирты (этиленгликоль, глицерин): Химические свойства. ЕГЭ по химииСкачать

7.3. Спирты: Способы получения. ЕГЭ по химииСкачать

Получение спиртов с помощью реактивов Гриньяра, часть 1Скачать

Реакции присоединения и полимеризации в органике | Химия ЕГЭ | УмскулСкачать

Реакции присоединения | Химия 10 класс | УмскулСкачать

Спирты и фенолы: цепочки. Часть 2/3. 10 класс и ЕГЭ по химииСкачать

Спирты и фенолы: цепочки. Часть 1/3. 10 класс и ЕГЭ по химииСкачать

Окисление ВСЕХ органических веществ за 4 часа | Химия ЕГЭ 2023 | УмскулСкачать

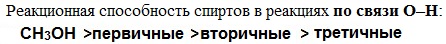

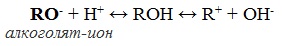 Кислотные свойства уменьшаются в ряду, а основные возрастают:
Кислотные свойства уменьшаются в ряду, а основные возрастают: