Химия | 10 — 11 классы
Составить уравнение электролиза CaCl2 с использованием инертных электродов.
( — )катод 2H⁺ + 2e = H2°
( + ) анод 2Сl⁻ — 2e = Cl2°
CaCl2 + 2HOH = Ca(OH)2 + H2↑ + Cl2↑.
- Напишите уравнения электролиза водных раствором йодида калия, сульфата кальция с инертными электродам?
- Написать электронные уравнения реакций, происходящих на электродах при электролизе водного раствора сульфата кадмия : 1?
- Составить схемы электролиза и написать уравнения элек — тродных процессов, протекающих при электролизе водных раство — ров серной кислоты и нитрата свинца (II) с инертными электродами?
- При электролизе раствора какой соли на аноде выделяется кислород?
- ЭЛЕКТРОЛИЗ ВОДНОГО РАСТВОРА ЙОДИДА КАЛИЯ С ИНЕРТНЫМИ ЭЛЕКТРОДАМИ?
- Напишите уравнение электролиза раствора CaI2 на инертных электродах?
- Уравнение электролиза водного раствора сульфата железа на инертном электроде?
- Друзья, пожалуйста, напишите уравнение электролиза водного раствора хлорида железа (III), на инертном электроде?
- Напишите уравнения реакций, протекающих при электролизе расплава LiI с инертными электродами?
- Какие процессы будут протекать на инертных электродах при электролизе расплава AuCl3?
- Электронные уравнения процессов, происходящих на электродах при электролизе растворов солей
- Решение задач по химии на электролиз соли
- Электролиз
- Электролиз
- Электролиз растворов
- Катодные процессы
- Анодные процессы
- Суммарные процессы электролиза
- Электролиз расплавов
- Электролиз с растворимыми электродами
- 📽️ Видео
Видео:Электролиз. Часть 7. Электролиз с растворимым анодомСкачать

Напишите уравнения электролиза водных раствором йодида калия, сульфата кальция с инертными электродам?
Напишите уравнения электролиза водных раствором йодида калия, сульфата кальция с инертными электродам.
Видео:Электролиз. 10 класс.Скачать

Написать электронные уравнения реакций, происходящих на электродах при электролизе водного раствора сульфата кадмия : 1?
Написать электронные уравнения реакций, происходящих на электродах при электролизе водного раствора сульфата кадмия : 1.
С инертными электродами 2.
С кадмиевым анодом.
Видео:Электролиз растворов. 3 часть. 10 класс.Скачать
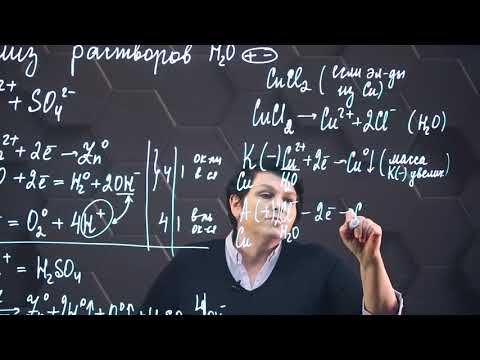
Составить схемы электролиза и написать уравнения элек — тродных процессов, протекающих при электролизе водных раство — ров серной кислоты и нитрата свинца (II) с инертными электродами?
Составить схемы электролиза и написать уравнения элек — тродных процессов, протекающих при электролизе водных раство — ров серной кислоты и нитрата свинца (II) с инертными электродами.
Видео:Все об электролизе и задании 20 за 20 минут | Химия ЕГЭ 2023 | УмскулСкачать

При электролизе раствора какой соли на аноде выделяется кислород?
При электролизе раствора какой соли на аноде выделяется кислород?
Видео:Как писать уравнения электролиза? | Химия ЕГЭ 2022 | УмскулСкачать

ЭЛЕКТРОЛИЗ ВОДНОГО РАСТВОРА ЙОДИДА КАЛИЯ С ИНЕРТНЫМИ ЭЛЕКТРОДАМИ?
ЭЛЕКТРОЛИЗ ВОДНОГО РАСТВОРА ЙОДИДА КАЛИЯ С ИНЕРТНЫМИ ЭЛЕКТРОДАМИ.
Видео:Электролиз растворов. 2 часть. 10 класс.Скачать

Напишите уравнение электролиза раствора CaI2 на инертных электродах?
Напишите уравнение электролиза раствора CaI2 на инертных электродах.
Видео:Электролиз растворов. 1 часть. 10 класс.Скачать

Уравнение электролиза водного раствора сульфата железа на инертном электроде?
Уравнение электролиза водного раствора сульфата железа на инертном электроде.
Видео:Часть 3-2. Электролиз водных растворов. Примеры решений уравнений (подробно).Скачать

Друзья, пожалуйста, напишите уравнение электролиза водного раствора хлорида железа (III), на инертном электроде?
Друзья, пожалуйста, напишите уравнение электролиза водного раствора хлорида железа (III), на инертном электроде.
Видео:Задачи на электролиз с растворимым анодом.Скачать

Напишите уравнения реакций, протекающих при электролизе расплава LiI с инертными электродами?
Напишите уравнения реакций, протекающих при электролизе расплава LiI с инертными электродами.
Видео:Химия / 9 класс / ЭлектролизСкачать

Какие процессы будут протекать на инертных электродах при электролизе расплава AuCl3?
Какие процессы будут протекать на инертных электродах при электролизе расплава AuCl3?
На этой странице сайта размещен вопрос Составить уравнение электролиза CaCl2 с использованием инертных электродов? из категории Химия с правильным ответом на него. Уровень сложности вопроса соответствует знаниям учеников 10 — 11 классов. Здесь же находятся ответы по заданному поиску, которые вы найдете с помощью автоматической системы. Одновременно с ответом на ваш вопрос показаны другие, похожие варианты по заданной теме. На этой странице можно обсудить все варианты ответов с другими пользователями сайта и получить от них наиболее полную подсказку.
2KMnO4 + 16HCl — > 2MnCl2 + 5Cl2 + 2KCl + 8H2O K( + )Mn( + 7)O( — 2) + H( + )Cl( — ) — > Mn( + 2)Cl( — ) + Cl(0) + K( + )Cl( — ) + H( + )O( — 2) Mn( + 7) + 5e — > Mn( + 2) 2 в — ие ок — ль 2Cl( — ) — 2e — > Cl2(0) 5 ок — ие в — ль 2NH3 + 3CuO — > 3Cu..
Cu — металлическая связь CuO — ионная связь N2 — ковалентная неполярная связь N2O5 — ковалентная полярная связь Na2O — ионная связь.
А) Mr(Cu2O) = 64 * 2 + 16 = 144 Mr(KNO3) = 39 + 14 + 16 * 3 = 101 Mr(Na2SiO3) = 23 * 2 + 28 + 16 * 3 = 122 Mr(H3PO4) = 1 * 3 + 31 + 16 * 4 = 98 Б) Mr(Al2(SO4)3) = 27 * 2 + 32 * 3 + 16 * 12 = 342 Mr(H2SO4) = 1 * 2 + 32 + 16 * 4 = 98 Mr(K2S) = 39 * 2 +..
D — C — B — A Сначала пройтись магнитом, потом остаток растворить в воде, пропустить через фильтр, выпарить.
Для начала вычислим сколько моль делает 45 грамм NO. Молекулярная Масса NO 30 грамм. 45 / 30 = 1, 5 моль Следовательно , чтоб получить сколько молекул в 1, 5 моль вещества умножим его на 6, 02•10 ^ 23 1, 5•6, 02•10 ^ 23 = 9, 02•10 ^ 23 Количество в..
34, 98%СI — — — — 35. 5гCI x = 100 * 35. 5 / 34. 98 = 101г / моль 100% — — — — — — — — хг кислота 0, 99% Н — — — — — 1гН 100% — — — — — — — хг кислота х = 100 * 1 / 0, 99 = 101г / моль Ответ — M(HCIO4 ) = 101г / моль.
3NaOH + H3PO4 = Na3PO4 + 3H2O n(H3PO4) = 49 : 98 = 0. 5(моль) n(Na3PO4) = 0. 5(моль) m(Na3PO4) = 106помножити на 0. 5 = 53(г).
Ответ на задание смотри на фото.
Кислотные : Р2О5 Основные оксиды : СоО Безразличные : СО Кислотные гидроксиды : H2SO3 Основные гидроксиды : Fe(OH)2, Ba(OH)2 Амфотерные гидроксиды : Al(OH)3 Средние соли : Sn3(PO4)2, NaI Кислых солей нет Основные соли : AlOHCl2 Остался Cr2O3 — это ам..
Fe(OH)3, Sn(OH)2, Mg(HSiO3)2, KHCO3, Ba(OH)2, Ni(OH)2, Mn(OH)2, Na2HPO4, RbOH, Pb(OH)2, Fe(OH)3, Ca(HSO3)2.
Видео:ЭлектролизСкачать

Электронные уравнения процессов, происходящих на электродах при электролизе растворов солей
Видео:Часть 3-1. Электролиз расплава. Решаем примеры уравнений (подробно).Скачать

Решение задач по химии на электролиз соли
Задание 274.
Составьте электронные уравнения процессов, происходящих на графитовых электродах при электролизе раствора КВг. Какая масса вещества выделяется на катоде и аноде, если электролиз проводить в течение 1 ч 35 мин при силе тока 15 А? Ответ: 0,886 г; 70,79 г.
Решение:
Стандартный электродный потенциал системы К + + 
2Н2О + 2 
На аноде будет происходить электрохимическое окисление ионов Br-, приводящее к выделению брома:
2Br — — 2 
поскольку отвечающий этой системе стандартный электродный потенциал (+1,07 В) значительно ниже, чем стандартный потенциал (+1,23 В), характеризующий систему:
2Н2О — 4 
Массу веществ, выделившихся на электродах находим из уравнения Фарадея, имея в виду, что 1 ч 35 мин = 5700 с и МЭ(Н2) = 1 г/моль, МЭ(Br2) = 79,916 г/моль получим:
m(B) = МЭ(B) . I . t/F
m(H2) = МЭ(H2) . I . t/F = 1 . 15 . 5700/96500 = 0,886 г;
m(Br2) = МЭ(Br2) . I . t/F = 79,916 . 15 . 5700/96500 = 70,81 г.
m(B) – масса выделившегося вещества, г; МЭ(В) – масса эквивалента вещества, г/моль; I – сила тока, А; t – время, с; F – число Фарадея, 96500.
Ответ: m(H2) = 0,886 г; m(Br2) = 70,81 г.
Задание 275.
Составьте электронные уравнения процессов, происходящих на угольных электродах при электролизе раствора СuCl2. Вычислите массу меди, выделившейся на катоде, если на аноде выделилось 560 мл газа (н.у.). Ответ: 1,588 г.
Решение:
а) Электролиз соли хлорида меди на угольных электродах:
Стандартный электродный потенциал системы Cu 2+ + 2 
Cu 2+ + 2 
На аноде будет происходить электрохимическое окисление ионов Cl — , приводящее к выделению хлора:
2Cl — — 2 
поскольку отвечающий этой системе стандартный электродный потенциал (+1,36 В) значительно выше, чем стандартный потенциал (+1,23 В), характеризующий систему
2Н2О — 4 
Чтобы вычислить массу меди, выделившейся на катоде при электролизе CuCl2, рассчитаем количество эквивалентов хлора, выделившегося на аноде, зная его объём и эквивалентный объём, получим:
Эквивалентный объём хлора равен 11,2 л/моль. Тогда количество эквивалентов выделившегося хлора равно:
Так как (Cl2) = (Cu), то можно рассчитать массу выделившейся меди при электролизе CuCl2, получим:
m(Cu) = (Cu) . MЭ(Cu) = 0,05 . 31,77 = 1,588 г.
Ответ: m(Cu) = 1,588 г.
Задание 275.
Составьте электронные уравнения процессов, происходящих на угольных электродах при электролизе раствора СuCl2. Вычислите массу меди, выделившейся на катоде, если на аноде выделилось 560 мл газа (н.у.). Ответ: 1,588 г.
Решение:
а) Электролиз соли медного купороса на угольных электродах:
Стандартный электродный потенциал системы Cu 2+ + 2 
Cu 2+ + 2 
На аноде будет происходить электрохимическое окисление ионов Cl — , приводящее к выделению хлора:
2Cl — — 2 
поскольку отвечающий этой системе стандартный электродный потенциал (+1,36 В) значительно ниже, чем стандартный потенциал (+1,23 В), характеризующий систему
2Н2О — 4 
Чтобы вычислить массу меди, выделившейся на катоде при электролизе CuCl2, рассчитаем количество эквивалентов хлора, выделившегося на аноде, зная его объём и эквивалентный объём, получим:
Эквивалентный объём хлора равен 11,2 л/моль. Тогда количество эквивалентов выделившегося хлора равно:
Так как (Cl2) = (Cu), то можно рассчитать массу выделившейся меди при электролизе CuCl2, получим:
m(Cu) = (Cu) . MЭ(Cu) = 0,05 . 31,77 = 1,588 г.
Ответ: m(Cu) = 1,588 г.
Задание 276.
При электролизе соли трехвалентного металла при силе тока 1,5 А в течение 30 мин на катоде выделилось 1,071 г металла. Вычислите атомную массу металла. Ответ: 114,835.
Решение:
Эквивалентную массу металла рассчитаем из уравнения Фарадея относительно массы вещества, подставив в него данные из задачи, получим:
m(В) = МЭ(В) . I . t/F;
МЭ(Ме) = m(В) . F/(I . t) = (1,071 . 96500)/(1,5 . 60 . 30) = 38,278 г/моль.
Здесь m(B) – масса выделившегося вещества, г; VЭ – эквивалентный объём газа, л/моль; МЭ(В) – масса эквивалента вещества, г/моль; I – сила тока, А; t – время, с; F – число Фарадея, 96500 Кл/моль.
Учитывая, что металл трёхвалентный рассчитаем его атомную массу:
Аr(Ме) = МЭ(Ме) . В = 38,278 . 3 = 114,835, где В – валентность металла.
Видео:Электролиз. Часть 2. Уравнения электролиза расплавов и растворов.Скачать

Электролиз
Видео:Электролиз. Решение задач. 1 часть. 10 класс.Скачать

Электролиз
Химические реакции, сопровождающиеся переносом электронов (окислительно-восстановительные реакции) делятся на два типа: реакции, протекающие самопроизвольно и реакции, протекающие при прохождении тока через раствор или расплав электролита.
Раствор или расплав электролита помещают в специальную емкость — электролитическую ванну .
Электрический ток — это упорядоченное движение заряженных частиц — ионов, электронов и др. под действием внешнего электрического поля. Электрическое поле в растворе или расплаве электролита создают электроды .
Электроды — это, как правило, стержни из материала, проводящего электрический ток. Их помещают в раствор или расплав электролита, и подключают к электрической цепи с источником питания.
При этом отрицательно заряженный электрод катод — притягивает положительно заряженные ионы — катионы . Положительно заряженный электрод ( анод ) притягивает отрицательно заряженные частицы ( анионы ). Катод выступает в качестве восстановителя, а анод — в качестве окислителя.
Различают электролиз с активными и инертными электродами. Активные (растворимые) электроды подвергаются химическим превращениям в процессе электролиза. Обычно их изготавливают из меди, никеля и других металлов. Инертные (нерастворимые) электроды химическим превращениям не подвергаются. Их изготавливают из неактивных металлов, например, платины , или графита .
Видео:Электролиз расплавов и растворов солей.Теория для задания 22 ЕГЭ по химииСкачать
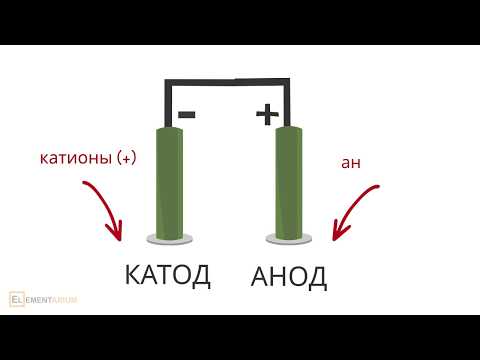
Электролиз растворов
Различают электролиз раствора или расплава химического вещества. В растворе присутствует дополнительное химическое вещество — вода, которая может принимать участие в окислительно-восстановительных реакциях.
Катодные процессы
В растворе солей катод притягивает катионы металлов. Катионы металлов могут выступать в качестве окислителей. Окислительные способности ионов металлов различаются. Для оценки окислительно-восстановительных способностей металлов применяют электро-химический ряд напряжений :
Каждый металл характеризуется значением электрохимического потен-циала. Чем меньше потенциал , тем больше восстановительные свойства металла и тем меньше окислительные свойства соответствующего иона этого металла. Разным ионам соответствуют разные значения этого потенциала. Электрохимический потенциал — относительная величина. Электрохимический потенциал водорода принят равным нулю.
Также около катода находятся молекулы воды Н2О. В составе воды есть окислитель — ион H + .
При электролизе растворов солей на катоде наблюдаются следующие закономерности:
1. Если металл в соли — активный ( до Al 3+ включительно в ряду напряжений ), то вместо металла на катоде восстанавливается (разряжается) водород , т.к. потенциал водорода намного больше. Протекает процесс восстановления молекулярного водорода из воды, при этом образуются ионы OH — , среда возле катода — щелочная:
2H2O +2ē → H2 + 2OH —
Например , при электролизе раствора хлорида натрия на катоде будет вос-станавливаться только водород из воды.
2. Если металл в соли – средней активности (между Al 3+ и Н + ) , то на катоде восстанавливается (разряжается) и металл , и водород , так как потенциал таких металлов сравним с потенциалом водорода:
Me n+ + nē → Me 0
2 H + 2O +2ē → H2 0 + 2OH —
Например , при электролизе раствора сульфата железа (II) на катоде будет восстанавливаться (разряжаться) и железо, и водород:
Fe 2+ + 2ē → Fe 0
2 H + 2O +2ē → H2 0 + 2OH —
3. Если металл в соли — неактивный (после водорода в ряду стандартных электрохимических металлов) , то ион такого металла является более сильным окислителем, чем ион водорода, и на катоде восстанавливается только металл:
Me n+ + nē → Me 0
Например, при электролизе раствора сульфата меди (II) на катоде будет восстанавливаться медь:
Cu 2+ + 2ē → Cu 0
4. Если на катод попадают катионы водорода H + , то они и восстанавливаются до молекулярного водорода:
2H + + 2ē → H2 0
Анодные процессы
Положительно заряженный анод притягивает анионы и молекулы воды. Анод – окислитель. В качестве восстановителей выступаю либо анионы кислотных остаток, либо молекулы воды (за счет кислорода в степени окисления -2: H 2 O -2 ).
При электролизе растворов солей на аноде наблюдаются следующие закономерности:
1. Если на анод попадает бескислородный кислотный остаток , то он окисляется до свободного состояния (до степени окисления 0):
неМе n- – nē = неМе 0
Например : при электролизе раствора хлорида натрия на аноде окисляют-ся хлорид-ионы:
2Cl — – 2ē = Cl2 0
Действительно, если вспомнить Периодический закон: при увеличении электроотрицательности неметалла его восстановительные свойства уменьшаются. А кислород – второй по величине электроотрицательности элемент. Таким образом, проще окислить практически любой неметалл, а не кислород. Правда, есть одно исключение . Наверное, вы уже догадались. Конечно же, это фтор. Ведь электроотрицательность фтора больше, чем у кислорода. Таким образом, при электролизе растворов фторидов окисляться будут именно молекулы воды, а не фторид-ионы :
2H2 O -2 – 4ē → O2 0 + 4H +
2. Если на анод попадает кислородсодержащий кислотный остаток, либо фторид-ион , то окислению подвергается вода с выделением молекулярно-го кислорода:
2H2 O -2 – 4ē → O2 0 + 4H +
3. Если на анод попадает гидроксид-ион, то он окисляется и происходит выделение молекулярного кислорода:
4 O -2 H – – 4ē → O2 0 + 2H2O
4. При электролизе растворов солей карбоновых кислот окислению под-вергается атом углерода карбоксильной группы, выделяется углекислый газ и соответствующий алкан.
Например , при электролизе растворов ацетатов выделяется углекислый газ и этан:
2 CH3 C +3 OO – –2ē → 2 C +4 O2+ CH3-CH3
Суммарные процессы электролиза
Рассмотрим электролиз растворов различных солей.
Например , электролиз раствора сульфата меди. На катоде восстанавливаются ионы меди:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются молекулы воды:
Анод (+): 2H2 O -2 – 4ē → O2 + 4H +
Сульфат-ионы в процессе не участвуют. Мы их запишем в итоговом уравнении с ионами водорода в виде серной кислоты:
2 Cu 2+ SO4 + 2H2 O -2 → 2 Cu 0 + 2H2SO4 + O2 0
Электролиз раствора хлорида натрия выглядит так:
На катоде восстанавливается водород:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются хлорид-ионы:
Анод (+): 2 Cl – – 2ē → Cl2 0
Ионы натрия в процессе электролиза не участвуют. Мы записываем их с гидроксид-анионами в суммарном уравнении электролиза раствора хлорида натрия :
2 H + 2O +2Na Cl – → H2 0 + 2NaOH + Cl2 0
Следующий пример : электролиз водного раствора карбоната калия.
На катоде восстанавливается водород из воды:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются молекулы воды до молекулярного кислорода:
Анод (+): 2H2 O -2 – 4ē → O2 0 + 4H +
Таким образом, при электролизе раствора карбоната калия ионы калия и карбонат-ионы в процессе не участвуют. Происходит электролиз воды:
2 H2 + O -2 → 2 H2 0 + O2 0
Еще один пример : электролиз водного раствора хлорида меди (II).
На катоде восстанавливается медь:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются хлорид-ионы до молекулярного хлора:
Анод (+): 2 Cl – – 2ē → Cl2 0
Таким образом, при электролизе раствора карбоната калия происходит электролиз воды:
Cu 2+ Cl2 – → Cu 0 + Cl2 0
Еще несколько примеров: электролиз раствора гидроксида натрия.
На катоде восстанавливается водород из воды:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются гидроксид-ионы до молекулярного кислорода:
Анод (+): 4 O -2 H – – 4ē → O2 0 + 2H2O
Таким образом, при электролизе раствора гидроксида натрия происходит разложение воды, катионы натрия в процессе не участвуют:
2 H2 + O -2 → 2 H2 0 + O2 0
Видео:ХИМИЯ 11 класс : Электролиз растворовСкачать

Электролиз расплавов
При электролизе расплава на аноде окисляются анионы кислотных остатков, а на катоде восстанавливаются катионы металлов. Молекул воды в системе нет.
Например: электролиз расплава хлорида натрия. На катоде восстанавли-ваются катионы натрия:
Катод (–): Na + + ē → Na 0
На аноде окисляются анионы хлора:
Анод (+): 2 Cl – – 2ē → Cl2 0
Суммарное уравнение электролиза расплава хлорида натрия:
2 Na + Cl – → 2 Na 0 + Cl2 0
Еще один пример: электролиз расплава гидроксида натрия. На катоде восстанавливаются катионы натрия:
Катод (–): Na + + ē → Na 0
На аноде окисляются гидроксид-ионы:
Анод (+): 4 OH – – 4ē → O2 0 + 2H2O
Суммарное уравнение электролиза расплава гидроксида натрия:
4 Na + OH – → 4 Na 0 + O2 0 + 2H2O
Многие металлы получают в промышленности электролизом расплавов.
Например , алюминий получают электролизом раствора оксида алюминия в расплаве криолита. Криолит – Na3[AlF6] плавится при более низкой температуре (1100 о С), чем оксид алюминия (2050 о С). А оксид алюминия отлично растворяется в расплавленном криолите.
В растворе криолите оксид алюминия диссоциирует на ионы:
На катоде восстанавливаются катионы алюминия:
Катод (–): Al 3+ + 3ē → Al 0
На аноде окисляются алюминат-ионы:
Анод (+): 4Al O 3 3 – – 12ē → 2Al2O3 + 3 O2 0
Общее уравнение электролиза раствора оксида алюминия в расплаве криолита:
2 Al 2 О 3 = 4 Al 0 + 3 О 2 0
В промышленности при электролизе оксида алюминия в качестве электродов используют графитовые стержни. При этом электроды частично окисляются (сгорают) в выделяющемся кислороде:
C 0 + О2 0 = C +4 O2 -2
Видео:Электролиз расплавов и растворов. 10 класс.Скачать

Электролиз с растворимыми электродами
Если материал электродов выполнен из того же металла, который присут-ствует в растворе в виде соли, или из более активного металла, то на аноде разряжаются не молекулы воды или анионы, а окисляются частицы самого металла в составе электрода.
Например , рассмотрим электролиз раствора сульфата меди (II) с медными электродами.
На катоде разряжаются ионы меди из раствора:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются частицы меди из электрода :
Анод (+): Cu 0 – 2ē → Cu 2+
📽️ Видео
Электролиз раствора KIСкачать

Электролиз расплавов и растворов. 1 часть. 10 класс.Скачать














