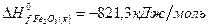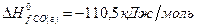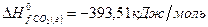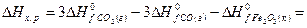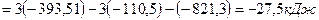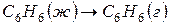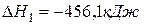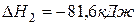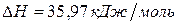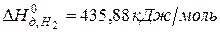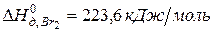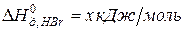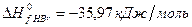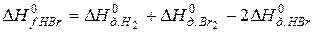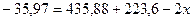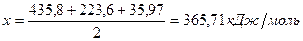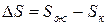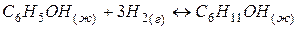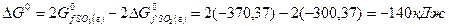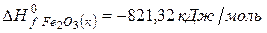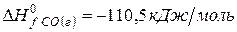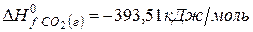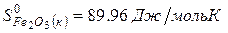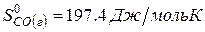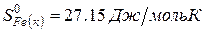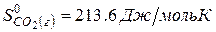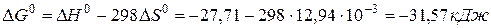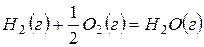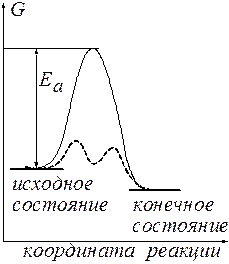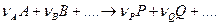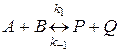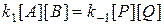Рассчитайте стандартную энтальпию (тепловой эффект) реакции
Укажите, будет ли данная реакция экзо- или эндотермической?
РЕШЕНИЕ
| Вещество | SO2 | H2S | S | H2O |
| ∆Н r 0 | кДж/моль | -297 | -20,15 | -285,84 |
| n | моль |
Ответ: Стандартная энтальпия реакции равна -234,5 кДж.
Реакция экзотермическая, так как ∆Н r 0 0 = -584 кДж
рассчитайте стандартную энтальпию (теплоту) образования продукта.
РЕШЕНИЕ
| вещество | FeO | O2 | Fe2O3 |
| ∆Н r 0 | кДж/моль | -206 | ? |
| n | моль |
Ответ: Стандартная энтальпия (теплота) образования оксида железа (ΙΙΙ) равна — 824 кДж/моль.
ПРИМЕР 3
Рассчитайте значение стандартной энтальпии (теплоты) образования этана из простых веществ
по следующим термохимическим уравнениям:
РЕШЕНИЕ
Для вычисления стандартной энтальпии (теплового эффекта ∆Н r 0 ) реакции образования этана из простых веществ по уравнению
следует уравнение (б) умножить на 2, уравнение (в) — на 3, а затем сумму этих уравнений вычесть из уравнения (а):
После преобразования получим уравнение (1). Проведя такие же действия со стандартными энтальпиями данных реакций, получим стандартную энтальпию (теплоту) разложения этана:
Энтальпия образования равна энтальпии разложения с обратным знаком, поэтому стандартная энтальпия (теплота) образования этана ∆Н1 0 (C2H6)= — 84,67 кДж/моль.
ПРИМЕР 4
Вычислите количество теплоты, выделяющееся при получении 300 г метафосфорной кислоты НРОз из оксида фосфора Р205, пользуясь энтальпиями (теплотами) образования, кДж/моль:
Видео:78. Тепловой эффект реакции. Термохимические уравнения (часть 1)Скачать

Примеры решения типовых задач. Пример 1. Вычисление тепловых эффектов химических реакций по значениям теплот образования реагентов и продуктов реакции.
Пример 1. Вычисление тепловых эффектов химических реакций по значениям теплот образования реагентов и продуктов реакции.
Задача 1. Рассчитайте тепловой эффект реакции 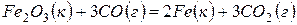
Решение. В соответствии со следствием из закона Гесса
Ответ: 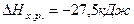
Пример 2. Вычисление изменения внутренней энергии.
Задача 1. Определите изменение внутренней энергии при испарении 46,8г бензола при 20 о С. Теплота испарения бензола при этой температуре составляет 30,92 кДж/моль. Пары бензола подчиняются законам идеальных газов.
Решение. Изменение внутренней энергии и тепловой эффект процесса связаны между собой соотношением
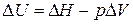
В соответствии с уравнением Менделеева-Клапейрона: 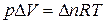
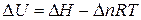
где 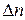
Для процесса испарения бензола
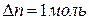
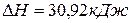
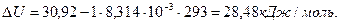
Число моль бензола составляет
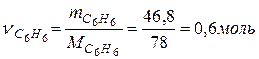
Тогда изменение внутренней энергии при испарении 48,6г бензола составляет 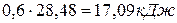
Пример 3. Определение теплового эффекта реакции на основе тепловых эффектов отдельных стадий процесса.
Задача 1. Даны три уравнения химических реакций:
(1) 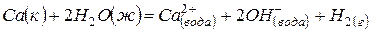
(2) 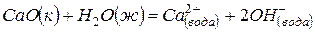
(3) 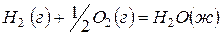
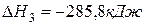
Определите тепловой эффект реакции 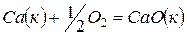
Решение. Любая сложная химическая реакция может быть представлена как алгебраическая сумма ее отдельных стадий. Нетрудно заметить, что реакция 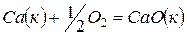
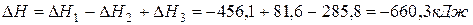
Пример 4. Расчет тепловых эффектов на основе энергий химических связей. Оценка энергий химических связей на основе теплового эффекта химической реакции с учетом энергии других разрывающихся и образующихся в химической реакции связей.
Задача 1. Рассчитайте энергию химической связи в молекуле HBr, если известны тепловой эффект реакции 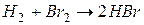
и энергии диссоциации молекул Н2 и Br2 .
Решение. Предположим, что процесс протекает через стадии диссоциации реагентов и образование молекулы HBr. Этот процесс можно представить совокупностью следующих стадий:
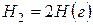

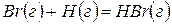
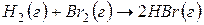
В соответствии с законом Гесса
откуда:
Таким образом, энергия связи HBr 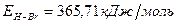
Пример 5. Определение знака изменения энтропии на основе структуры исходного и конечного состояний системы.
Задача 1. Как изменяется энтропия процесса таяния льда?
Решение. Изменение энтропии этого процесса характеризует величина
Кристаллическое состояние характеризуется высокой упорядоченностью, обусловленной структурой кристаллической решетки, в которой атомы жестко связаны между собой и имеют ограниченное число степеней свободы. Такая структура может быть представлена малым числом микросостояний. В жидком состоянии молекулы имеют большую свободу движений относительно друг друга, что обусловливает образование значительно большего числа комбинаций взаимного расположения молекул (микросостояний). Поэтому такое состояние имеет большие значения S, чем кристаллическое состояние, т.е. 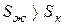
Пример 6. Определение знака изменения энтропии процесса на основе строения реагентов и продуктов реакции.
Задача 1. Как изменится энтропия процесса гидрирования фенола
Решение. Как и в предыдущем примере 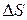
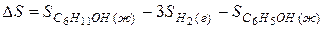
Из двух структур C6H11OH и C6H5OH первая является более высокоорганизованной, поскольку заключает в себе большее количество химических связей и большее число структурных единиц (атомов). Поэтому 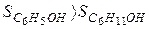
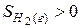
Пример 7. Выявление возможности протекания химической реакции по величине изменения энергии Гиббса.
Задача 1. В каком направлении будет протекать реакция 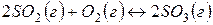
Решение. Изменение энергии Гиббса в данной реакции характеризуется равенством
Поскольку 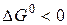
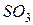
Пример 8. Вычисление изменение энергии Гиббса в химической реакции по значениям теплот образования и энтропий реагирующих веществ и продуктов реакции.
Задача 1. Вычислите изменение энергии Гиббса 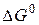
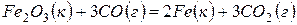
Решение. Воспользуемся для решения поставленных задач значениями теплот образования и энтропий реагентов и продуктов реакции:
Изменение энергии Гиббса в химической реакции при температуре Т можно рассчитать по уравнению
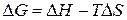
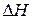
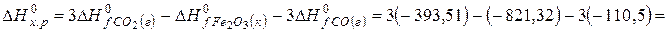
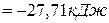
Изменение энтропии в соответствии с уравнением (6) выражается равенством:
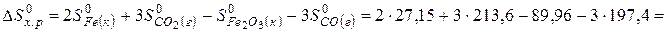
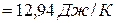
Изменение энергии Гиббса в химической реакции равно
Из результатов расчета ( 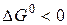
1.5. Химическая кинетика и равновесие
Кинетика – раздел химической науки, изучающий скорости химических реакций и факторы, влияющие на скорость реакций.
Термодинамика на основе значений 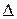
без каких-либо внешних воздействий не протекает в стандартных условиях, несмотря на его термодинамическую выгодность ( 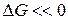
Рис.1 Энергетическая диаграмма реакции.
Можно видеть, что 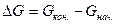
Уравнение скорости необратимой химической реакции
может быть выражено в следующей форме:
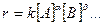
k – константа скорости, определяемая как величина скорости при единичных концентрациях реагентов [А]= 1 моль/л, [В]= 1 моль/л и т.д.;
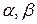
Сумма частных порядков реакции 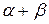
Уравнение (1) в концентрированном виде включает в себя действие различных факторов. К таким факторам относятся:
Концентрация реагентов является фактором ускорения химических реакций, поскольку, как правило, порядки реакции имеют положительное значение. Физически это легко объяснимо: с ростом концентрации возрастает количество молекул реагентов в единице объема, а следовательно, вероятность их столкновений, приводящих к химическому взаимодействию.
Давление выступает в качестве фактора ускорения процесса, когда реагент является газом. Так, если мы имеем дело с реакцией газообразных реагентов, то к каждому из них применимы газовые законы 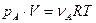
Из последнего выражения следует, что
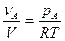
Поскольку 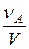
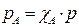
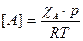
где: 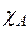
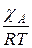
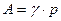
где 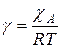
Таким образом, увеличение давления приводит к росту концентрации газообразных реагентов и в этой связи выступает как фактор скорости процесса.
Если реакционная система представляет собой систему газ – жидкость, то увеличение парциального давления газообразного реагента в соответствии с законом Генри приводит к увеличению его растворимости в жидкой реакционной массе, где, как правило, протекает реакция. Таким образом, и в этом случае давление выступает в качестве фактора увеличения концентрации реагента и, соответственно, фактора скорости процесса.
Влияние температуры на скорость реакции связано с ее влиянием на константу скорости. Основное уравнение, иллюстрирующее это влияние – уравнение Аррениуса:
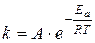
А – предэкспоненциальный множитель;
ЕА – энергия активации, имеющая смысл минимального избытка энергии, которым должна обладать реагирующая частица по сравнению с их средней энергией, чтобы прореагировать.
Ускоряющее действие температуры физически обосновывается увеличением с ростом температуры доли частиц, обладающих минимальным избытком энергии ЕА, гарантирующим им преодоление энергетического барьера.
Другое, менее строгое выражение для температурного влияния на скорость химической реакции – уравнение Вант-Гоффа:
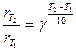
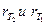
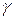
Действие катализатора как фактора ускорения процесса рассматривалось выше. Смысл ускоряющего действия катализатора – понижение энергетического барьера реакции (ЕА).
Реакции, в которых по мере накопления продуктов реакции последние вступают во взаимодействие между собой с образованием исходных реагентов, называются обратимыми.
По мере протекания этих реакций система приближается к состоянию равновесия, в котором скорости прямой и обратной реакций равны. Если на систему в состоянии равновесия не действуют какие-либо внешние факторы, то это состояние остается неизменным бесконечно долгое время и характеризуется постоянством состава реакционной массы.
Для обратимой химической реакции
состояние равновесия определяется равенством скоростей прямой и обратной реакций
Из последнего выражения следует, что
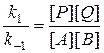
Поскольку является константой, то правая часть уравнения (5) также будет постоянной величиной, отражающей неизменность состава реакционной массы в состоянии равновесия. Величина 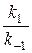
В стандартных условиях для обратимой реакции имеет место соотношение
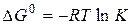
Руководствуясь этим соотношением и рисунком 1, можно показать, что катализатор, ускоряя прямую и обратную реакции, лишь ускоряет достижение равновесия, не влияя на его положение. Действительно, и в каталитической и в некаталитической реакции 
Принцип смещения равновесия (принцип Ле–Шателье) определяет направление смещения равновесия под действием различных факторов:
Если на систему, находящуюся в состоянии равновесия, оказывается внешнее воздействие, то равновесие смещается в сторону процесса, ослабляющего это воздействие.
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Тепловой эффект химической реакции. Термохимические уравнения
Тепловой эффект химической реакции. Термохимические уравнения.
Химические реакции протекают либо с выделением теплоты, либо с поглощением теплоты.
Экзотермические реакции протекают с выделением теплоты (теплота указывается со знаком «+»). Эндотермические реакции – с поглощением теплоты (теплота Q указывается со знаком «–»).
Тепловой эффект химической реакции – это изменение внутренней энергии системы вследствие протекания химической реакции и превращения исходных веществ (реагентов) в продукты реакции в количествах, соответствующих уравнению химической реакции.
При протекании химических реакций наблюдаются некоторые закономерности, которые позволяют определить знак теплового эффекта химической реакции:
- Реакции, которые протекают самопроизвольно при обыных условиях, скорее всего экзотермические. Для запуска экзотермических реакций может потребоваться инициация – нагревание и др.
Например, после поджигания горение угля протекает самопроизвольно, реакция экзотермическая:
- Реакции образования устойчивых веществ из простых веществ экзотермические, реакции разложения чаще всего – эндотермические.
Например, разложение нитрата калия сопровождается поглощением теплоты:
- Реакции, в ходе которых из менее устойчивых веществ образуются более устойчивые, чаще всего экзотермические. И наоборот, образование более устойчивых веществ из менее устойчивых сопровождается поглощением теплоты. Устойчивость можно примерно определить по активности и стабильности вещества при обычных условиях. Как правило, в быту нас окружают вещества сравнительно устойчивые.
Например, горение амиака (взаимодействие активных, неустойчивых веществ — аммиака и кислорода) приводит к образованию устойчивых веществ – азота и воды. Следовательно, реакция экзотермическая:
Количество теплоты обозначают буквой Q, измеряют в кДж (килоджоулях) или Дж (джоулях).
Количество теплоты, выделяющейся в результате реакции, пропорционально количеству вещества, вступившего в реакцию.
В термохимии используются термохимические уравнения . Это уравнение реакции с указанием количества теплоты, выделившейся в ней (на число моль вещества, равное коэффициентам в уравнении).
Например, рассмотрим термохимическое уравнение сгорания водорода:
Из термохимического уравнения видно, что 484 кДж теплоты выделяются при сгорании 2 моль водорода, 1 моль кислорода. Также можно сказать, что при образовании 2 моль воды выделяется 484 кДж теплоты.
Теплота образования вещества – количество теплоты, выделяющееся при образовании 1 моль данного вещества из простых веществ.
Например, при сгорании алюминия:
теплота образования оксида алюминия равна 1675 кДж/моль. Если мы запишем термохимическое уравнение без дробных коэффициентов:
теплота образования Al2O3 все равно будет равна 1675 кДж/моль, т.к. в термохъимическом уравнении приведен тепловой эффект образования 2 моль оксида алюминия.
Теплота сгорания – количество теплоты, выделяющееся при горении 1 моль данного вещества.
Например, при горении метана:
теплота сгорания метана равна 802 кДж/моль.
Разберемся, как решать задачи на термохимические уравнения (задачи на термохимию) из ЕГЭ. Для этого разберем несколько примеров термохимических задач.
1. В результате реакции, термохимическое уравнение которой:
получено 98 л (н.у.) оксида азота (II). Определите количество теплоты, которое затратили при этом (в кДж). (Запишите число с точностью до целых.).
Решение.
Из термохимического уравнения видно, что на образование 2 моль оксида азота (II) потребуется 180 кДж теплоты. 2 моль оксида азота при н.у. занимают объем 44,8 л. Составляем простую пропорцию:
на получение 44,8 л оксида азота (II) затрачено 180 кДж теплоты,
на получение 98 л оксида азота затрачено х кДж теплоты.
Отсюда х= 180*98/44,8 = 393,75 кДж. Округляем ответ до целых, как требуется в условии: Q=394 кДж.
Ответ: потребуется 394 кДж теплоты.
2. В результате реакции, термохимическое уравнение которой
выделилось 1452 кДж теплоты. Вычислите массу образовавшейся при этом воды (в граммах). (Запишите число с точностью до целых.)
Решение.
Из термохимического уравнения видно, что при образовании 2 моль воды выделится 484 кДж теплоты. Масса 2 моль воды равна 36 г. Составляем простую пропорцию:
при образовании 36 г воды выделится 484 кДж теплоты,
при образовании х г воды выделится 1452 кДж теплоты.
Отсюда х= 1452*36/484 = 108 г.
Ответ: образуется 108 г воды.
3. В результате реакции, термохимическое уравнение которой
израсходовано 80 г серы. Определите количество теплоты, которое выделится при этом (в кДж). (Запишите число с точностью до целых).
Решение.
Из термохимического уравнения видно, что при сгорании 1 моль серы выделится 296 кДж теплоты. Масса 1 моль серы равна 32 г. Составляем простую пропорцию:
при сгорании 32 г серы выделится 296 кДж теплоты,
при сгорании 80 г серы выделится х кДж теплоты.
Отсюда х= 80*296/32 = 740 кДж.
Ответ: выделится 740 кДж теплоты.
🌟 Видео
Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

Решение задач на термохимические уравнения. 8 класс.Скачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Задачи на ТЕПЛОВОЙ ЭФФЕКТ | Термохимические уравненияСкачать

Химия 9 класс (Урок№2 - Тепловой эффект химических реакций. )Скачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Тепловой эффект хим. реакции. Энтальпия. Закон Гесса. Капучинка ^-^Скачать

Тепловой эффект реакции. Задание №28 | Химия ЕГЭ | УмскулСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Расчёт тепловых эффектов реакций по табличным даннымСкачать
Тепловой эффект реакции. ЗадачиСкачать

Проклятая химическая реакция 😜 #shortsСкачать

Термохимические уравнения. Решение задач из ЕГЭ на тепловой эффект.Скачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Окислительно-восстановительные реакции. 1 часть. 9 класс.Скачать