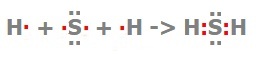FOR-DLE.ru — Всё для твоего DLE 😉
Привет, я Стас ! Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
ПРОВЕРЬТЕ СВОИ ЗНАНИЯ
Упражнение 1 Составьте схему образования химической связи для молекулы сероводорода.
Упражнение 2 Охарактеризуйте физические и химические свойства сероводорода.
Сероводород ― бесцветный газ, обладающий запахом тухлых яиц, немного тяжелее воздуха, растворяется в воде с образованием серной кислоты, ядовит.
Химические свойства сероводорода.
Реагирует со щелочами:
H2S + 2NaOH = Na2S + 2H2O
Проявляет сильные восстановительные свойства:
Очищают промышленные выбросы от сероводорода, окисляя его до серы оксидом серы (IV):
2H2S + SO2 = 3S + 2H2O
H2S -2 + S +4 O2 ⟶ S 0 + H2O
S -2 -2ē ⟶ S 0 |2|4|2 ― процесс окисления
S +4 +4ē ⟶ S 0 |4| |1 ― процесс восстановления
В приведённой реакции сероводород (за счёт атомов серы в степени окисления -2) — восстановитель, а оксид серы (IV) (за счёт атомов серы в степени окисления +4) — окислитель.
Очищают промышленные выбросы от сероводорода, окисляя его до серы кислородом в недостатке:
2H2S + O2(недостаток) = 2S↓ + 2H2O
H2S -2 + O2 0 ⟶ S 0 + H2O -2
S -2 -2ē ⟶ S 0 |2|4|2 ― процесс окисления
О2 0 +4ē ⟶ 2О -2 |4| |1 ― процесс восстановления
В приведённой реакции сероводород (за счёт атомов серы в степени окисления -2) — восстановитель, а кислород — окислитель.
В избытке кислорода сероводород горит:
2H2S + 3O2(избыток) = 2SO2 + 2H2O
H2S -2 + O2 0 ⟶ S +4 O2 -2 + 2H2O
S -2 -6ē ⟶ S +4 |6|12|2 ― процесс окисления
О2 0 +4ē ⟶ 2О -2 |4| |3 ― процесс восстановления
В приведённой реакции сероводород (за счёт атомов серы в степени окисления -2) — восстановитель, а кислород — окислитель.
Проявляет сильные восстановительные свойства и в растворах (сероводородная кислота):
H2S + Br2 = S↓ + 2HBr
H2S -2 + Br2 0 ⟶ S 0 + 2HBr -1
S -2 -2ē ⟶ S 0 |2|2|1 ― процесс окисления
Br2 0 +2ē ⟶ 2Br -1 |2| |1 ― процесс восстановления
В приведённой реакции сероводород (за счёт атомов серы в степени окисления -2) — восстановитель, а бром — окислитель.
Более сильные окислители способны окислять сероводород до оксида серы (IV) и даже серной кислоты:
H2S + 3H2SO4 (конц.) = 4SO2↑ + 4H2O
H2S -2 + H2S +6 O4 ⟶ S +4 O2 + H2O
S -2 -6ē ⟶ S +4 |6|6|1 ― процесс окисления
S +6 +2ē ⟶ S +4 |2| |3 ― процесс восстановления
В приведённой реакции сероводород (за счёт атомов серы в степени окисления -2) — восстановитель , а серная кислота (за счёт атомов серы в степени окисления +6) — окислитель.
H2S + 8HNO3 (конц.) = H2SO4 + 8NO2↑ + 4H2O
H2S -2 + HN +5 O3 ⟶ H2S +6 O4 + N +4 O2 + H2O
S -2 -8ē ⟶ S +6 |8|8|1 ― процесс окисления
N +5 +1ē ⟶ N +4 |1| |8 ― процесс восстановления
В приведённой реакции сероводород (за счёт атомов серы в степени окисления -2) — восстановитель , а азотная кислота (за счёт атомов азота в степени окисления +5) — окислитель.
Упражнение 3 Запишите сокращённое ионное уравнение качественной реакции на сульфид-ион.
Для обнаружения сероводородной кислоты и её солей в растворе используется растворимая соль свинца, в результате реакции образуется чёрный осадок сульфида свинца (II):
Pb 2+ + S 2- = PbS↓
ПРИМЕНИТЕ СВОИ ЗНАНИЯ
Упражнение 1 Напишите молекулярные и ионные уравнения реакций сероводородной кислоты с хлорной водой, гидроксидом лития, нитратом свинца (II), оксидом серы (IV). В окислительно-восстановительных реакциях расставьте коэффициенты методом электронного баланса, укажите окислители и восстановители.
H2S + Cl2 = S↓ + 2HCl
Схема окислительно-восстановительной реакции.
H2S -2 + Cl2 0 → S 0 + 2HCl -1
S -2 -2ē ⟶ S 0 | 2|2|1 ― процесс окисления
Cl2 0 +2ē ⟶ 2Cl -1 | 2| |1 ― процесс восстановления
Проводим вертикальную черту и пишем за ней число электронов, которые отдали и присоединили атомы серы и хлора. Находим наименьшее общее кратное для чисел 2 и 2. Это число 2, которое записываем за второй вертикальной чертой посередине, и поделив его поочередно на 2 и 2, записываем результат за третьей чертой в строках, касающихся элементов серы и хлора. Множители 1 и 1 являются искомыми коэффициентами. Поскольку эти элементы изменили степень окисления полностью (в правой части схемы этот элемент ни в одном веществе не проявляет такую же степень окисления, как в исходном веществе) и одинаковыми являются индексы элемента серы в формуле исходного вещества и продукта реакции, поэтому ставим коэффициент 1 (который обычно не пишем) перед формулой двух соединений серы (H2S, S), а разными являются индексы элемента хлора в формуле исходного вещества и продукта реакции — коэффициент 1 (который обычно не пишем) только перед формулой хлора Сl2. Подбираем коэффициенты для остальных соединений.
В приведённой реакции сероводород (за счёт атомов серы в степени окисления -2) — восстановитель, а хлор — окислитель.
2H2S+ SO2 = 3S + 2H2O
Схема окислительно-восстановительной реакции.
H2S -2 + S +4 O2 ⟶ S 0 + H2O
S -2 -2ē ⟶ S 0 | 2|4|х2 ― процесс окисления
S +4 +4ē ⟶ S 0 |4 | |х1 ― процесс восстановления
Проводим вертикальную черту и пишем за ней число электронов, которые отдали и присоединили атомы серы. Находим наименьшее общее кратное для чисел 2 и 4. Это число 4, которое записываем за второй вертикальной чертой посередине, и поделив его поочередно на 2 и 4, записываем результат за третьей чертой в строках, касающихся элементов серы. Числа в последнем столбце ― 2 и 1― это дополнительные множители в схемах соответствующих процессов:
2S -2 -4ē ⟶ 2S 0
S +4 +4ē ⟶ S 0
Добавим почленно эти уравнения, получим суммарную схему:
2S -2 + S +4 ⟶ 3S 0
Эти коэффициенты переносим в уравнение реакции:
2H2S + SO2 ⟶ 3S + H2O
Проверяем, уравнялось ли число атомов элементов, которых не было в схемах окисления и восстановления. Число атомов водорода разное, уравниваем его, поэтому ставим коэффициент 2 перед формулой Н2О:
2H2S + SO2 ⟶ 3S + 2H2O
Число атомов кислорода одинаковое: по 2 атома.
В приведённой реакции сероводород (за счёт атомов серы в степени окисления -2) — восстановитель, а оксид серы (IV) (за счёт атомов серы в степени окисления +4) — окислитель.
Упражнение 2 Напишите уравнения реакций, с помощью которых можно осуществить превращения по схеме:
ZnS ⟶ H2S ⟶ S ⟶ FeS ⟶ SO2. Для окислительно-восстановительных реакций расставьте коэффициенты методом электронного баланса, укажите окислители и восстановители.
ZnS + 2HCl = ZnCl2 + H2S↑
ZnS + 2H + + 2Cl — = Zn 2+ + 2Cl — + H2S↑
ZnS + 2H + = Zn 2+ + H2S↑
2H2S+ SO2 = 3S + 2H2O
Схема окислительно-восстановительной реакции.
H2S -2 + S +4 O2 ⟶ S 0 + H2O
S -2 -2ē ⟶ S 0 | 2|4|х2 ― процесс окисления
S +4 +4ē ⟶ S 0 |4 | |х1 ― процесс восстановления
Проводим вертикальную черту и пишем за ней число электронов, которые отдали и присоединили атомы серы. Находим наименьшее общее кратное для чисел 2 и 4. Это число 4, которое записываем за второй вертикальной чертой посередине, и поделив его поочередно на 2 и 4, записываем результат за третьей чертой в строках, касающихся элементов серы. Числа в последнем столбце ― 2 и 1― это дополнительные множители в схемах соответствующих процессов:
2S -2 -4ē ⟶ 2S 0
S +4 +4ē ⟶ S 0
Добавим почленно эти уравнения, получим суммарную схему:
2S -2 + S +4 ⟶ 3S 0
Эти коэффициенты переносим в уравнение реакции:
2H2S + SO2 ⟶ 3S + H2O
Проверяем, уравнялось ли число атомов элементов, которых не было в схемах окисления и восстановления. Число атомов водорода разное, уравниваем его, поэтому ставим коэффициент 2 перед формулой Н2О:
2H2S + SO2 ⟶ 3S + 2H2O
Число атомов кислорода одинаковое: по 2 атома.
В приведённой реакции сероводород (за счёт атомов серы в степени окисления -2) — восстановитель, а оксид серы (IV) (за счёт атомов серы в степени окисления +4) — окислитель.
S + Fe = FeS
Схема окислительно-восстановительной реакции.
S 0 + Fe 0 ⟶ Fe +2 S -2
Восстановитель Fe 0 — 2ē ⟶ Fe +2 | 2|2|1 ― процесс окисления
Окислитель S 0 + 2ē ⟶ S -2 | 2| |1 ― процесс восстановления
Проводим вертикальную черту и пишем за ней число электронов, которые отдали и присоединили атомы железа и серы. Находим наименьшее общее кратное для чисел 2 и 2. Это число 2, которое записываем за второй вертикальной чертой посередине, и поделив его поочередно на 2 и 2, записываем результат за третьей чертой в строках, касающихся элементов железа и серы. Множители 1 и 1 являются искомыми коэффициентами. Поскольку эти элементы изменили степень окисления полностью (в правой части схемы этот элемент ни в одном веществе не проявляет такую же степень окисления, как в исходном веществе) и одинаковыми являются индексы этих элементов в формуле исходного вещества и продукта реакции, поэтому ставим коэффициент 1 (который обычно не пишем) перед формулой всех соединений (S, Fe, FeS) .
2FeS + 3O2 = 2FeO + 2SO2
Схема окислительно-восстановительной реакции.
FeS -2 + O2 0 ⟶ FeO + S +4 O2 -2
S -2 -6ē ⟶ S +4 |6|12|2 ― процесс окисления
O2 0 +4ē ⟶ 2O -2 |4 | |3 ― процесс восстановления
Проводим вертикальную черту и пишем за ней число электронов, которые отдали и присоединили атомы серы и кислорода. Находим наименьшее общее кратное для чисел 6 и 4. Это число 12, которое записываем за второй вертикальной чертой посередине, и поделив его поочередно на 6 и 4, записываем результат за третьей чертой в строках, касающихся элементов серы и кислорода. Множители 2 и 3 являются искомыми коэффициентами. Поскольку элемент сера изменил степень окисления полностью (в правой части схемы этот элемент ни в одном веществе не проявляет такую же степень окисления, как в исходном веществе) и одинаковыми являются индексы этого элемента в формуле исходного вещества и продукта реакции, поэтому ставим коэффициент 2 перед формулой двух соединений серы (FeS, SO2). Поскольку часть атомов кислорода не восстановилась, а вошла в состав FeO, поэтому ставим коэффициент 3 перед формулой кислорода О2.
2FeS + 3O2 ⟶ FeO + 2SO2 . Подбираем коэффициенты для остальных соединений.
В приведённой реакции сульфид железа (II) (за счёт атомов серы в степени окисления -2) — восстановитель, а кислород — окислитель.
Упражнение 3 Напишите по одному молекулярному уравнению реакции, соответствующему каждому из следующих ионных уравнений:
а) H2S + OH — = HS — + H2O;
В левой части уравнения записана формула ионов, поэтому соединение, которое взаимодействует, должно быть растворимым и сильным электролитом. По таблице растворимости определяем в каких соединениях (берем во внимание только сильные электролиты) могут содержаться ионы OН — (LiOH, KOH, NaOH).
H2S + NaOH = NaHS + H2O
H2S + KOH = KHS + H2O
б) H2S + 2OH — = S 2- + 2H2O;
В левой части уравнения записана формула ионов, поэтому соединение, которое взаимодействует, должно быть растворимым и сильным электролитом. По таблице растворимости определяем в каких соединениях (берем во внимание только сильные электролиты) могут содержаться ионы OН — (LiOH, KOH, NaOH).
H2S + 2NaOH = Na2S + 2H2O
H2S + 2KOH = K2S + 2H2O
в) HS — + OH — = S 2- + H2O;
В левой части уравнения записано только формулы ионов, поэтому соединения, которые взаимодействуют, должны быть растворимыми и сильными электролитами. По таблице растворимости определяем в каких соединениях (берем во внимание только сильные электролиты) могут содержаться ионы HS — (LiHS, KHS, NaHS) и OH- (LiOH, NaOH, KOH).
NaHS + NaOH = Na2S + H2O
KHS + KOH = K2S + H2O
г) S 2- + Cu 2+ = CuS↓.
В левой части уравнения записано только формулы ионов, поэтому соединения, которые взаимодействуют, должны быть растворимыми и сильными электролитами. По таблице растворимости определяем в каких соединениях (берем во внимание только сильные электролиты) могут содержаться ионы HS — (Li2S, K2S, Na2S) и Cu 2+ (CuF2, CuCl2, CuI2, CuSO4, Cu(NO3)2).
K2S + CuSO4 = K2SO4 + CuS↓
Na2S + CuSO4 = Na2SO4 + CuS↓
K2S + CuCl2 = 2KCl + CuS↓
Na2S + CuCl2 = 2NaCl + CuS↓
Na2S + Cu(NO3)2 = 2NaNO3 + CuS↓
K2S + Cu(NO3)2 = 2KNO3 + CuS↓
Упражнение 4 В химической реакции, протекающей по уравнению 2Н2S+Сl2=2S+2НСl, концентрация газообразного хлора за 3 минуты уменьшилась с 0,063 моль/л до 0,027 моль/л. Рассчитайте скорость химической реакции в данный промежуток времени.
1. Рассчитаем изменение концентрации вещества:
Δс=0,063 моль/л — 0,027 моль/л=0,036 моль/л
2. Рассчитаем промежуток времени:
Δt=3 мин=3●60 с=180 с
3. Вычисляем скорость химической реакции по формуле v= Δс/Δt, где Δ с — изменение концентрации вещества; Δ t — промежуток времени, за который произошло данное изменение концентрации.
v=0,036 моль/л : 180 с=0,0002 моль/л●с=0,2 моль/л●с
Ответ: 0,2 ммоль/л●с
Упражнение 5 В состав белой краски (свинцовых белил), нередко использовавшейся ранее для написания икон, входил сульфат свинца (II). Спустя длительное время белая краска таких икон чернела из-за взаимодействия с сероводородом. Образующийся сульфид свинца (II) – соль чёрного цвета. Для восстановления белых тонов икону обрабатывали раствором пероксида водорода, при этом сульфид свинца (II) вновь окислялся до сульфата свинца (II). Составьте уравнение этой реакции, расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель.
PbS + 4H2O2 = PbSO4 + 4H2O
Схема окислительно-восстановительной реакции.
PbS -2 + H2O2 -1 ⟶ PbS +6 O4 -2 + H2O
S -2 -8ē ⟶ S +6 |8|8|1 ― процесс окисления
O -1 +2ē ⟶ O -2 |2 | |4 ― процесс восстановления
Проводим вертикальную черту и пишем за ней число электронов, которые отдали и присоединили атомы серы и кислорода. Находим наименьшее общее кратное для чисел 8 и 2. Это число 8, которое записываем за второй вертикальной чертой посередине, и поделив его поочередно на 8 и 2, записываем результат за третьей чертой в строках, касающихся элементов серы и кислорода. Множители 1 и 4 являются искомыми коэффициентами. Поскольку элемент сера изменил степень окисления полностью (в правой части схемы этот элемент ни в одном веществе не проявляет такую же степень окисления, как в исходном веществе) и одинаковыми являются индексы этого элемента в формуле исходного вещества и продукта реакции, поэтому ставим коэффициент 1 (который обычно не пишем) перед формулой двух соединений серы (PbS, PbSO4). Поскольку часть атомов кислорода не восстановилась, а вошла в состав H2O, поэтому ставим коэффициент 4 только перед формулой пероксида водорода H2О2.
PbS + 4H2O2 = PbSO4 + H2O. Подбираем коэффициенты для остальных соединений.
В приведённой реакции сульфид железа (II) (за счёт атомов серы в степени окисления -2) — восстановитель, а пероксид водорода (за счёт атомов кислорода в степени окисления -1) — окислитель.
- Составить уравнения реакций к следующим превращениям : а) FeS — H2S — K2S — PbS b) S — H2S — Na2S — PbS?
- Как осуществить следующие превращения : Zn — — H2S — — Na2S — — PbS?
- По ионным уравнениям реакций составьте молекулярное : H + OH⇒H2O, Pb² + H2S⇒PbS↓ + 2H?
- Закончите уравнение реакций?
- HNO3 + PbS — > ; составить ионное и молекулярное уравнение?
- Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения : S H2S SO2 Na2SO3 NaHSO3 SO2 H2S S K2S PbS?
- Осуществите превращения Pbo — Pb — PbS — PbO — PbSO4 — Pb(NO3)2?
- По краткому ионному уравнению составьте молекулярное уравнение реакции :а) Ag + + Cl — → AgCl↓б) S2 — + Pb2 + → PbS↓?
- Получите свинец из руды, содержащей сульфид свинца (PbS), запишите уравнения реакций?
- Краткое ионное уравнение реакции S2 — + Pb2 + = PbS¡?
- Предложите технологическую цепочку производства свинца из минерала галенита PbS?
- Осуществите превращения Н2S → S → К2S → PbS
- Ваш ответ
- решение вопроса
- Похожие вопросы
- 🔥 Видео
Видео:ВАЛЕНТНОСТЬ 8 КЛАСС ХИМИЯ // Урок Химии 8 класс: Валентность Химических ЭлементовСкачать

Составить уравнения реакций к следующим превращениям : а) FeS — H2S — K2S — PbS b) S — H2S — Na2S — PbS?
Химия | 5 — 9 классы
Составить уравнения реакций к следующим превращениям : а) FeS — H2S — K2S — PbS b) S — H2S — Na2S — PbS.
А)1. FeS + H2 = H2S + Fe 2.
H2S + 2KOH = K2S + 2H2O 3.
K2S + PbCl2 = PbS + 2KCl
H2S + 2NaOH = Na2S + 2H2O 3.
Na2S + PbCl2 = PbS + 2NaCl.
Видео:Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

Как осуществить следующие превращения : Zn — — H2S — — Na2S — — PbS?
Как осуществить следующие превращения : Zn — — H2S — — Na2S — — PbS?
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

По ионным уравнениям реакций составьте молекулярное : H + OH⇒H2O, Pb² + H2S⇒PbS↓ + 2H?
По ионным уравнениям реакций составьте молекулярное : H + OH⇒H2O, Pb² + H2S⇒PbS↓ + 2H.
Видео:Окислительно-восстановительные реакции. 1 часть. 9 класс.Скачать

Закончите уравнение реакций?
Закончите уравнение реакций.
Разберите окислительно — восстановительные реакции методом электронного баланса.
Видео:8 КЛАСС | Как решать ЦЕПОЧКИ ХИМИЧЕСКИХ РЕАКЦИЙ | Цепочки превращенийСкачать

HNO3 + PbS — > ; составить ионное и молекулярное уравнение?
HNO3 + PbS — > ; составить ионное и молекулярное уравнение.
Видео:Химия, 9 класс, тема "Окислительно-восстановительные реакции" (учитель Швецова Елена Евгеньевна)Скачать

Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения : S H2S SO2 Na2SO3 NaHSO3 SO2 H2S S K2S PbS?
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения : S H2S SO2 Na2SO3 NaHSO3 SO2 H2S S K2S PbS.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Осуществите превращения Pbo — Pb — PbS — PbO — PbSO4 — Pb(NO3)2?
Осуществите превращения Pbo — Pb — PbS — PbO — PbSO4 — Pb(NO3)2.
Видео:Химия 9 класс — Как определять Степень Окисления?Скачать

По краткому ионному уравнению составьте молекулярное уравнение реакции :а) Ag + + Cl — → AgCl↓б) S2 — + Pb2 + → PbS↓?
По краткому ионному уравнению составьте молекулярное уравнение реакции :
а) Ag + + Cl — → AgCl↓
б) S2 — + Pb2 + → PbS↓.
Видео:Эффект растворителя в реакциях по механизмам Sn1 и Sn2Скачать

Получите свинец из руды, содержащей сульфид свинца (PbS), запишите уравнения реакций?
Получите свинец из руды, содержащей сульфид свинца (PbS), запишите уравнения реакций.
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Краткое ионное уравнение реакции S2 — + Pb2 + = PbS¡?
Краткое ионное уравнение реакции S2 — + Pb2 + = PbS¡.
Ему соответствует взоимодействие веществ.
Видео:Реакции по механизму Sn2Скачать

Предложите технологическую цепочку производства свинца из минерала галенита PbS?
Предложите технологическую цепочку производства свинца из минерала галенита PbS.
Запишите уравнения реакций.
На этой странице вы найдете ответ на вопрос Составить уравнения реакций к следующим превращениям : а) FeS — H2S — K2S — PbS b) S — H2S — Na2S — PbS?. Вопрос соответствует категории Химия и уровню подготовки учащихся 5 — 9 классов классов. Если ответ полностью не удовлетворяет критериям поиска, ниже можно ознакомиться с вариантами ответов других посетителей страницы или обсудить с ними интересующую тему. Здесь также можно воспользоваться «умным поиском», который покажет аналогичные вопросы в этой категории. Если ни один из предложенных ответов не подходит, попробуйте самостоятельно сформулировать вопрос иначе, нажав кнопку вверху страницы.
Видео:ДЕВОЧКА ПРОНЕСЛА В ШКОЛУ БОМБУ И ЧУТЬ НЕ ВЗОРВАЛА ВСЕХСкачать

Осуществите превращения Н2S → S → К2S → PbS
Видео:Реакции по механизму Sn1Скачать

Ваш ответ
Видео:ВСЯ ХИМИЯ С НУЛЯ! | Денис Марков | УмскулСкачать

решение вопроса
Видео:68 учеников этого НЕ ЗНАЮТ! Таблица Менделеева — Как пользоваться?Скачать

Похожие вопросы
- Все категории
- экономические 43,407
- гуманитарные 33,633
- юридические 17,905
- школьный раздел 608,009
- разное 16,855
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
🔥 Видео
Механизм SN2 и стереохимияСкачать

ВСЯ ХИМИЯ за 8 класс в 1 уроке + таймкодыСкачать

ВСЯ ХИМИЯ за 9 класс в 1 уроке + таймкодыСкачать

Собеседование .NET 2021. Каверзные вопросы: Как хранятся значимые и ссылочные типы?Скачать