Гидроксид калия KOH — неорганическое соединение. Белый, гигроскопичный, плавится и кипит без разложения. Хорошо растворяется в воде.
Относительная молекулярная масса Mr = 56,11; относительная плотность для тв. и ж. состояния d = 2, 044; tпл = 404º C; tкип = 1324º C
- Способы получения
- Качественная реакция
- Химические свойства
- Acetyl
- Гидроксид калия: свойства, получение и применение
- Классификация гидроксидов
- Физические свойства
- Другие названия гидроксида калия
- Химические свойства
- Взаимодействие с солями
- Реакции с кислотами
- Что будет, если добавить его к оксиду?
- Основные способы получения гидроксида калия
- Использование в промышленности
- Соединения калия, получаемые из его гидроксида, и их применение
- Гидроксид калия и человеческий организм
- 💥 Видео
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Способы получения
1. Гидроксид калия получают электролизом раствора хлорида калия :
2KCl + 2H2O → 2KOH + H2 + Cl2
2. При взаимодействии калия, оксида калия, гидрида калия и пероксида калия с водой также образуется гидроксид калия:
2K + 2H2O → 2KOH + H2
2KH + 2H2O → 2KOH + H2
3. Карбонат калия при взаимодействии с гидроксидом кальция образует гидроксид калия:
Видео:Правая часть уравнения реакции вещества X с гидроксидом калия имеет вид: ... = NH3 + Н2О + KI.Скачать

Качественная реакция
Качественная реакция на гидроксид калия — окрашивание фенолфталеина в малиновый цвет .
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Химические свойства
1. Гидроксид калия реагируют со всеми кислотами (и сильными, и слабыми, и растворимыми, и нерастворимыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов:
2. Гидроксид калия реагирует с кислотными оксидами . При этом образуются средние или кислые соли, в зависимости от соотношения реагентов:
3. Гидроксид калия реагирует с амфотерными оксидами и гидроксидами . При этом в расплаве образуются средние соли, а в растворе комплексные соли:
в растворе образуется комплексная соль — тетрагидроксоалюминат:
4. С кислыми солями гидроксид калия также может взаимодействовать. При этом образуются средние соли, или менее кислые соли:
5. Гидроксид калия взаимодействует с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода).
При этом кремний окисляется до силиката и выделяется водород:
Фтор окисляет щелочь. При этом выделяется молекулярный кислород:
Другие галогены, сера и фосфор — диспропорционируют в растворе гидроксида калия:
Сера взаимодействует с гидроксидом калия только при нагревании:
6. Гидроксид калия взаимодействует с амфотерными металлами , кроме железа и хрома. При этом в расплаве образуются соль и водород:
В растворе образуются комплексная соль и водород:
2KOH + 2Al + 6Н2О = 2K[Al(OH)4] + 3Н2
7. Гидроксид калия вступает в обменные реакции с растворимыми солями .
Хлорид меди (II) реагирует с гидроксидом калия с образованием хлорида калия и осадка гидроксида меди (II):
2KOH + CuCl2 = Cu(OH)2↓+ 2KCl
Также с гидроксидом калия взаимодействуют соли аммония .
Например , при взаимодействии хлорида аммония и гидроксида калия образуются хлорид калия, аммиак и вода:
NH4Cl + KOH = NH3 + H2O + KCl
8. Гидроксид калия проявляет свойства сильного основания. В воде практически полностью диссоциирует , образуя щелочную среду и меняя окраску индикаторов.
KOH ↔ K + + OH —
9. Гидроксид калия в расплаве подвергается электролизу . При этом на катоде восстанавливается сам литий, а на аноде выделяется молекулярный кислород:
4KOH → 4K + O2 + 2H2O
Видео:Самый *ПРОСТОЙ* способ ПОЛУЧИТЬ ГИДРОКСИД КАЛИЯСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать  Гидроксид калия: свойства, получение и применениеВсего в природе существует три класса неорганических соединений: соли, оксиды и гидроксиды. Также в отдельный класс выделяют такие вещества, как СІ2, І2 и подобные им, состоящие только из одного химического элемента. Видео:нитрат серебра + гидроксид калияСкачать  Классификация гидроксидовЭто один из трех существующих классов неорганических соединений. Они делятся на кислоты, основания и амфотерные вещества. Первые состоят из катиона Н+ и аниона в виде кислотного остатка, к примеру, СІ-. Структура вторых включает в себя катион какого-либо металла, например, Са+, а также анион в виде гидроксильной группы ОН-. Последние характеризуются тем, что одновременно обладают химическими свойствами, присущими кислотам и основаниям. К таким гидроксидам можно отнести соединения алюминия и железа. Основания, как и другие неорганические вещества, можно разделить на группы в зависимости от их химической активности. Самыми сильными в этом плане считаются гидроксид калия и натрия, которые еще называют щелочами. Они быстро вступают в реакцию с различными веществами. Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать  Физические свойстваДанное вещество в нормальных условиях (при комнатной температуре и невысоком давлении) пребывает в твердом агрегатном состоянии. Оно выглядит как небольшого размера кристаллы, которые не имеют цвета и запаха, хорошо растворимы в воде. Эти кристаллы обладают чрезвычайно высокой гигроскопичностью. Пребывая долго на открытом воздухе, они расплываются и превращаются в раствор, поглощая из атмосферы влагу. Такое же явление наблюдается и с гидроксидом натрия, гигроскопичность которого еще выше. Видео:Гидроксид калия ЭлекиролизСкачать 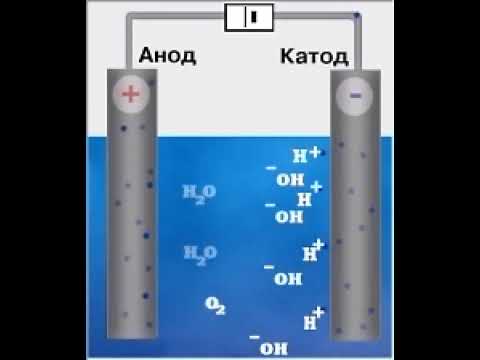 Другие названия гидроксида калияВ просторечье данное вещество именуется едким калием, а также каустическим поташем и калиевым щёлоком. Видео:Кто с кем реагирует?Скачать  Химические свойстваРассматриваемое вещество обладает всеми особенностями, которые характерны для оснований. Его щелочные свойства очень ярко выражены, как и у гидроксида натрия. При горении гидроксид калия выделяется оксид данного металла и вода. К2О имеет светло-желтую окраску. Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать  Взаимодействие с солямиСоли — вещества, состоящие из катиона какого-либо металла и аниона, представленного кислотным остатком. Образуются они в основном при взаимодействии активных металов с кислотами. Происходит реакция замещения, при которой кроме соли образуется водород, выделяющийся в виде газа. При реакции с веществами данного класса образуется уже другая соль с содержанием калия, а также гидроксид какого-либо металла. Например, при взаимодействии данного вещества с хлоридом меди образуется гидроксид меди и хлорид калия, выпадающий в осадок. Для того чтобы провести такого рода реакцию, необходимо взять щелочь и хлорид меди в таких пропорциях, чтобы на две молекулы первого вещества приходилась одна второго, то есть соотношение полученных веществ будет таким: на одну молекулу гидроксида купрума две хлорида калия. Такого рода взаимодействия называются реакциями обмена. Чтобы они могли осуществляться, нужно соблюсти следующие условия: один из продуктов взаимодействия должен либо выпадать в осадок, либо испаряться в виде газа, либо становиться водой. Металл, входящий в состав соли, должен быть менее химически активным, нежели калий (все, кроме лития). Видео:ВСЕ РЕАКЦИИ С АЗОТОМ И ЕГО СОЕДИНЕНИЯМИ | ЕГЭ ХИМИЯ 2024| НООСкачать  Реакции с кислотамиВсе основания, в том числе и гидроксид калия, способны взаимодействовать с кислотами. Самая распространенная и часто используемая реакция — та, в которой участвует рассматриваемое вещество и серная кислота. Гидроксид калия в таком случае нужен в таком количестве, чтобы на одну молекулу кислоты приходилось две — данного соединения. При подобного рода реакции образуются такие вещества, как сульфат калия и вода в молярном соотношении один к двум. Подобный химический процесс активно используется в промышленности, так как полученный продукт широко применяется повсеместно. Видео:Реакция нейтрализации гидроксида натрия соляной (хлороводородной) кислотойСкачать  Что будет, если добавить его к оксиду?В таком случае также произойдет, по сути, реакция обмена. К примеру, если смешать гидроксид калия и диоксид железа в молярном соотношении два к одному, можно получить гидроксид (ІІ) ферума, выпадающий в темно-зеленый осадок, а также оксид калия в таких пропорциях, что на одну молекулу первого вещества будет приходиться одна второго. Видео:Тетрапероксохромат Kалия - K3Cr(O2)4. Реакция Хромата Калия, Гидроксида Калия и Пероксида Водорода.Скачать  Основные способы получения гидроксида калияВ промышленности чаще всего его добывают путем электролиза раствора калий хлорида. Получение гидроксид калия — это процесс, при котором кроме добываемого вещества образуются Н2 и СІ2. Видео:Химия | Молекулярные и ионные уравненияСкачать  Использование в промышленностиВ основном данное вещество используется в сфере изготовления мыла и других чистящих средств. В этом процессе используется реакция рассматриваемого соединения с каким-либо жиром. Для такой же цели можно использовать и гидроксид натрия. Также рассматриваемое в этой статье вещество широко применяется в химической промышленности для получения разнообразных соединений калия, в первую очередь — его сульфата. Реакция, при которой он образуется, была рассмотрена нами выше. В этой же сфере его используют как соединение, поглощающее газы, такие как сероводород, диоксид серы, углекислый газ. Также он выступает в роли осушителя благодаря своим высоким гигроскопическим свойствам. Его можно использовать для определения уровня концентрации кислот в растворе. Кроме того, гидроксид применяется и в пищевой промышленности. Здесь его используют в качестве пищевой добавки Е525. Он выступает регулятором кислотности. Встретить его можно в составе какао, шоколада и других аналогичных продуктов. Применяют гидроксид калия при обработке целлюлозы, для получения вискозы, используют в щелочных аккумуляторах, добавляют в состав средств для мытья посуды или очистки разных поверхностей, для обработки хлопковой ткани и придания ей большей гигроскопичности. Видео:8 класс. Составление уравнений химических реакций.Скачать  Соединения калия, получаемые из его гидроксида, и их применениеЧаще всего рассматриваемое вещество используется для того, чтобы добыть сульфат калия, который применяется в качестве удобрения. Им подкармливают растения во время вегетационного периода. Также он применяется как эмульгатор в пищевой промышленности — он дает возможность получить однородную массу, состоящую из компонентов, которые не смешиваются при обычных условиях. Для его обозначения используют маркировку Е515. Также он может, как и гидроксид калия, выступать в качестве регулятора кислотности. Сульфат часто используют как заменитель соли. Кроме того, данное вещество находит свое применение в фармакологии при производстве биологически активных добавок, а также при изготовлении красителей. Кроме этого, его используют и в стекольной промышленности. Видео:9.гидроксид калия и др. Свойства основанийСкачать  Гидроксид калия и человеческий организмВ виде концентрированного раствора данное химическое соединение является опасным для живых организмов. Попадание его на кожу или слизистые оболочки может привести к серьезным поражениям. Концентрированный раствор гидроксида калия причиняет более сильные ожоги, чем кислоты. Также он способен растворять многие органические соединения. Данное вещество относят ко второму классу опасности, то есть при работе с ним необходимо соблюдать особые правила. Избыточное количество гидроксид калия в организме приводит к возникновению новых кожных заболеваний или обострению хронических. 💥 ВидеоЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать  Алюминий и гидроксид калияСкачать  Химический опыт. Гидроксид Калия+ Сульфат МедиСкачать  ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать  |






