В неорганической химии существует три основных класса соединений. Это кислоты, щелочи и оксиды. Кислота состоит из катиона водорода и аниона кислотного остатка. Щелочь — из катиона металла и гидроксильной группы. Об оксидах мы поговорим подробнее далее.
- Что такое оксид?
- Оксид калия: формула
- Физические свойства
- Химические свойства К2О
- Реакция с водой
- С другими оксидами
- Взаимодействие с кислотами
- К2О и галогены
- Взаимодействие с аммиаком
- Взаимодействие с органическими веществами
- Получение К2О
- Использование К2О в промышленности
- Оксид калия: способы получения и химические свойства
- Способ получения
- Химические свойства
- Формула оксида калия (K2O), свойства, риски и использование
- Физико-химические свойства
- Реактивность и опасности
- приложений
- 📸 Видео
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

Что такое оксид?
Это соединение, состоящее из двух разных химических элементов, одним из которых является кислород. Вторым же может быть металл или неметалл. Количество атомов кислорода зависит от валентности второго химического элемента, входящего в состав соединения. Так, например, валентность калия равна одному, поэтому оксид калия будет содержать один атом кислорода и два атома калия. Валентность кальция равна двум, поэтому его оксид будет состоять из одного атома кислорода и одного атома кальция. Валентность фосфора равна пяти, поэтому его оксид состоит из двух атомов фосфора и пяти атомов кислорода.
В этой статье мы более подробно поговорим про оксид калия. А именно — о его физических и химических свойствах, о его применении в различных областях промышленности.
Видео:ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

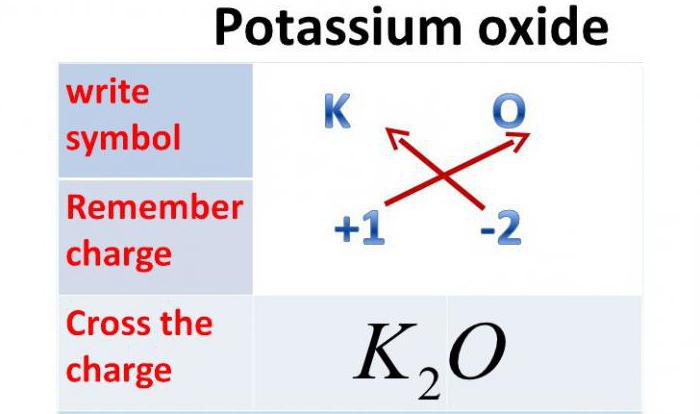
Оксид калия: формула
Так как валентность данного металла равна одному, а валентность кислорода — двум, то это химическое соединение будет состоять из двух атомов металла и одного атома Оксигена. Итак, оксид калия: формула — К2О.
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Физические свойства
Рассматриваемый оксид обладает бледно-желтой окраской. Иногда он может быть и бесцветным. При комнатной температуре он обладает твердым агрегатным состоянием.
Температура плавления данного вещества равняется 740 градусам Цельсия.
Плотность составляет 2,32 г/см 3 .
При термическом разложении данного оксида образуется пероксид этого же металла и чистый калий.
Растворим в органических растворителях.
В воде не растворяется, а вступает в реакцию с ней.
Обладает высокой гигроскопичностью.
Видео:ОКСИД КАЛИЯ!!!!!/Профессиональный РАЗБОР ОТ А ДО Я/ДОЗЫ ПРИМЕНЕНИЯСкачать

Химические свойства К2О
Данное вещество обладает типичными для всех основных оксидов химическими свойствами. Рассмотрим химические реакции данного оксида с различными веществами по порядку.
Видео:8 класс. Составление уравнений химических реакций.Скачать

Реакция с водой
В первую очередь оно способно реагировать с водой с образованием в результате гидроксида данного металла.
Уравнение такой реакции выглядит следующим образом:
Зная молярную массу каждого из веществ, из уравнения можно сделать следующий вывод: из 94 граммов рассматриваемого оксида и 18 граммов воды можно получить 112 граммов калий гидроксида.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

С другими оксидами
Кроме того, рассматриваемый оксид способен реагировать с диоксидом карбона (углекислым газом). При этом образуется соль — карбонат калия.
Уравнение реакции оксида калия и оксида карбона можно записать следующим образом:
Так, можно сделать вывод, что из 94 граммов рассматриваемого оксида и 44 граммов углекислого газа получается 138 граммов калий карбоната.
Также рассматриваемый оксид может вступать в реакцию с оксидом сульфура. При этом образуется другая соль — калий сульфат.
Взаимодействие оксида калия с оксидом сульфура можно выразить следующим уравнением:
Из него видно, что, взяв 94 грамма рассматриваемого оксида и 80 граммов оксида сульфура, можно получить 174 грамма сульфата калия.
Таким же образом К2О может реагировать и с другими оксидами.
Другой тип взаимодействия — реакции не с кислотными, а с амфотерными оксидами. В таком случае образуется не кислота, а соль. Примером такого химического процесса может служить взаимодействие рассматриваемого оксида с оксидом цинка.
Эту реакцию можно выразить следующим уравнением:
Из него видно, что при взаимодействии рассматриваемого оксида и оксида цинка образуется соль под названием калий цинкат. Если знать молярную массу всех веществ, то можно подсчитать, что из 94 граммов К2О и 81 грамма оксида цинка можно получить 175 граммов калий цинката.
Также К2О способен взаимодействовать с оксидом азота. При этом образуется смесь из двух солей: нитрата и нитрита калия. Уравнение этой реакции выглядит таким образом:
Если знать молярные массы веществ, можно сказать, что из 94 граммов рассматриваемого оксида и 92 граммов оксида нитрогена можно получить 101 грамм нитрата и 85 граммов нитрита.
Видео:Реакция калия с кислородомСкачать

Взаимодействие с кислотами
Самый распространенный случай — оксид калия + серная кислота = сульфат калия + вода. Уравнение реакции выглядит таким образом:
Из уравнения можно сделать вывод, что для получения 174 граммов сульфата калия и 18 граммов воды необходимо взять 94 грамма рассматриваемого оксида и 98 граммов серной кислоты.
Похожим образом происходит химическое взаимодействие между рассматриваемым оксидом и азотной кислотой. При этом образуется нитрат калия и вода. Уравнение этой реакции можно записать следующим образом:
Таким образом, из 188 граммов рассматриваемого оксида и 252 граммов азотной кислоты можно получить 404 грамма нитрата калия и 36 граммов воды.
По такому же принципу рассматриваемый оксид может реагировать и с другими кислотами. В процессе этого будут образовываться другие соли и вода. Так, к примеру, при реакции этого оксида с фосфорной кислотой получается фосфат и вода, с хлоридной кислотой — хлорид и вода и так далее.
Видео:Получение и химические свойства ОКСИДОВ 8 класс | ПРИНЦИП составления реакций с участием оксидовСкачать

К2О и галогены
Рассматриваемое химическое соединение способно реагировать и с веществами данной группы. К галогенам относятся простые соединения, состоящие из нескольких атомов одного и того же химического элемента. Это, например, хлор, бром, иод и некоторые другие.
Итак, хлор и оксид калия: уравнение:
В результате такого взаимодействия образуется две соли: хлорид и гипохлорит калия. Из 94 грамм рассматриваемого оксида и 70 грамм хлора получается 74 грамма хлорида калия и 90 грамм гипохлорита калия.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Взаимодействие с аммиаком
К2О способен реагировать с этим веществом. В результате такого химического взаимодействия образуется гидроксид и амид калия. Уравнение данной реакции выглядит следующим образом:
Зная молярные массы всех веществ, можно вычислить пропорции реагентов и продуктов реакции. Из 94 граммов рассматриваемого оксида и 17 граммов аммиака можно получить 56 граммов гидроксида калия и 55 граммов амида калия.
Видео:8 класс химические свойства оксидов, оснований, кислот, солей и ионные уравненияСкачать

Взаимодействие с органическими веществами
Из органических химических веществ оксид калия взаимодействует с эфирами и спиртами. Однако эти реакции идут медленно и требуют специальных условий.
Видео:Кто с кем реагирует?Скачать

Получение К2О
Данное химическое вещество можно получать несолькими способами. Вот самые распространенные из них:
- Из нитрата калия и металлического калия. Эти два реагента нагревают, в результате чего образуется К2О и азот. Уравнение реакции выглядит следующим образом: 2KNO3 + 10К = N2 + 6К2О.
- Второй способ происходит в два этапа. Сначала происходит реакция между калием и кислородом, в результате чего образуется пероксид калия. Уравнение реакции выглядит так: 2К + О2 = К2О2. Далее пероксид обогащают калием, в результате чего и получают оксид калия. Уравнение реакции можно записать таким образом: К2О2 + 2К = 2К2О.
Видео:🤔ГДЕ основный оксид? #shortsСкачать

Использование К2О в промышленности
Наиболее часто рассматриваемое вещество используется в сельскохозяйственной промышленности. Данный оксид является одним из компонентов минеральных удобрений. Калий очень важен для растений, так как повышает их стойкость к различным заболеваниям. Также рассматриваемое вещество применяется в строительстве, так как может присутствовать в составе некоторых видов цемента. Кроме того, оно применяется в химической промышленности для получения других соединений калия.
Видео:Оксиды. Химические свойства. 8 класс.Скачать

Оксид калия: способы получения и химические свойства
Оксид калия K2O — Бинарное неорганическое вещество . Белый, термически устойчивый.
Относительная молекулярная масса Mr = 94,20; относительная плотность для тв. и ж. состояния d = 2,33; tпл = 740º C при избыточном давлении.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Способ получения
1. Оксид калия можно получить путем взаимодействия калия и гидроксида калия при 450º С, в результате образуется оксид калия и водород :
2K + 2KOH = 2K2O + H2
2. При взаимодействии надпероксида калия и калия при температуре 700º C и избыточном давлении образуется оксид калия:
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Химические свойства
1. При разложении оксида калия образуется пероксид калия и калий, температура при этом должна быть 350–430º С:
2. Оксид калия взаимодействует со сложными веществами:
2.1. Оксид калия реагирует с водой . Образуется гидроксид калия:
2.2. Оксид калия взаимодействует с кислотами . При этом образуются соль и вода.
Например , оксид калия с разбавленной соляной кислотой образует хлорид калия и воду:
K2O + 2HCl = 2KCl + H2O.
2.3. При взаимодействии калия с оксидами образуются соли.
2.3.1. Реагируя с углекислым газом при 400º C оксид калия образует карбонат калия:
2.3.2. При 150–200º C, в результате взаимодействия оксида калия, и оксидом азота (IV) образуются нитрат калия и нитрит калия:
2.3.3. Оксид калия взаимодействует с оксидом алюминия при 1000º С. При это образуется алюминат калия:
Видео:8 класс.Основные оксиды.Скачать

Формула оксида калия (K2O), свойства, риски и использование
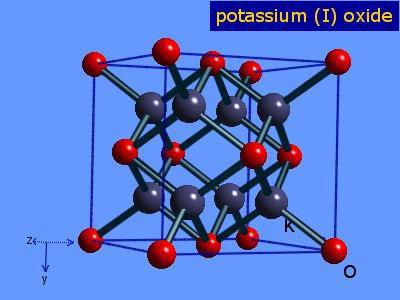
оксид калия, также называется оксидом калия, ионная кислородно-калиевая соль, формула которой K2О. Его структура представлена на рисунке 1 (EMBL-EBI, 2016).
К2Или это самый простой оксид калия, это очень реактивное и редко встречающееся соединение. Некоторые коммерческие материалы, такие как удобрения и цементы, испытывают, предполагая процентное содержание состава, которое будет эквивалентно смеси химических соединений K2О.
Оксид калия получают из гидроксида калия (едкого кали) и металлического калия при 450 ° C с образованием молекулярного водорода (ОКСИД КАЛИЯ K2O, S.F.) в соответствии с уравнением:
Его также получают путем восстановления пероксида калия в соответствии с реакцией:
Другим способом получения оксида калия является нагревание карбоната калия при высокой температуре, как показано следующей реакцией:
Однако основным способом получения оксида калия является нагревание нитрата калия для получения молекулярного азота, как показано следующей реакцией:
- 1 Физико-химические свойства
- 2 Реактивность и опасности
- 3 использования
- 4 Ссылки
Видео:ОСНОВАНИЯ В ХИМИИ — Химические свойства оснований. Реакции оснований с кислотами и солямиСкачать

Физико-химические свойства
Оксид калия — это желтоватые тетраэдрические кристаллы без характерного аромата (Национальный центр биотехнологической информации, 2017). Его внешний вид показан на рисунке 2 (американские элементы, С.Ф.).
Соединение имеет молекулярную массу 94,2 г / моль и плотность 2,13 г / мл при 24 ° С. Он имеет температуру плавления 740 ° C, хотя начинает разлагаться при 300 ° C (Royal Society of Chemistry, 2015).
Соединение устойчиво к нагреванию и растворим в этаноле и эфире. К2Или он кристаллизуется в структуре антифторита. По этой причине положения анионов и катионов меняются местами относительно их положений в CaF.2, с ионами калия, координированными до 4 оксидных ионов, и ионами оксида, скоординированными с 8 калиями.
К2Или это основной оксид и бурно реагирует с водой с образованием едкого гидроксида калия. Он распух и поглощает воду из атмосферы, инициируя эту энергичную реакцию.
Оксид калия обратимо окисляется до пероксида калия при 350 ° С, бурно реагирует с кислотами, такими как соляная кислота, с образованием солей калия в соответствии с реакцией:
Соединение реагирует с диоксидом азота с образованием нитрата и нитрита калия при температуре от 150 до 200 ° C:
Оксид калия реагирует при низких температурах с аммиаком с образованием амидов и гидроксида калия в соответствии с реакцией:
Видео:Реакции металлов с кислородом и водой. 8 класс.Скачать

Реактивность и опасности
Оксид калия является нестабильным веществом. Он легко окисляется до других оксидов калия, пероксида или до окиси калия (KHO). Соединение не является горючим, но активно и экзотермически реагирует с водой с образованием гидроксида калия (KOH).
Раствор оксида калия в воде является сильным основанием, бурно реагирует с кислотой и вызывает коррозию. Бурно реагирует с водой, образующей гидроксид калия. Атакует многие металлы в присутствии воды (Национальный институт безопасности и гигиены труда, 2014).
Вещество разъедает глаза, кожу и дыхательные пути, а также при попадании в организм. Вдыхание аэрозоля может вызвать отек легких. Симптомы отека легких часто проявляются лишь через несколько часов и усиливаются при физической нагрузке..
В случае попадания в глаза вам следует проверить, носите ли вы контактные линзы, и немедленно снять их. Глаза должны быть промыты проточной водой в течение не менее 15 минут с открытыми веками. Вы можете использовать холодную воду. Мазь не следует использовать для глаз.
Если химическое вещество попало на одежду, удалите его как можно быстрее, защищая свои руки и тело. Поместите жертву под безопасный душ.
Если химическое вещество накапливается на незащищенной коже жертвы, например на руках, аккуратно и осторожно промойте кожу, загрязненную проточной водой и неабразивным мылом. Вы можете использовать холодную воду. Если раздражение не проходит, обратитесь к врачу. Выстирать загрязненную одежду перед повторным использованием.
Если контакт с кожей серьезный, его следует промыть дезинфицирующим мылом и покрыть кожу, загрязненную антибактериальным кремом..
В случае вдыхания пострадавшему должно быть разрешено отдыхать в хорошо проветриваемом помещении. Если вдыхание серьезное, пострадавшего следует как можно скорее эвакуировать в безопасное место..
Ослабьте тесную одежду, такую как воротник рубашки, ремни или галстук. Если пострадавшему трудно дышать, следует назначить кислород. Если пострадавший не дышит, проводится реанимация из уст в уста.
Всегда принимая во внимание, что человеку, оказывающему помощь в проведении реанимации изо рта в рот, может быть опасно, когда вдыхаемый материал токсичен, инфекционен или вызывает коррозию.
В случае проглатывания не вызывать рвоту. Ослабьте тесную одежду, такую как воротники рубашки, ремни или галстуки. Если пострадавший не дышит, проведите реанимацию из уст в уста. Во всех случаях следует немедленно обратиться за медицинской помощью (IPCS, S.F.).
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

приложений
Химическая формула К2O (или просто «K») используется в нескольких промышленных контекстах: числа N-P-K для удобрений, в формулах цемента и в формулах стекла.
Оксид калия часто не используется непосредственно в этих продуктах, но количество калия указывается в терминах K-эквивалентов.2Или для любого типа используемых соединений калия, таких как карбонат калия.
Оксид калия составляет около 83% калия по весу, а хлорид калия — только 52%. Хлорид калия обеспечивает меньше калия, чем равное количество оксида калия.
Поэтому, если удобрением является хлорид калия в количестве 30% по весу, его стандартный индекс калия, основанный на оксиде калия, будет составлять только 18,8%. Он производится и / или импортируется от 10 до 100 тонн в год этого вещества в Европейском экономическом пространстве.
Это вещество используется в лабораторных химикатах, удобрениях, полимерах и фитосанитарных продуктах. К2Или это имеет промышленное использование, которое приводит к производству другого вещества (использование промежуточных продуктов).
Оксид калия используется в областях приготовления смесей и / или переупаковки, а также в сельском хозяйстве, лесном хозяйстве и рыболовстве. Это вещество используется для производства химических продуктов, пластмассовых изделий и минеральных продуктов (например, гипса, цемента)..
Выброс в окружающую среду оксида калия, вероятно, произойдет для промышленного использования: в качестве промежуточного этапа при производстве другого вещества (использование промежуточных продуктов), составления смесей, в качестве вспомогательного средства для обработки и промышленной обработки на истирание с низкой скоростью. выпуска, резки, механической обработки или полировки металла).
Возможно, что другое высвобождение в окружающую среду этого вещества путем его использования во внутренних помещениях, например, моющих жидкостей / моющих средств, автомобильных средств по уходу, краски и покрытия или клеи, ароматизаторы и освежители воздуха..
Также для использования внутри помещений в закрытых системах с минимальным выбросом, таких как охлаждающие жидкости в холодильниках, электрические нагреватели на масляной основе.
Оксид калия используется на открытом воздухе в долговременных материалах с низкой скоростью высвобождения, например, в строительных материалах и конструкциях из металла, дерева и пластика..
В помещении он используется в долговечных материалах с низкой скоростью высвобождения, таких как мебель, игрушки, строительные материалы, занавески, обувь, кожгалантерея, бумажные и картонные изделия, электронное оборудование..
Это вещество можно найти в изделиях из камня, гипса, цемента, стекла или керамики (например, посуду, кастрюли / сковородки, контейнеры для хранения продуктов питания, строительные и изоляционные материалы) (Европейское химическое агентство, 2017).
Оксид калия является термостойким, крайне нерастворимым источником калия, подходящим для стекла, оптики и керамики. Оксидные соединения не приводят к электричеству.
Однако некоторые структурированные оксиды перовскита являются электронными проводниками, которые находят применение в катоде твердооксидных топливных элементов и системах генерации кислорода..
Они представляют собой соединения, которые содержат, по меньшей мере, один кислородный анион и один катион металла. Они чрезвычайно стабильны, что делает их полезными для изготовления керамических конструкций, таких как глиняные миски или для продвинутой электроники.
Он также используется в легких конструкционных компонентах в аэрокосмической и электрохимической промышленности, таких как топливные элементы, в которых они проявляют ионную проводимость..
Металлооксидные соединения являются основными ангидридами и поэтому могут вступать в реакцию с кислотами и сильными восстановителями в окислительно-восстановительных реакциях..
📸 Видео
Кислотный оксид + вода = ??? Основной оксид + вода = ???Скачать