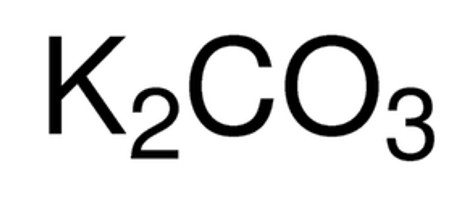Карбонат калия K2CO3 — соль щелочного металла калия и угольной кислоты. Белое вещество, плавится без разложения, при дальнейшем нагревании разлагается. Очень хорошо растворяется в воде.
Относительная молекулярная масса Mr = 138,20; относительная плотность для тв. и ж. состояния d = 2,428; tпл = 891º C;
- Способ получения
- Качественная реакция
- Химические свойства
- Карбонат калия
- Содержание
- История
- Физические и химические свойства
- Получение
- Применение
- Карбонат калия (поташ): получение, применение и химические свойства
- Историческая справка
- Применения поташа в истории
- Современные способы получения
- Общие свойства карбоната калия
- Применение
- Пищевая добавка Е501
- Первая помощь при вдыхании и попадании на кожу карбоната калия
- 🔥 Видео
Видео:Калий и водаСкачать

Способ получения
1. Карбонат калия можно получить путем взаимодействия при комнатной температуре пероксида калия и влажного углекислого газа. В результате реакции образуется карбонат калия и кислород:
2. В результате взаимодействия пероксида калия и угарного газа при 50º С образуется карбонат калия и кислород:
3. При взаимодействии концентрированного гидроксида калия и углекислого газа образуется карбонат калия и вода:
4. Взаимодействуя с углеродом (графитом) при 30º С надпероксид калия карбонат калия и углекислый газ:
5. Разлагаясь при температуре 100 — 400 ºС гидрокарбонат калия образует карбонат калия, углекислый газ и воду:
6. В результате реакции между гидрокарбонатом калия и гидроксидом калия образуется карбонат калия и вода:
Видео:Поташ (углекислый калий) из золы.Скачать

Качественная реакция
Качественная реакция на карбонат калия — взаимодействие его с раствором сильных кислот. В результате реакции происходит бурное выделение углекислого газа, образование которого можно проверить, если пропустить его через известковую воду, которая мутнеет из-за образования осадка:
1. При взаимодействии с хлороводородной кислотой, карбонат калия образует хлорид калия, углекислый газ и воду:
2. Взаимодействуя с серной кислотой, карбонат калия образует углекислый газ и воду, а также сульфат калия:
Видео:химическая реакция взаимодействия карбоната калия и соляной кислотыСкачать

Химические свойства
1. Карбонат калия может реагировать с простыми веществами :
С хлором, бромом и йодом концентрированный и горячий раствор карбоната калия реагирует с образованием хлорида, бромида или йодида калия, хлората, бромата или йодата калия и углекислого газа:
2. Карбонат калия вступает в реакцию со многими сложными веществами :
2.1. Насыщенный карбонат калия реагирует при 30–40º C с водой и углекислым газом, образуя осадок гидрокарбоната калия:
2.2. Карбонат калия может реагировать с насыщенным гидроксидом кальция с образованием гидроксида калия и осадка карбоната кальция:
2.3. Карбонат калия способен реагировать с кислотами :
2.3.1. При взаимодействии с разбавленной хлороводородной кислотой карбонат калия образует хлорид калия, углекислый газ и воду:
2.3.2. В результате реакции между насыщенным карбонатом калия и концентрированной и холодной хлорной кислотой образуется осадок хлорат калия, вода и газ углекислый газ:
2.3.3. Взаимодействуя с разбавленной фосфорной кислотой концентрированный раствор карбоната калия образует фосфат калия, воду и углекислый газ:
2.3.4. Карбонат калия взаимодействует с плавиковой кислотой . В результате реакции образуется фторид калия, вода и углекислый газ, если кислота разбавленная:
а если кислота концентрированная, то образуется гидрофторид калия, вода и углекислый газ:
2.5. Концентрированный раствор карбоната калия взаимодействует с оксидом серы . При этом образуются карбонат калия и углекислый газ:
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Карбонат калия
| Карбонат калия | |
|---|---|
 | |
 | |
| Систематическое наименование | Карбонат калия |
| Традиционные названия | поташ |
| Хим. формула | CK₂O₃ |
| Состояние | кристаллическое |
| Молярная масса | 138,205 г/моль |
| Плотность | 2,44 г/см³ |
| Т. плав. | 891 °C |
| Растворимость в воде | 110,5 г/100мл (20 °C) |
| ГОСТ | ГОСТ 4221-76 ГОСТ 10690-73 |
| Рег. номер CAS | 584-08-7 |
| PubChem | 11430 |
| Рег. номер EINECS | 209-529-3 |
| SMILES | |
| Кодекс Алиментариус | E501(i) |
| RTECS | TS7750000 |
| ChEBI | 131526 |
| ChemSpider | 10949 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
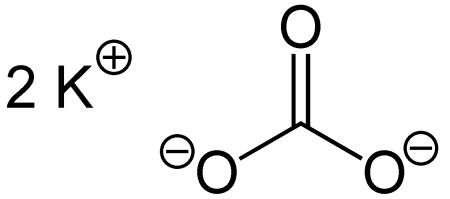
Карбонат калия, углекислый калий, арх. поташ K2CO3 — средняя соль калия и угольной кислоты. Это белое кристаллическое вещество, хорошо растворимое в воде. Малотоксичен, относится к III классу опасности.
Старое название соли — поташ из нидерл. рotasсh напрямую или через нем. Pottasche , фр. potasse .
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Содержание
- 1 История
- 2 Физические и химические свойства
- 3 Получение
- 4 Применение
Видео:КИСЛОТЫ В ХИМИИ — Химические Свойства Кислот. Реакция Кислот с Основаниями, Оксидами и МеталламиСкачать

История
Поташ — одна из солей, известных людям ещё в древности. Обычно поташ загрязнён различными примесями, поэтому не имеет такого чисто-белого цвета, как измельчённый карбонат калия. До XX века в Европе поташ был одним из важнейших промышленных химических реагентов. Его получали путём водной экстракции из растительной золы, с дальнейшей очисткой до необходимого уровня. Производство было сосредоточено в местах, богатых лесом — кое-где в Европе, но, в основном, в России и Северной Америке, — то есть именно там, где за несколько тысяч лет до н. э. находились языки отходящих в сторону северного полюса вместе с глобальным потеплением ледников (как правило, в тех местностях, где вода предельно жёсткая).
На производство поташа ещё Петр I в 1721 году установил монополию: «Нигде никому отнюдь поташа не делать и никому не продавать под страхом ссылки в вечную каторжную работу». С целью сбережения леса, поскольку вводил технологию производства поташа из «худых бочек, сучьев и прочих обрезков» то есть вторичная переработка.
Видео:Самый *ПРОСТОЙ* способ ПОЛУЧИТЬ ГИДРОКСИД КАЛИЯСкачать

Физические и химические свойства
Выглядит как бесцветные или белые кристаллы, имеющие моноклинную сингонию, переходит в гексагональную при 420 °C. Плотность моноклинной модификации 2,44 г/см 3 , гексагональной 2,27 г/см 3 . Температура плавления — 891 °C. Растворим в воде: 105,5/100 мл (0 °C), 110,5 (20 °C), 155,7 (100 °C). Гигроскопичен.
Образует несколько различных гидратов с 5, 1,5 и 0,5 молекулами воды, гидрат с 1,5·H2O образуется при кристаллизации из водных растворов и хранении безводной формы на воздухе. Все перечисленные гидраты полностью обезвоживаются при 150—160 °C.
Водные растворы карбоната калия присоединяют углекислый газ с образованием гидрокарбоната калия. С двуокисью серы водные растворы реагируют с образованием гидросульфита калия и двуокиси углерода.
Видео:Опыты по химии. Разложение карбоната кальция при нагреванииСкачать

Получение
Карбонат калия получают:
- как побочный продукт получается при переработке нефелинов.
- путём электролиза хлорида калия, в результате чего образуется гидроксид калия, который, вступая в реакцию с углекислым газом, образует воду и карбонат калия:
2KOH + CO2 → K2CO3 + H2O
- воздействием CO2 на раствор гидроксида калия.
Для использования в качестве удобрения, поташ получают из щёлока при выщелачивании водой золы из злаков или водорослей, так как именно карбоната калия больше всего в растворимой части растительных остатков (белая «зола» от костра — в основном поташ). Принцип добычи: в глиняный обожжённый сосуд с небольшим отверстием на дне насыпали золу и слегка утрамбовывали. Потом его заливали определённым количеством воды. Воду, прошедшую через сосуд, тщательно собирали и ею заливали следующую партию. И так до тех пор, пока жидкость не приобретала сиропообразную консистенцию. После лишнюю жидкость выпаривали в металлической посуде и получали поташ.
Видео:Получение Карбоната Кальция - чистого мела. CaCO3.Скачать

Применение
Карбонат калия применяют:
- для изготовления жидкого мыла;
- для производства пигментов;
- для производства хрустального, оптического или тугоплавкого стекла;
- крашения;
- для выращивания сельскохозяйственных культур (соли калия являются хорошим удобрением для растений);
- в фотографии как элемент проявителей;
- в качестве добавки в строительный раствор и бетон для уменьшения температуры замерзания (даёт белые пятна, поэтому разрабатываются специальные противоморозные присадки, не дающие разводов);
- для производства других соединений калия;
- как поглотитель сероводорода при очистке газов;
- как обезвоживающий агент;
- зарегистрирован в качестве пищевой добавки E501.
Видео:Гидролиз солей. 9 класс.Скачать

Карбонат калия (поташ): получение, применение и химические свойства
Карбонат калия также известен как пищевая добавка Е501. Это мелкий кристаллический порошок, образующийся в результате химической реакции диоксида углерода и гидроксида калия. Вещество это достаточно давно известно. В старину его называли «поташ».
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Историческая справка
Углекислый калий с давних времен назывался поташ. Слово это имеет латинское происхождение. Дословно его можно перевести так: потт — горшок, аш — зола. Вот такой получается интересный перевод – горшок золы. Почему такое странное название? Это связано со старинным способом его получения.
Большую популярность поташ приобрел в 17-19 веках. Он выступал как основной химический реагент. Его использовали практически во всех отраслях промышленности тех лет. В Российской империи небезызвестный своими новаторскими идеями Петр Первый ввел монополию на производство поташа в 1721 году. Сегодня же карбонат калия относится к 3-му классу опасных веществ. Его производят во многих странах.
Видео:Проклятая химическая реакция 😜 #shortsСкачать

Применения поташа в истории
Итак, история исследования и использования такого вещества, как поташ, насчитывает не один век. Интересно, что он был известен еще древним римлянам. Они по достоинству оценили свойства данного вещества и использовали его для стирки. Именно они впервые подметили, что зола способна удалить даже сильные жирные пятна с вещей. Только спустя несколько веков этому нашли научное подтверждение. Оказывается, что поташ, попадая в воду, создает щелочную среду. Жирные вещества в ней просто напросто расщепляются.
Примечательно, что в больших объемах научились добывать карбонат калия уже в начале семнадцатого века. Такое производство по праву можно было назвать промышленным. Процесс его получения был трудоемок. Сначала строились большие каменные очаги. В них раздували сильный костер, поддерживая его дровами. Затем в специальном деревянном корыте смешивали сильно горячую воду и приготовленную древесную золу. Получался раствор, которым, как ни странно это звучит, поливали костер, следя, чтобы он не потух. Конечно, здесь требовалось мастерство и умение. Появились даже специальные люди обученные ремеслу, которых называли «поливала». Но как же получали сам поташ? Под костром, который долгое время периодически поливали раствором золы, появлялся слой карбоната калия. И чем больше по времени протекал этот процесс, тем наслоение было толще. Теперь только оставалось дождаться, пока он остынет. Потом его долбили и закатывали по небольшим бочкам. Но экономичным этот процесс нельзя было назвать. Чтобы получить один килограмм поташа уходил кубометр древесины.
Видео:Кто с кем реагирует?Скачать

Современные способы получения
Легче всего карбонат калия получить из щелочи в процессе выщелачивания водой золы из водорослей и злаков. Поташа больше всего содержится в растворимой составляющей растительных остатков. Еще сравнительно недавно принцип получения этого вещества был такой. В глиняный сосуд с маленьким отверстием на дне помещали золу. Затем ее утрамбовывали. Заливали строго отмеренным количеством горячей воды. Она должна была пройти через весь слой золы и стечь в емкость. Потом ее снова заливали в сосуд, так до тех пор, пока жидкость не приобретала густую консистенцию. Затем лишнюю воду выпаривали и после остывания получали поташ. Весь процесс был куда более экономичным, чем предыдущий. Требовалось уже не так много золы.
Сегодня это вещество получают в результате электролиза KCl. Это цепь сложных химических реакций. В итоге осуществляется гидролиз карбоната калия. Во взаимодействие вступают гидроксид К и углекислый газ. Формула реакции выглядит следующим образом: 2(КОН) + СО2 → К2СО3 + Н2О
Видео:Карбонат натрия из пищевой содыСкачать

Общие свойства карбоната калия
Это химическое вещество обладает следующими свойствами:
— Оно мгновенно растворяется в воде.
— Данное вещество не расщепляется в этаноле.
— Температура плавления кристаллического карбоната калия составляет 891 градус по Цельсию.
— Вещество обладает выраженным вкусом щелочи.
— Углекислый калий не имеет запаха.
Важно знать, в кристаллическом состоянии карбонат калия оказывает кератолитическое и выраженное противомикробное действие. Его бактерицидные свойства можно объяснить тем, что сухое вещество и его раствор – это сильная щелочь. При этом чем выше его температура, тем сильнее проявляются эти свойства. Поташ издревле использовался как средство, убивающее микробов и микроскопических вредителей.
Видео:8 класс. Составление уравнений химических реакций.Скачать

Применение
Благодаря своим щелочным свойствам углекислый калий способен регулировать уровень кислотности. Также ему под силу бороться с избытком влаги, перемешивать масляные и водные растворы в однородную массу. Он может применяться в качестве разрыхлителя теста в выпечке. Данное вещество используют в производстве алкогольных напитков. Здесь его применяют как стабилизатор. Естественно, что карбонат калия — вещество опасное, поэтому в пищевой промышленности он используется в малых количествах.
В сельском хозяйстве уже достаточно долгое время поташ известен как удобрение. Он препятствует размножению на культурных растениях насекомых и прочих вредителей. Раствор углекислого калия способен значительно улучшить качество пашни. Его свойства способствуют тому, что из почвы выводится излишняя кислотность. Раствором этого вещества дезинфицируют помещения. Особенно там, где долгое время содержится скот. Это курятники, конюшни, свинарники.
Нашел свое применение карбонат калия и в фармацевтике. Это активное вещество противопаразитарных мазей и суспензий. Они эффективно борются с такими паразитами, как вши и чесоточные клещи.
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Пищевая добавка Е501
Пищевая добавка Е501 – это мелкозернистый порошок. Его используют как компонент кулинарных изделий и алкогольных напитков. Он является примесью питьевой соды. В настоящее время она признана во многих странах опасной. В старину карбонат калия добавляли в малых количествах в пряники.
Помимо своего основного названия, эта пищевая добавка скрывается и под другими не менее известными наименованиями. Это и дикалий карбонат, и поташ, и калий углекислый. Но в действительности это одно и то же вещество. Оно небезопасно для здоровья человека и может спровоцировать сильные раздражения.
В результате исследований доказано, что карбонат калия (формула К2СО3) наносит вред организму человека. Но справедливости ради нужно отметить, что опасен он только во взвешенном состоянии. Если он попадает в верхние дыхательные пути, то непременно вызовет сильнейшее раздражение и аллергическую реакцию. Могут также проявиться астматические приступы у больных с хронической формой.
Это вещество также вызывает местное раздражение и зуд, если попадает на влажные кожные покровы и слизистую рта и глаз. Проявляется и в форме экземы. Если порошок попадает на руки или лицо, его необходимо немедленно смыть водой.
Видео:Химия 9 класс (Урок№19 - Угольная кислота.)Скачать

Первая помощь при вдыхании и попадании на кожу карбоната калия
Данное вещество не угрожает жизненно важным процессам в организме. Но между тем оно может спровоцировать массу негативных симптомов. При вдыхании наблюдается раздражение и отек. Поэтому необходимо незамедлительно вызвать скорую помощь. Затем вынести пострадавшего на свежий воздух.
Если вещество попало на слизистые или кожу, то его нужно сразу же смыть. Промывают холодной проточной водой в течение 15 минут. Если вещество попало по каким-то причинам в желудок, то делают промывание.
🔥 Видео
Реакции между растворами электролитов / Реакции ионного обменаСкачать

7 ПРОСТЫХ ХИМИЧЕСКИХ ОПЫТОВ!Скачать

Химия | Молекулярные и ионные уравненияСкачать