Рубидий — это щелочной металл. Белый, мягкий, весьма легкоплавкий. Чрезвычайно реакционноспособный. Сильнейший восстановитель.
Относительная молекулярная масса Mr = 85,468; относительная плотность для твердого состояния d(т) = 1,532; относительная плотность для жидкого состояния d(ж) = 1, 472; tпл = 39,3º C; tкип = 696º C.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Способ получения
1. Рубидий получают в промышленности путем разложения гидрида рубидия при температуре выше 200º С, при этом образуются рубидий и водород :
2RbH = 2Rb + H2
2. В результате электролиза жидкого гидроксида рубидия образуются рубидий, кислород и вода :
4RbOH → 4Rb + O2↑ + 2H2O
3. В результате разложения оксида рубидия при 400 — 550º С получается пероксид рубидия и рубидий:
4. Жидкий хлорид рубидия подвергают электролизу, в результате чего на выходе образуется рубидий и хлор:
2RbCl = 2Rb +Cl2↑
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Качественная реакция
Качественная реакция на рубидий — окрашивание пламени солями рубидия в фиолетовый цвет .
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Химические свойства
1. Рубидий — сильный восстановитель . Поэтому он реагирует почти со всеми неметаллами :
1.1. Рубидий легко реагирует с водородом при 300–350º C и повышенным давлением с образованием гидрида рубидия:
2Rb + H2 = 2RbH
1.2. Рубидий сгорает в кислороде (воздухе) с образованием надпероксида рубидия:
а если сгоранием происходит в холодной среде, то образуется оксид рубидия:
1.3. Рубидий активно реагирует при комнатной температуре с фтором, хлором, бромом и йодом . При этом образуются фторид рубидия, хлорид рубидия, бромид рубидия, йодид рубидия :
2Rb + F2 = 2RbF
2Rb + Cl2 = 2RbCl
2Rb + Br2 = 2RbBr
2Rb + I2 = 2RbI
1.4. С серой рубидий реагирует при температуре 100–130º C с образованием сульфида рубидия:
2Rb + S = Rb2S
2. Рубидий активно взаимодействует со сложными веществами:
2.1. Рубидий реагирует с водой . Взаимодействие рубидия с водой приводит к образованию гидроксида рубидия и газа водорода:
2Rb 0 + 2 H2 O = 2 Rb + OH + H2 0
2.2. Рубидий взаимодействует с кислотами . При этом образуются соль и водород.
2.2.1. Рубидий реагирует с разбавленной соляной кислотой, при этом образуются хлорид рубидия и водород :
2Rb + 2HCl = 2RbCl + H2 ↑
2.2.2. При взаимодействии с разбавленной и холодной с ерной кислотой образуется сульфат рубидия, оксид серы (IV), осадок сера и вода:
2.2.3. Реагируя с разбавленной и холодной азотной кислотой рубидий образует нитрат рубидия, газ оксид азота (II), газ оксид азота (I), газ азот и воду:
2.2.4. В результате реакции насыщенной сероводородной кислоты и рубидия в бензоле образуется осадок гидросульфид рубидия и газ водород:
2Rb + 2H2S = 2RbHS↓ + H2↑
2.3. Рубидий может взаимодействовать с основаниями:
2.3.1. Рубидий взаимодействует с гидроксидом рубидия при температуре 400º С, при этом образуется оксид рубидия и водород:
2Rb + 2RbOH = 2Rb2O + H2
2.4. Рубидий вступает в реакцию с газом аммиаком при 40-60º С. В результате данной реакции образуется амид рубидия и водород:
2.5. Рубидий может вступать в реакцию с оксидами :
2.5.1. В результате взаимодействия рубидия и оксида кремния при температуре выше 300º С образуется силикат рубидия и кремний:
Видео:8 класс. Составление уравнений химических реакций.Скачать

РУБИДИЙ
РУБИДИЙ – (Rubidium) Rb, химический элемент 1-й (Ia) группы Периодической системы. Щелочной элемент. Атомный номер 37, относительная атомная масса 85,4678. В природе встречается в виде смеси стабильного изотопа 85 Rb (72,15%) и радиоактивного изотопа 87 Rb (27,86%) с периодом полураспада 4,8 . 10 10 лет. Искусственно получено еще 26 радиоактивных изотопов рубидия с массовыми числами от 75 до 102 и периодами полураспада от 37 мс (рубидий-102) до 86 дней (рубидий-83).
Степень окисления +1.
Рубидий был открыт в 1861 немецкими учеными Робертом Бунзеном и Густавом Кирхгоффом и стал одним из первых элементов, открытых методом спектроскопии, который был изобретен Бунзеном и Кирхгоффом в 1859. Название элемента отражает цвет наиболее яркой линии в его спектре (от латинского rubidus – глубокий красный).
Изучая с помощью спектроскопа различные минералы, Бунзен и Кирхгофф заметили, что один из образцов лепидолита, присланный из Розены (Саксония), дает линии в красной области спектра. (Лепидолит – минерал калия и лития, который имеет примерный состав K2Li3Al4Si7O21(OH,F)3.) Эти линии не встречались в спектрах ни одного из известных веществ. Вскоре аналогичные темно-красные линии были обнаружены в спектре осадка, полученного после испарения воды из образцов, взятых из минеральных источников Шварцвальда. Однако содержание нового элемента в опробованных образцах было ничтожным, и чтобы извлечь мало-мальски ощутимые количества, Бунзену пришлось выпаривать свыше 40 м 3 минеральных вод. Из упаренного раствора он осадил смесь хлороплатинатов калия, рубидия и цезия. Для отделения рубидия от его ближайших родственников (и особенно от большого избытка калия) Бунзен подверг осадок многократной фракционированной кристаллизации и получил хлориды рубидия и цезия из наименее растворимой фракции и затем перевел их в карбонаты и тартраты (соли винной кислоты), что позволило еще лучше очистить рубидий и освободить его от основной массы цезия. Бунзену удалось получить не только отдельные соли рубидия, но и сам металл. Металлический рубидий был впервые получен при восстановлении сажей кислой соли – гидротартрата рубидия.
Спустя четверть века русский химик Николай Николаевич Бекетов предложил другой способ получения металлического рубидия – восстановлением его из гидроксида алюминиевым порошком. Он проводил этот процесс в железном цилиндре с газоотводной трубкой, которая соединялась со стеклянным резервуаром-холодильником. Цилиндр подогревался на газовой горелке, и в нем начиналась бурная реакция, сопровождавшаяся выделением водорода и возгонкой рубидия в холодильник. Как писал сам Бекетов, «рубидий гонится постепенно, стекая, как ртуть, и сохраняя даже свой металлический блеск вследствие того, что снаряд во время операции наполнен водородом».
Распространение рубидия в природе и его промышленное извлечение. Содержание рубидия в земной коре составляет 7,8·10 –3 %. Это примерно столько же, как для никеля, меди и цинка. По распространенности в земной коре рубидий находится примерно на 20-м месте, однако в природе он находится в рассеянном состоянии, рубидий – типичный рассеянный элемент. Собственные минералы рубидия неизвестны. Рубидий встречается вместе с другими щелочными элементами, он всегда сопутствует калию. Обнаружен в очень многих горных породах и минералах, найденных, в частности, в Северной Америке, Южной Африке и России, но его концентрация там крайне низка. Только лепидолиты содержат несколько больше рубидия, иногда 0,2%, а изредка и до 1–3% (в пересчете на Rb2О).
Соли рубидия растворены в воде морей, океанов и озер. Концентрация их и здесь очень невелика, в среднем порядка 100 мкг/л. В отдельных случаях содержание рубидия в воде выше: в Одесских лиманах оно оказалось равным 670 мкг/л, а в Каспийском море – 5700 мкг/л. Повышенное содержание рубидия обнаружено и в некоторых минеральных источниках Бразилии.
Из морской воды рубидий перешел в калийные соляные отложения, главным образом, в карналлиты. В страссфуртских и соликамских карналлитах содержание рубидия колеблется в пределах от 0,037 до 0,15%. Минерал карналлит – сложное химическое соединение, образованное хлоридами калия и магния с водой; его формула KCl·MgCl2·6H2O. Рубидий дает соль аналогичного состава RbCl·MgCl2·6H2O, причем обе соли – калиевая и рубидиевая – имеют одинаковое строение и образуют непрерывный ряд твердых растворов, кристаллизуясь совместно. Карналлит хорошо растворим в воде, потому вскрытие минерала не составляет большого труда. Сейчас разработаны и описаны в литературе рациональные и экономичные методы извлечения рубидия из карналлита, попутно с другими элементами.
Тем не менее, большую часть добываемого рубидия получают как побочный продукт при производстве лития из лепидолита. После выделения лития в виде карбоната или гидроксида рубидий осаждают из маточных растворов в виде смеси алюморубидиевых, алюмокалиевых и алюмоцезиевых квасцов MAl(SO4)2·12H2O (M = Rb, K, Cs). Смесь разделяют многократной перекристаллизацией. Рубидий выделяют и из отработанного электролита, получающегося при получении магния из карналлита. Из него рубидий выделяют сорбцией на осадках ферроцианидов железа или никеля. Затем ферроцианиды прокаливают и получают карбонат рубидия с примесями калия и цезия. При получении цезия из поллуцита рубидий извлекают из маточных растворов после осаждения Cs3[Sb2Cl9]. Можно извлекать рубидий и из технологических растворов, образующихся при получении глинозема из нефелина.
Для извлечения рубидия используют методы экстракции и ионообменной хроматографии. Соединения рубидия высокой чистоты получают с использованием полигалогенидов.
Значительную часть производимого рубидия выделяют в ходе получения лития, поэтому появление большого интереса к литию для использования его в термоядерных процессах в 1950-х привело к уведичению добычи лития, а, следовательно, и рубидия и поэтому соединения рубидия стали более доступными.
Рубидий – один из немногих химических элементов, ресурсы и возможности добычи которого больше, чем нынешние потребности в нем. Официальная статистика по производству и использованию рубидия и его соединений отсутствует. Считают, что годовое производство рубидия составляет около 5 т.
Рынок рубидия очень мал. Активная торговля металлом не ведется, и рыночной цены на него нет. Цены, установленные компаниями, торгующими рубидием и его соединениями, различаются в десятки раз.
Характеристика простого вещества, промышленное получение и применение металлического рубидия. Рубидий – мягкий серебристо-белый металл. При обычной температуре он имеет почти пастообразную консистенцию. Плавится рубидий при 39,32° С, кипит при 687,2° С. Пары рубидия окрашены в зеленовато-синий цвет.
Рубидий обладает высокой реакционной способностью. На воздухе он мгновенно окисляется и воспламеняется, образуя надпероксид RbO2 (с примесью пероксида Rb2O2):
С водой рубидий реагирует со взрывом c образованием гидроксида RbOH и выделением водорода: 2Rb + 2H2O = 2RbOH + H2.
Рубидий непосредственно соединяется с большинством неметаллов. Однако с азотом он в обычных условиях не взаимодействует. Нитрид рубидия Rb3N образуется при пропускании в жидком азоте электрического разряда между электродами, изготовленными из рубидия.
Рубидий восстанавливает оксиды до простых веществ. Он реагирует со всеми кислотами с образованием соответствующих солей, а со спиртами дает алкоголяты:
Рубидий растворяется в жидком аммиаке, при этом получаются синие растворы, содержащие сольватированные электроны и обладающие электронной проводимостью.
Со многими металлами рубидий образует сплавы и интерметаллические соединения. Соединение RbAu, в котором связь между металлами имеет частично ионный характер, является полупроводником.
Металлический рубидий получают, в основном, восстановлением соединений рубидия (обычно галогенидов), кальцием или магнием:
2RbCl + 2Ca = 2Rb + CaCl2
Rb2CO3 + 3Mg = 2Rb + 3MgO + C
Реакцию галогенида рубидия с магнием или кальцием проводят при 600–800° С и 0,1 Па. Продукт очищают от примесей ректификацией и вакуумной дистилляцией.
Можно получить рубидий электрохимическим способом из расплава галогенида рубидия на жидком свинцовом катоде. Из образовавшегося свинцово-рубидиевого сплава рубидий выделяют дистилляцией в вакууме.
В небольших количествах рубидий получают восстановлением хромата рубидия Rb2CrO4 порошком циркония или кремния, а рубидий высокой чистоты – путем медленного термического разложения азида рубидия RbN3 в вакууме при 390–395° С.
Металлический рубидий – компонент материала катодов для фотоэлементов и фотоэлектрических умножителей, хотя по чувствительности и диапазону действия рубидиевые фотокатоды уступают некоторым другим, в частности цезиевым. Он входит в состав смазочных композиций, используемых в реактивной и космической технике. Пары рубидия используют в разрядных электрических трубках.
Металлический рубидий является компонентом катализаторов (его наносят на активную окись алюминия, силикагель, металлургический шлак) доокисления органических примесей в ходе производства фталевого ангидрида, а также процесса получения циклогексана из бензола. В его присутствии реакция идет при более низких температурах и давлениях, чем при активации катализаторов натрием или калием, и ему почти не мешают «смертельные» для обычных катализаторов яды – вещества, содержащие серу.
Рубидий опасен в обращении. Хранят его в ампулах из специального стекла в атмосфере аргона или в стальных герметичных сосудах под слоем обезвоженного минерального масла.
Соединения рубидия. Рубидий образует соединения со всеми обычными анионами. Почти все соли рубидия хорошо растворимы в воде. Как и у калия мало растворимы соли Rb2SiF6, Rb2PtCl6.
Видео:Рубидий - металл, который дороже золота.Скачать

Соединения рубидия с кислородом.
Рубидий образует многочисленные кислородные соединения, в том числе, оксид Rb2O, пероксид Rb2O2, надпероксид RbO2, озонид RbO3. Все они окрашены, например, Rb2O – ярко-желтый, а RbO2 – темно-коричневый. Надпероксид рубидия образуется при сжигании рубидия на воздухе. Пероксид рубидия получают окислением рубидия, растворенного в безводном аммиаке, безводным пероксидом водорода, а оксид рубидия – нагреванием смеси металлического рубидия и его пероксида. Оксид, пероксид и надпероксид термически устойчивы, они плавятся при температуре около 500° С.
Методом рентгеноструктурного анализа было показано, что соединение состава Rb4O6, полученное в твердом состоянии реакцией Rb2O2 с RbO2 в соотношении 1:2, имеет состав [Rb4(O2 2– )(O2 – )2]. При этом двухатомные анионы кислорода разных типов (пероксид и надпероксид) в кубической элементарной ячейке неразличимы даже при –60° С. Это соединение плавится при 461° С.
Озонид рубидия RbО3 образуется при действии озона на безводный порошок RbОН при низкой температуре:
Частичное окисление рубидия при низких температурах дает соединение состава Rb6O, которое разлагается выше –7,3° С с образованием блестящих кристаллов медного цвета, имеющих состав Rb9O2. Под действием воды соединение Rb9O2 воспламеняется. При 40,2° С оно плавится с разложением и образованием Rb2O и Rb в соотношении 2:5.
Карбонат рубидия Rb2CO3 плавится при 873° С, хорошо растворим в воде: при 20° С в 100г воды растворяется 450г карбоната рубидия.
В 1921 немецкие химики Франц Фишер (Fischer Franz) (1877–1947) и Ганс Тропш (Tropsch Hans) (1889–1935) нашли, что карбонат рубидия – превосходный компонент катализатора для получения синтетической нефти – синтола (смесь спиртов, альдегидов и кетонов, образующаяся из водяного газа при 410° C и давления 140–150 атм в присутствии специального катализатора).
Карбонат рубидия оказывает положительное действие на процесс полимеризации аминокислот, с его помощью получены синтетические полипептиды с молекулярной массой до 40 000, причем реакция протекает очень быстро.
Гидрид рубидия RbH получают взаимодействием простых веществ при нагревании под давлением 5–10 МПа в присутствии катализатора:
Это соединение плавится при 585° С; разлагается под действием воды.
Галогениды рубидия RbF, RbCl, RbBr, RbI получают при взаимодействии гидроксида или карбоната рубидия с соответствующими галогеноводородными кислотами, при реакции сульфата рубидия с растворимыми галогенидами бария, а также при пропускании сульфата или нитрата рубидия через ионообменную смолу.
Галогениды рубидия хорошо растворимы в воде, хуже – в органических растворителях. Они растворяются в водных растворах галогеноводородных кислот, образуя в растворе гидрогалогениды, устойчивость которых падает от гидродифторида RbHF2 к гидродииодиду RbHI2.
Фторид рубидия входит в состав специальных стекол и композиций для аккумулирования тепла. Он является оптическим материалом, прозрачным в диапазоне 9–16 мкм. Хлорид рубидия служит электролитом в топливных элементах. Его добавляют в специальные чугунные отливки для улучшения их механических свойств, он является компонентом материала катодов электроннолучевых трубок.
У смесей хлоридов рубидия с хлоридами меди, серебра или лития электрическое сопротивление падает с повышением температуры столь резко, что они могут стать весьма удобными термисторами в различных электрических установках, работающих при температуре 150–290° C.
Иодид рубидия используется как компонент люминесцентных материалов для флуоресцирующих экранов, твердых электролитов в химических источниках тока. Соединение RbAg4I5 имеет самую высокую электропроводность из всех известных ионных кристаллов. Его можно использовать в тонкопленочных батареях.
Комплексные соединения. Для рубидия не характерно образование ковалентных связей. Наиболее устойчивыми являются его комплексы с полидентатными лигандами, например с краун-эфирами, где он обычно проявляет координационное число 6.
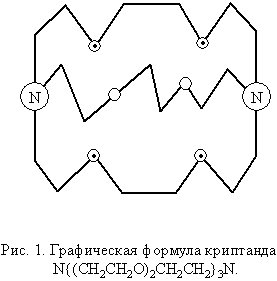
Другая группа очень эффективных лигандов, которые в последнее время используются для координации катионов щелочных элементов, – макроциклические полидентатные лиганды, которые французский химик-органик Жан Мари Лен назвал криптандами (рис. 1).
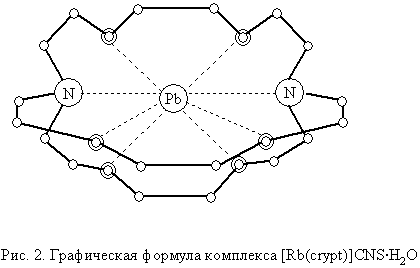
Рубидий образует комплекс [Rb(crypt)]CNS . H2O, в котором криптанд N<(CH2CH2O)2CH2CH2>3N (crypt) заключает катион в координационной полиэдр, имеющий форму двухшапочной тригональной призмы (рис. 2).
Озонид рубидия образует устойчивые растворы в органических растворителях (таких как CH2Cl2, тетрагидрофуран или СН3CN), если катион координирован краун-эфирами или криптандами. Медленное выпаривание аммиачных растворов таких комплексов приводит к образованию красных кристаллов. Рентгеноструктурный анализ соединения состава [Rb(18-crown-6)(O3)(NH3)] показал, что координационное число атома рубидия равно 9. Он образует шесть связей с краун-эфиром, две – с ионом O3 – и одну – с молекулой аммиака.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Применение изотопов рубидия.
Рубидий-87 самопроизвольно испускает электроны ( b -излучение) и превращается в изотоп стронция. Около 1% стронция образовалось на Земле именно этим путем, и если определить соотношение изотопов стронция и рубидия с массовым числом 87 в какой-либо горной породе, то можно с большой точностью вычислить ее возраст. Такой метод пригоден применительно к наиболее древним породам и минералам. С его помощью установлено, например, что самые старые скальные породы американского континента возникли 2100 млн лет тому назад.
Радионуклид рубидия-82 с периодом полураспада 76 с используется в диагностике. С его помощью, в частности, оценивают состояние миокарда. Изотоп вводится в кровеносную систему пациента, и кровоток анализируется методом позитронно-эмиссионной томографии (ПЭТ).
Видео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 💡 ВидеоПроклятая химическая реакция 😜 #shortsСкачать  КАК УРАВНЯТЬ ХИМИЧЕСКУЮ РЕАКЦИЮ?Скачать  Как расставлять коэффициенты в уравнениях реакций? #shorts #youtubeshortsСкачать  Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать  Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать  Типы химических реакций#shortsСкачать  ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать  8 класс. Распределение электронов в атоме. Электронные формулы.Скачать  Реакции металлов с кислородом и водой. 8 класс.Скачать  РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать  ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать  БЕЗ ЭТОГО НЕ СДАТЬ ЕГЭ по Химии — Электронная конфигурация атомаСкачать  ХИМИЧЕСКИЕ УРАВНЕНИЯ - Топ 5 Ошибок в уравнениях химических реакций // Подготовка к ЕГЭ по ХимииСкачать  |