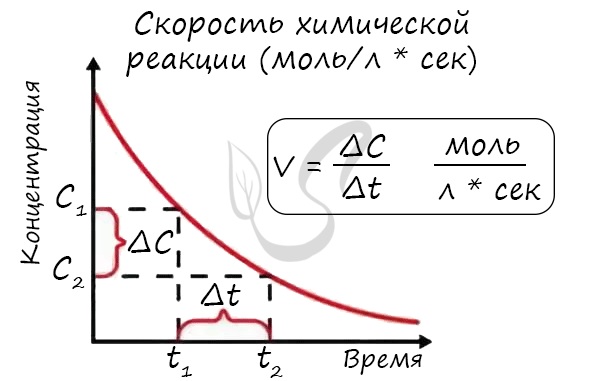
Скорость химической реакции — основное понятие химической кинетики, выражающее отношения количества прореагировавшего вещества (в молях) к отрезку времени, за которое произошло взаимодействие.
Скорость реакции отражает изменение концентраций реагирующих веществ за единицу времени. Единицы измерения для гомогенной реакции: моль/л * сек. Физический смысл в том, что каждую секунду какое-то количество одного вещества превращается в другое в единице объема.
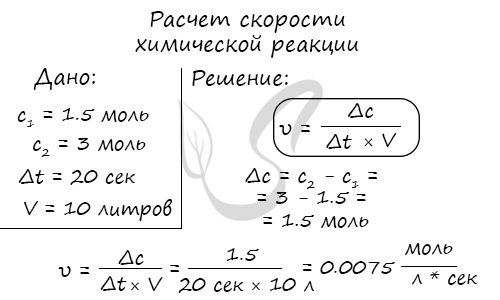
Мне встречались задачи, где была дана молярная концентрация вещества до реакции и после, время и объем. Требовалось посчитать скорость реакции. Давайте решим подобное несложное задание для примера:
Молярная концентрация вещества до реакции составляла 1.5 моль/л по итогу реакции — 3 моль/л. Объем смеси 10 литров, реакция заняла 20 секунд. Рассчитайте скорость реакции.
Влияние природы реагирующих веществ
При изучении агрегатных состояний веществ возникает вопрос: где же быстрее всего идут реакции: между газами, растворами или твердыми веществами?
Запомните, что самая высокая скорость реакции между растворами, в жидкостях. В газах она несколько ниже.
Если реакция гетерогенная: жидкость + твердое вещество, газ + твердое вещество, жидкость + газ, то большую роль играет площадь соприкосновения реагирующих веществ.
Очевидно, что большой кусок железа, положенный в соляную кислоту, будет гораздо дольше реагировать с ней, нежели чем измельченное железо — железная стружка.
Химическая активность также играет важную роль. Например, отвечая на вопрос «какой из металлов Fe или Ca быстрее прореагирует с серой?» мы отдадим предпочтение кальцию, так как в ряду активности металлов он стоит левее железа, а значит кальций активнее железа.
Иного подхода требуют реакции металлов с водой, где нужно учитывать радиус атома. Например, отвечая на вопрос «какой из металлов Li или K быстрее прореагирует с водой?» мы отдадим предпочтение калию, так как калий имеет больший радиус атома. Калий будет быстрее взаимодействовать с водой, чем литий.
Иногда для верного ответа на вопрос о скорости реакции требуется знание активности кислот. Мы подробнее обсудим эту тему в гидролизе, однако сейчас я замечу: чем сильнее (активнее) кислота, тем быстрее идет реакция.
Например, реакцию магния с серной кислотой протекает гораздо быстрее реакции магния с уксусной кислотой. Причиной этому служит то, что серная кислота относится к сильным (активным) кислотам, а активность уксусной кислоты меньше, она является слабой кислотой.
Как я уже упомянул, слабые и сильные кислоты и основания изучаются в теме гидролиз.
Влияние изменения концентрации
Влияние концентрации «прямо пропорционально» скорости реакции: при увлечении концентрации реагирующего вещества скорость реакции повышается, при уменьшении — понижается.
Замечу деталь, которая может оказаться важной, если в реакции участвуют газы: при увеличении давления концентрация вещества на единицу объема возрастает (представьте, как газ сжимается). Поэтому увеличение давление, если среди исходных веществ есть газ, увеличивает скорость реакции.
Закон действующих масс устанавливает соотношение между концентрациями реагирующих веществ и их продуктами. Скорость простой реакции aA + bB → cC определяют по уравнению:
Физический смысл константы скорости — k — в том, что она численно равна скорости реакции при том условии, что концентрации реагирующих веществ равны 1. Обратите внимание, что стехиометрические коэффициенты уравнения переносятся в степени — a и b.
Записанное выше следствие закона действующих масс нужно не только «зазубрить», но и понять. Поэтому мы решим пару задач, где потребуется написать подобную формулу.
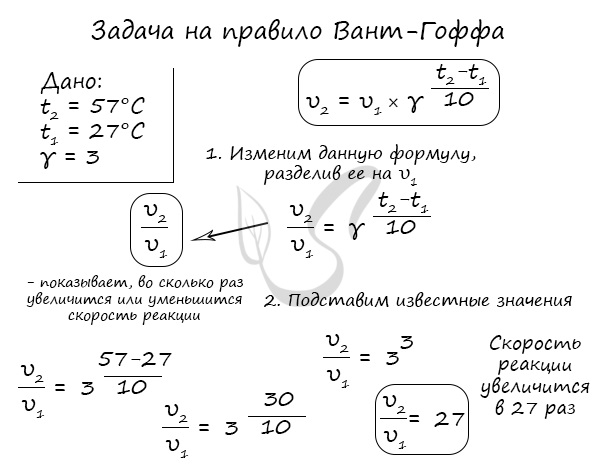
Окисление диоксида серы протекает по уравнению: 2SO2(г) + O2 = 2SO3(г). Как изменится скорость этой реакции, если объемы системы уменьшить в три раза?
По итогу решения становится ясно, что скорость реакции в таком случае возрастет в 27 раз.
Решим еще одну задачу. Дана реакция синтеза аммиака: N2 + ЗН2 = 2NH3. Как изменится скорость прямой реакции образования аммиака, если уменьшить концентрацию водорода в два раза?
В результате решения мы видим, что при уменьшении концентрации водорода в два раза скорость реакции замедлится в 8 раз.
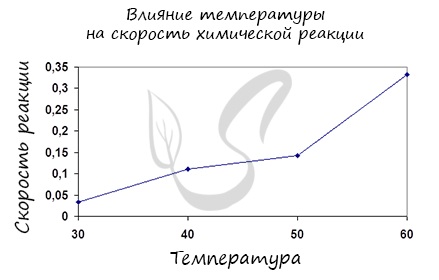
Влияние изменения температуры на скорость реакции
Постулат, который рекомендую временно взять на вооружение: «Увеличение температуры увеличивает скорость абсолютно любой химической реакции: как экзотермической, так и эндотермической. Исключений нет!»
Очень часто в заданиях следующей темы — химическом равновесии, вас будут пытаться запутать и ввести в заблуждение, но вы не поддавайтесь и помните про постулат!
Итак, влияние температуры на скорость реакции «прямо пропорционально»: чем выше температура, тем выше скорость реакции — чем ниже температура, тем меньше и скорость реакции. Однако, как и в случае с концентрацией, это больше чем простая «пропорция».
Правило Вант-Гоффа, голландского химика, позволяет точно оценить влияние температуры на скорость химической реакции. Оно звучит так: «При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза»
В формуле, написанной выше, используются следующие обозначение:
- υ1 — скорость реакции при температуре t1
- υ2 — скорость реакции при температуре t2
- γ — температурный коэффициент, который может быть равен 2-4
Если по итогам решения задач у вас получится температурный коэффициент меньше 2 или больше 4, то, скорее всего, где-то вы допустили ошибку. Используйте этот факт для самопроверки.
Для тренировки решим пару задач, в которых потребуется использование правило Вант-Гоффа.
Как изменится скорость гомогенной реакции при повышении температуры от 27°C до 57°C при температурном коэффициенте, равном трем?
Иногда в задачах требуется рассчитать температурный коэффициент, как, например, здесь: «Рассчитайте, чему равен температурный коэффициент скорости, если известно, что при понижении температуры от 250°C до 220°C скорость реакции уменьшилась в 8 раз».
Катализаторы и ингибиторы
Катализатор (греч. katalysis — разрушение) — вещество, ускоряющее химическую реакцию, но не участвующее в ней. Катализатор не расходуется в химической реакции.
Многие химические реакции в нашем организме протекают с участием катализаторов — белковых молекул, ферментов. Без катализаторов подобные реакции шли бы сотни лет, а с катализаторами идут одну долю секунды.
Катализом называют явление ускорения химической реакции под действием катализатора, а химические реакции, идущие с участием катализатора — каталитическими.
Ингибитор (лат. inhibere — задерживать) — вещество, замедляющее или предотвращающее протекание какой-либо химической реакции.
Ингибиторы применяют для замедления коррозии металла, окисления топлива, старения полимеров. Многие лекарственные вещества являются ингибиторами.
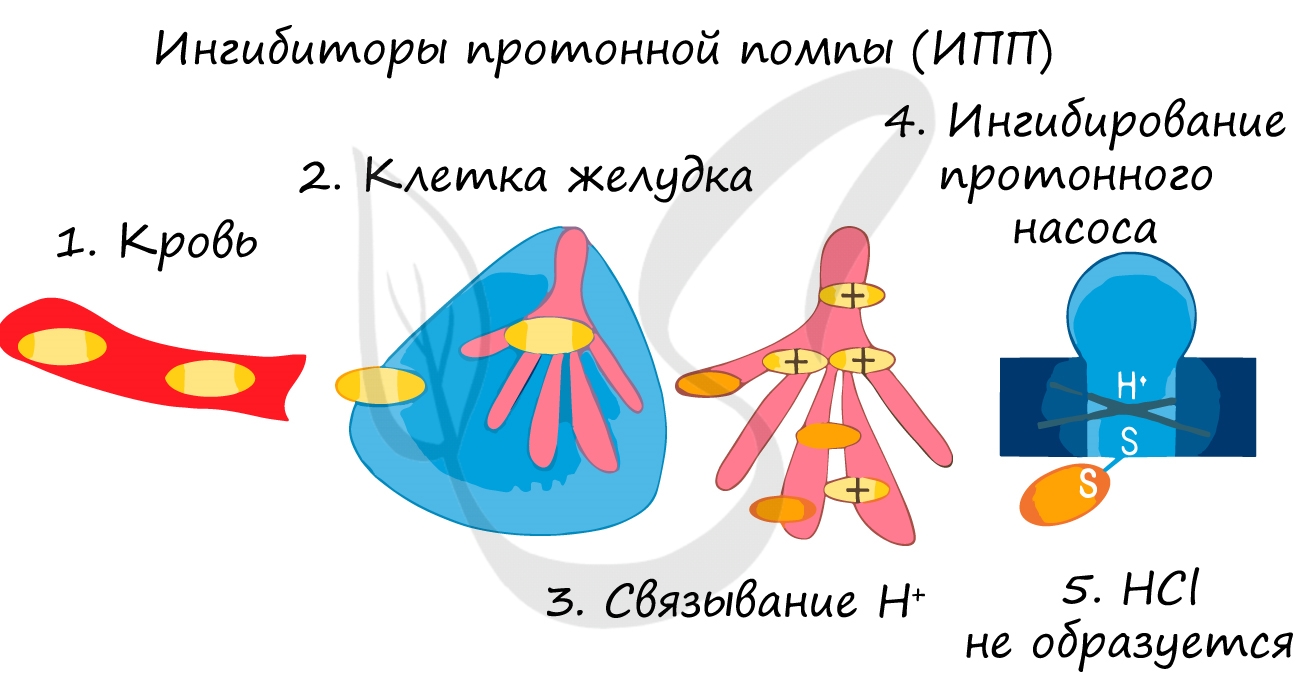
Так при лечении гастрита — воспаления желудка (греч. gaster — желудок) или язв часто назначаются ингибиторы протонной помпы — химические вещества, которые блокирует выработку HCl слизистой желудке. В результате этого соляная кислота прекращает воздействие на поврежденную стенку желудка, воспаление стихает.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Скорость химической реакции
Видео:Решение задач на тему: "Правило Вант-Гоффа". 1 часть. 10 класс.Скачать

Расчеты изменения скорости реакции
Задача 331.
Реакция между веществами А и В выражается уравнением: А + 2В → С. Начальные концентрации составляют: [А]0 = 0,03 моль/л, [В]0 = 0,05 моль/л. Константа скорости реакции равна 0,4. Найти начальную скорость реакции и скорость реакции по истечении некоторого времени, когда концентрация вещества А уменьшится на 0,01 моль/л.
Решение:
До изменения концентрации скорость реакции можно выразить уравнением:
v — скорость реакции, k — константа скорости реакции, [А] и [В] – концентрации исходных веществ.
Для нахождения скорости реакции по истечении некоторого времени учтём, что на образование 1 моля вещества С затрачивается 1 моль вещества А и 2 моля вещества В, поэтому при уменьшении концентрации вещества А на 0,01 моль/л, концентрация вещества В уменьшится соответственно на 0,02 моль/л (2 . 0.01 = 0,02). Тогда оставшиеся концентрации веществ будут равны [A]ост. = 0.03 – 0,01 = 0,02 моль/л, [B]ост. = 0,05 – 0,02 = 0,03моль/л. Тогда скорость реакции по истечении некоторого времени будет составлять:
Ответ: v1 = 3 . 10 -5 ; v2 = 7,2 . 10 -6 .
Задача 332.
Как изменится скорость реакции 2NO (г.) + O2 (г.) → 2NO2 (г.), если: а) увеличить давление в системе в 3 раза; б) уменьшить объем системы в 3 раза; в) повысить концентрацию в 3 раза?
Решение:
До изменения объёма, давления и концентрации скорость реакции можно выразить уравнением:
а) Вследствие увеличения давления в системе в 3 раза, соответственно концентрация каждого из реагирующих веществ возрастёт в 3 раза. Следовательно, теперь скорость реакции будет равна:
Тогда, сравнивая выражения v и vа) , находим, что скорость реакции возрастает в 27 раз
б) при уменьшении объёма в 3 раза в системе концентрация каждого из реагирующих веществ возрастёт в 3 раза. Следовательно, теперь скорость реакции будет равна:
Тогда, сравнивая выражения v и vб), находим, что скорость реакции возрастает в 27 раз
в) При увеличении концентрации NO в 3 раза скорость реакции будет равна:
Cравнивая выражения v и vв), находим, что скорость реакции возрастает в 9 раз
Ответ: а) возрастёт в 27 раз; б) возрастёт в 27 раз; в) возрастёт в 9 раз.
Задача 333.
Две реакции протекают при 25 °С с одинаковой скоростью. Температурный коэффициент скорости первой реакции равен 2,0, а второй 2,5. Найти отношение скоростей этих реакций при 95°С.
Решение:
Зависимость скорости реакции (или константы скорости реакции) от температуры может быть выражена уравнением:
Здесь vt и kt — скорость и константа скорости реакции при температуре t °С; v(t + 10) и k(t + 10) те же величины при температуре (t + 10 °С); 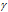
Поскольку 
Скорость второй реакции равна:
Найдём отношение этих скоростей:
Ответ:
Задача 334.
Чему равен температурный коэффициент скорости реакции, если при увеличении температуры на 30 градусов скорость реакции возрастает в 15,6 раза?
Решение:
Согласно правилу Вант Гоффа зависимость скорости реакции от температуры выражается уравнением:
vt и kt — скорость и константа скорости реакции при температуре t °С; v(t + 10) и k(t + 10) те же величины при температуре (t + 10 °С); 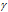

Ответ: 2,5.
Задача 335.
Температурный коэффициент скорости некоторой реакции равен 2,3. Во сколько раз увеличится скорость этой реакции, если повысить температуру на 25 градусов?
Решение:
Согласно правилу Вант Гоффа зависимость скорости реакции от температуры выражается уравнением:
vt и kt — скорость и константа скорости реакции при температуре t °С; v(t + 10) и k(t + 10) те же величины при температуре (t + 10 °С); 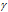

Видео:Решение задач на тему: "Правило Вант-Гоффа". 2 часть. 10 класс.Скачать
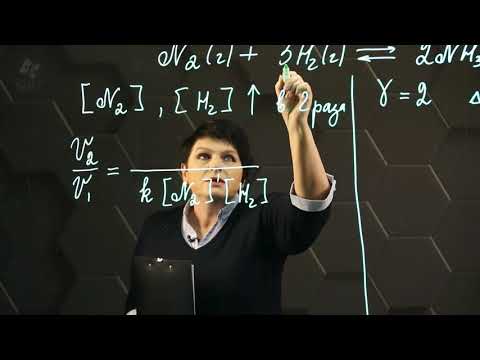
Задачи с использованием закона Вант-Гоффа
Пример 1
Как изменится скорость гомогенной реакции при повышении температуры от 67 0 до 97 0 при температурном коэффициенте, равном четырём?
Решение
Запишем формулу закона Вант-Гоффа:
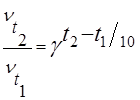
Подставим известные данные: 
Пример 2
Рассчитайте, чему равен температурный коэффициент скорости, если известно, что при понижении температуры от 150 0 до 120 0 скорость реакции уменьшилась в 27 раз.
Решение
Запишем формулу закона Вант-Гоффа
и выразим из неё 



где t2=120, t1=150 (температура понижается ), а 
______
СОВЕТ: помните, что значение 
1.2.3 Задачи с использованием закона объёмных отношений
Формулировка закона: если в реакцию вступают газообразные вещества и такие же вещества образуются в результате реакции, то их обёмы относятся друг к другу как небольшие целые числа, равные стехиометрическим коэффициентам в уравнении реакции перед формулами этих веществ. Например, для гомогенной реакции aA + bB = cC + dDформула будет выглядеть следующим образом:
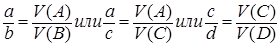
Этот закон относится к основным законам химии и может быть использован в химической кинетике применительно к концентрации.
Пример 1
Реакция идет по уравнению 2Н2(г)+O2(г)=2Н2O(г). Концентрации исходных веществ до начала реакции были [Н2]=0,06 моль/л, [O2]=0,02 моль/л. вычислите концентрации этих веществ в момент, когда [Н2O]=0,01 моль/л.
Решение
В этой реакции Н2(г) и O2(г) относятся к исходным веществам, концентрация которых с течением времени уменьшается по мере того, как эти вещества расходуются, а Н2O(г) – к продуктам реакции, концентрация которых с течением времени увеличивается по мере того, как эти вещества образуются. Из закона объёмных отношений следует, что один объём О2 взаимодействует с двумя объёмами Н2и при этом образуется два объёма Н2O, т. е. если получается 0,01 моль/л Н2O, то расходуется столько же Н2 и в два раза меньше О2. В виде формулы это можно записать следующим образом:

где обр-образованное и изр-израсходованное;

Таким образом концентрации этих веществ в момент, когда [Н2O]=0,01 моль/л будет равна: [H2]=[H2]нач-[H2]изр=0,06-0,01=0,05моль/л и [O2]=[O2]нач-[O2]изр=0,02-0,005=0,015 моль/л (где нач- начальная концентрация веществ).
Пример 2
До начала реакции концентрации исходных веществ в гомогенной системе K+2L=3M+Fбыли равны: [K]=0,5 моль/л, [L]=0,12 моль/л. Найдите концентрации всех веществ на тот момент времени, когда концентрация Lуменьшилась в три раза.
Решение
При уменьшении концентрации Lв три раза, на данный момент времени она будет равна [L] = [L]нач / 3 = 0,12 / 3 =0,4 моль/л. Следовательно, в ходе реакции израсходовалось некоторое количество вещества L:[L]изр = [L]нач-[L] = 0,12 – 0,4 = 0,8 моль/л. В случае определения концентрации вещества К следует помнить, что вещество Lне расходуется само по себе, а вступает в реакцию с К в соотношении 2 к 1,т. е. 
Значит, на данный момент времени концентрация вещества Кбудет равна [К] = [К]нач — [К]изр = 0,5 – 0,4.= 0,1 моль/л. Также по закону объёмных отношений можно найти и концентрации образованных веществ MиF:
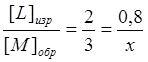
Концентрацию вещества F можно найти таким же образом по концентрации K или L, а можно и полученной концентрации М:

Поскольку не были даны исходные концентрации этих веществ, то мы можем считать, что начальная концентрация продуктов реакции равна нулю. Следовательно, на тот момент времени, когда концентрация Lуменьшилась в три раза, концентрации других веществ будут равны: [К] = 0,1 моль/л;[M] = 0,12 моль/л; [F] =0,4 моль/л.
______
СОВЕТ: в формулу закона необходимо подставлять не начальные или конечные концентрации для исходных веществ, а именно израсходованные, прореагировавшие.
2 Химическое равновесие
В химических реакциях исходные вещества не всегда полностью превращаются в продукты реакции. Это происходит потому, что по мере накопления продуктов реакции могут создаваться условия для протекания обратимой реакции в противоположном направлении. Например, если смешать пары иода с водородом при температуре 200°С, то произойдет реакция:
Однако известно, что йодистый водород уже при нагревании до 180 °С начинает разлагаться на иод и водород:

Понятно, что в этих условиях не произойдет ни полного разложения НI, так как продукты реакции способны вновь реагировать между собой, ни полного образования йодистого водорода.
Основные понятия и законы
Обратимаяхимическая реакция – это реакция, в ходе которой происходят превращения как в прямом, так и в обратном направлениях, Первым, кто четко сформулировал представление об обратимости химических реакций, был К.Бертолле (1799). Участвуя в Египетской экспедиции Бонапарта, он обратил внимание на образование карбоната натрия в соляных озерах и пришел к заключению, что карбонат натрия образуется в результате взаимодействия между насыщенным раствором хлорида натрия и растворенным карбонатом кальция. Этот процесс обратен проводимой в лаборатории реакции между карбонатом натрия и растворенным хлоридом кальция с образованием карбоната кальция.
При написании уравнений обратимых реакций вместо знака равенства ставят две противоположно направленные стрелки. Уравнение рассмотренной выше обратимой реакции запишется следующим образом:
Реакцию, протекающую слева направо, называют прямой (константа скорости прямой реакции k1), справа налево — обратной (константа скорости обратной реакции k2).
В обратимых реакциях скорость прямой реакции вначале имеет максимальное значение, а затем уменьшается вследствие уменьшения концентрации исходных веществ, расходуемых на образование продуктов реакции. И наоборот, обратная реакция в начальный момент имеет минимальную скорость, которая увеличивается по мере увеличения концентрации продуктов реакции. Следовательно, скорость прямой реакции уменьшается, а обратной — увеличивается. Наконец, наступает такой момент, когда скорости прямой и обратной реакций становятся равными.
 |
Рисунок 4 — График изменения скоростей прямой и обратной реакций во времени 1


 |
Рисунок 5 — График изменения скоростей прямой и обратной реакций во времени 2
Химическое равновесие — состояние системы, в котором скорость прямой реакции (V1) равна скорости обратной реакции (V2). При химическом равновесии концентрации веществ остаются неизменными. Химическое равновесие имеет динамический характер: прямая и обратная реакции при равновесии не прекращаются. Положение равновесия можно определить, зная скорости прямой и обратной реакций. Уравнение обратимой реакции имеет вид
согласно закону действующих масс, скорости прямой реакции u1 и обратной u2 соответственно запишутся следующим образом:
В равновесии скорости прямой и обратной реакций равны:
Состояние химического равновесия количественно характеризуется константой равновесия, представляющей собой отношение констант прямой (K1) и обратной (K2) реакций. Преобразуем эту формулу и получим:
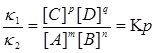
Константа равновесия зависит от температуры и природы реагирующих веществ. Чем больше константа равновесия, тем больше равновесие сдвинуто в сторону образования продуктов прямой реакции, т. е. численное значение константы равновесия характеризует тенденцию к осуществлению реакции или, другими словами, характеризует выход данной реакции. Так, при К >> 1 выход реакции велик (равновесие смещено в сторону прямой реакции ), так как при этом
🎬 Видео
Задачи на правило Вант-Гоффа. Зависимость скорости реакции от температуры.Скачать

Правило Вант-Гоффа для ЕНТ по химии 2023 | Химия ЕНТ УмскулСкачать

124. Правило Вант-Гоффа. Решение задач.Скачать

Задача на правило Вант-Гоффа. Скорость порчи продуктов.Скачать

Задача на правило Вант Гоффа. По условию Vt2 = Vt1+72Скачать

Использование правила Вант-Гоффа для решения зада. Химия для поступающих.Скачать

Осмос и осмотическое давлениеСкачать

Задача на правило Вант-Гоффа. Усложненный вариант.Скачать

Влияние температуры на скорость химических реакций. 10 класс.Скачать

Химическое равновесие. Закон действующих масс.Скачать

Закон Вант-ГОФФАСкачать

Вывод уравнения Вант-Гоффа для осмотического давленияСкачать

Решение задач на термохимические уравнения. 8 класс.Скачать

123. Решение задач на нахождение скорости хим. реакции по известным концентрациям и времени.Скачать

Уравнение Вант-ГоффаСкачать

6 Уравнение Аррениуса, ч 2Скачать

Задачи на скорость реакции в зависимости от концентрации реагентовСкачать

Химия 11 класс | Вуз | Правило Вант-Гоффа | Химическая кинетика | Изменение скорости от температурыСкачать