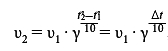материал для подготовки к егэ (гиа) по химии (9, 11 класс) на тему
Данный тип задач можно использовать на уроках химии и при подготовке к итоговой аттестации в 9 , 11 классах.
Видео:Задачи на ТЕПЛОВОЙ ЭФФЕКТ | Термохимические уравненияСкачать

Скачать:
| Вложение | Размер |
|---|---|
| Расчеты по термохимическим уравнениям реакций | 35.5 КБ |
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Предварительный просмотр:
Решение задач на нахождение теплового эффекта
- При сжигании 4,35л метана выделилось 173 кДж теплоты. Чему равен тепловой эффект данной реакции. CH 4 + 2O 2 = CO 2 + 2H 2 O + Q
- При окислении 1г глюкозы выделилось 15,64 кДж теплоты. Определить тепловой эффект реакции. C 6 H 12 O 6 + 6O 2 = 6CO 2 + 6H 2 O + Q
- Термохимическое уравнение реакции горения магния
2Mg + O 2 = 2MgO + 1127 кДж. Сколько теплоты выделится при сгорании 2,4г магния.
- При сжигании 2л ацетилена выделилось 116,0 кДж теплоты. Найдите тепловой эффект данной реакции. 2C 2 H 2 + 5O 2 = 4CO 2 + 2H 2 O + Q
- Термохимическое уравнение реакции CH 4 + 2O 2 = CO 2 + 2H 2 O + 880 кДж
Вычислите количество теплоты, которое выделиться при сжигании 112л метана.
- Термохимическое уравнение реакции разложения карбоната кальция
CaCO 3 = CaO + CO 2 – 178 кДж. Вычислите количество теплоты, которое необходимо затратить для разложения 20г карбоната кальция.
- Термохимическое уравнение реакции горения сероводорода
2H 2 S + 3O 2 = 2SO 2 + 2H 2 O + 1166 кДж. Сколько теплоты выделится при сгорании 11,2л сероводорода.
- При сжигании 5,6 л метана выделилось 223,0 кДж теплоты. Определите тепловой эффект данной реакции. CH 4 + 2O 2 = CO 2 + 2H 2 O + Q.
- При сжигании 1,0г серы выделилось 9,3 кДж теплоты. Определите тепловой эффект данной реакции. S + O 2 = SO 2 + Q.
- Термохимическое уравнение реакции сгорания ацетилена
2C 2 H 2 + 5O 2 = 4CO 2 + 2H 2 O + 2610 кДж. Сколько теплоты выделяется при сгорании ацетилена объемом 1,12л?
- Термохимическое уравнение горения этилена
C 2 H 4 + 3O 2 = 2CO 2 + 2H 2 O + 1140 кДж. Какой объем этилена нужно сжечь, чтобы получить 70 кДж теплоты?
- В результате сгорания ацетилена объемом 1,12л выделилось 65,25 кДж теплоты. Составьте термохимическое уравнение реакции.
2C 2 H 2 + 5O 2 = 4CO 2 + 2H 2 O + Q.
13. Термохимическое уравнение горения этилена
C 2 H 4 + 3O 2 = 2CO 2 + 2H 2 O + 1400 кДж. Какое количество теплоты выделится при сгорании 44,8л этилена?
- Термохимическое уравнение горения угарного газа 2CO + O 2 = 2CO 2 + 566 кДж.
Какой объем угарного газа должен сгореть, чтобы выделилось 152 кДж теплоты.
Видео:Решение задач по термохимическим уравнениям. Практическое занятие. Видеоурок 40. Химия 9 классСкачать

Задачи по термохимии
Просмотр содержимого документа
«Задачи по термохимии»
Расчеты по термохимическим уравнениям (экзотермические, эндотермические реакции, тепловой эффект)
1. Составьте термохимическое уравнение реакции горения магния, если известно, что при
сгорании магния массой 12 г выделилось количество теплоты 307,2 кДж.
(2 Mg(к) + O2(г) = 2 MgO(к) + 1228,8 кДж.)
2. Вычислите по термохимическому уравнению 4 P(к) + 5O2(г) =2 P2O5(к) + 3010 кДж
количество теплоты, выделяемой при сгорании 31 г фосфора. (752,5 кДж.)
3. По термохимическому уравнению CaCO3(к) = CaO(к) + СO2(г) — 157 кДж
Вычислите массу разложившегося известняка, если известно, что на его разложение
затрачено 1570 кДж (1000 г)
4. При сгорании кальция массой 8 г, выделилось количество теплоты 127 кДж.
Составьте термохимическое уравнение реакции.
вычислите количество теплоты, которая поглотится при получении кислорода (н.у.) объемом 6,72 л. (76,5 кДж)
вычислите массу гидроксида натрия, вступившего в реакцию, если известно, что при
его нейтрализации выделилось количество теплоты 725 кДж. (200 г.)
На разложение оксида ртути (II) массой 8,68 г затрачено количество теплоты 3,64кДж.
Составьте термохимическое уравнение реакции.
Задачи на тепловой эффект химической реакции 11 класс
1.При взаимодействии углерода массой 6г с водородом выделилось 37,42 кДж теплоты. Напишите термохимическое уравнение образования метана.
2. Тепловой эффект горения метана 890,31 кДж. Составьте термохимическое уравнение горения метана. 1) Рассчитайте, какое количество теплоты выделится, если сжечь метана: а) количеством вещества 0,8 моль; б) объёмом 250 мл ; в) массой 200 г.? 2) Сколько необходимо взять метана по объёму и по массе, чтобы при этом выделилось 148,385 кДж теплоты?
3.Рассчитайте по термохимическому уравнению
Какое количество теплоты выделится, если кислорода расходуется:
a) массой 16г; б) объёмом 67,2л; в) количеством вещества 2б5 моль.
Сколько оксида углерода(IV) по объёму и по массе получится, если при горении пропена выделится 277,5 кДж теплоты?
4.Составьте термохимическое уравнение реакций горения этилена, если известно, что тепловой эффект реакции 1410,97 кДж. 1)Сколько теплоты выделится, если сгорает этилена; а) количеством вещества 5 моль; б) массой 140 г в) объёмом 112л.?
2) Сколько кислорода (по объёму и по массе) необходимо сжечь, чтобы выделилось
Видео:Термохимические реакции. Практическая часть - решение задачи. 9 класс.Скачать

Расчёты по термохимическим уравнениям
Теоретический материал представлен на страницах:
Любая химическая реакция сопровождается поглощением или выделением энергии. Термохимические уравнения показывают соотношение между кол-вом веществ, вступающих в реакцию, и кол-вом энергии, которую выделяют, либо поглощают эти вещества в процессе химической реакции.
Главное отличие термохимического уравнения от молекулярного заключается в том, что кроме формул и коэффициентов, в нем указывается еще и кол-во энергии (теплоты реакции), относящееся к числу молей реагирующих веществ, соответствующему коэффициентам в уравнении реакции.
Теплота реакции (тепловой эффект) обозначается буквой Q (измеряется в кДж), и записывается в конце уравнения. Знак «плюс» перед числом обозначает выделившееся кол-во энергии, знак «минус» — кол-во поглощенной энергии.
Реакции, протекающие с выделением энергии, называются экзотермическими; с поглощением энергии — эндотермическими.
Если известна масса одного из двух реагирующих веществ, на основе термохимического уравнения можно определить кол-во теплоты реакции.
Пример 1 . Определить теплоту реакции горения 320 г серы.
- Согласно уравнения реакции, при сгорании 1 моля серы выделяется 297 кДж энергии, нам надо узнать, сколько энергии выделится при сгорании 320 г серы.
- Для решения задачи необходимо составить и решить простую пропорцию:
- Переходим от молей к граммам:
- В пропорции заменяем моли на граммы:
Если известно кол-во выделенной (поглощенной) теплоты в ходе реакции, можно определить массы прореагировавших веществ.
Пример 2 . Определить кол-во сгоревшего угля, если в ходе горения было выделено 33520 кДж энергии.
- Согласно уравнения реакции, при сгорании 1 моль углерода (масса 1 моль С = 12 г) выделилсь 402,24 кДж энергии.
- Составляем и решаем пропорцию:
Пример 3 . При горении 1 л метана (н.у) выделяется 39 кДж энергии. Составить термохимическое уравнение реакции и вычислить тепловой эффект.
Пример 4 . При горении 2,4 г магния (н.у) выделяется 60,12 кДж энергии. Составить термохимическое уравнение реакции.
Пример 5 . Два моля аммиака образуются в результате взаимодействия 1 моля азота с тремя молями водорода. Необходимо составить уравнение термохимической реакции, в ходе которой выделяется 92 кДж тепла, а все вещества, участвующие в реакции, являются газами.
Это очень простая задача, решение которой указано в условии.
Второй вариант записи термохимического уравнения.
Пример 6 . Составить термохимическое уравнение эндотермической реакции образования двухвалентного оксида азота из азота и кислорода с поглощением 180 кДж энергии. Записать это уравнение для образования 1 моля NO.
Первая часть задания не вызывает трудностей:
В этом термохимическом уравнении 2 моля оксида азота образуется при взаимодействии 1 моля азота и 1 моля кислорода. Для того, чтобы переписать данное уравнение для 1 моля оксида азота, необходимо все коэффициенты и кол-во теплоты разделить на 2:
Пример 7 . При образовании 50 г карбоната кальция (CaCO3) выделилось 80 кДж энергии. Определить тепловой эффект реакции разложения одного моля карбоната кальция.
- Определяем кол-во энергии, выделяемое при образовании 1 моля CaCO3 (М(CaCO3)=100 г/моль):
- Термохимическое уравнение реакции образования 1 моль карбоната кальция имеет вид:
- Термохимическое уравнение реакции разложения 1 моль карбоната кальция имеет вид:
- Q=-160 кДж
Пример 8 . Рассчитать кол-во выделенной энергии при образовании 2 л аммиака при н.у.
- Согласно термохимического уравнения — 1 моль аммиака образовался из полумоля азота и полутора молей водорода. Составляем пропорцию:
Пример 9 . Рассчитать тепловой эффект реакции:
- На основании первого следствия из закона Гесса:
- Теплоты образования простых веществ равны нулю:
- Теплоты образования сложных веществ берем из таблицы:
- Подставляем числовые значения в уравнение:
- Термохимическое уравнение реакции будет иметь вид:
Пример 10 . Рассчитать тепловой эффект реакции:
- Тепловой эффект реакции будем рассчитывать по формуле, вытекающей из второго следствия закона Гесса:
- Тепловые эффекты сгорания C2H4 и C2H6 можно взять из приведенных выше термохимический уравнений.
- Тепловой эффект сгорания водорода можно вычислить из термохимического уравнения образования 1 моля воды (теплоту образования воды берем из таблицы):
- Подставляем численные значения в формулу:
- Термохимическое уравнение реакции будет иметь вид:
Пример 11 . Определить скорость изменения реакции синтеза аммиака при а) увеличении концентрации исходных веществ в 2 раза; б) уменьшении давления в реакционной смеси в 2 раза:
- Записываем кинетическое уравнение данной реакции:
- Если концентрации исходных веществ будут увеличены в 2 раза, кинетическое уравнение примет вид:
- Составляем отношение и решаем его:
- Увеличение концентрации исходных веществ в 2 раза приведет к ускорению скорости реакции в 16 раз.
- Исходя из того факта, что концентрации газов пропорциональны давлению (при уменьшении давления в 2 раза концентрации также уменьшатся в 2 раза), логично предположить, что при снижении в 2 раза давления скорость протекания реакции снизится в 16 раз. Убедимся в этом, составив соотношение кинетических уравнений.
- Исхдное кинетическое уравнение:
- Для удобства чтения формул сделаем подстановку:
- Кинетическое уравнение при снижении давления в 2 раза:
- Соотошение:
- При уменьшении давления в реакционной смеси в 2 раза скорость протекания реакции уменьшится в 16 раз.
Пример 12 . Определить скорость изменения реакции с температурным коэффициентом 4 (γ=4) при повышении температуры с 10°C до 30°C.
Для решения задачи воспользуемся правилом Вант-Гоффа, которое выражается следующей математической формулой:
Все, что нам нужно сделать — подставить численные значения в формулу и провести расчеты:
При повышении температуры с 10 до 30 градусов Цельсия скорость реакции увеличится в 16 раз.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
📽️ Видео
Задача на термохимические уравнения: разбор задания 27 | ХИМИЯ ЕГЭ 2022Скачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Решение задач по теме «Расчеты по термохимическим уравнениям». 9 и 11 класс.Скачать

Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 1 ч. 9 класс.Скачать

Термохимические уравнения. Решение задач из ЕГЭ на тепловой эффект.Скачать

Химия ЦТ | Задачи по термохимическим уравнениямСкачать

Тепловой эффект реакции. ЗадачиСкачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Тепловой эффект хим. реакции. Энтальпия. Закон Гесса. Капучинка ^-^Скачать

78. Тепловой эффект реакции. Термохимические уравнения (часть 1)Скачать

Решение задач по термохимическим уравнениям/задание 28(2)/егэ химияСкачать

Задачи: термохимические уравнения и расчеты по нимСкачать

Решение задач по термохимическим уравнениям реакций, 8 классСкачать
Как решать задачи по химии? Расчет по уравнениям химических реакций | TutorOnlineСкачать

79. Тепловой эффект реакции. Термохимические уравнения (часть 2)Скачать