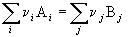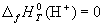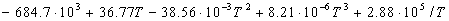Тепловой эффект E процесса – это сумма количества теплоты, которую отдала система Q ‘ в этом процессе, и теплового эквивалента работы A
, элемент которой равняется:
= δ A — p d V ( 1 ) , где δ A считается элементарной полной работой системы, p d V – работой расширения.
Тогда получим, что:
Разрешается записать в виде E = — Q с Q , обозначающей количество теплоты, подведенное к системе. Согласно первому началу термодинамики:
E = — ∆ U — ∫ 1 2 p d V ( 3 ) , где ∆ U = U 2 — U 1 является изменением внутренней энергии системы, p – давлением, V – объемом.
Тепловой эффект применяется в термохимии. Тепловым эффектом химической реакции считается количество тепла, выделяемое в ходе данной реакции. При выделении теплоты реакция получила название экзотермической, при поглощении – эндотермической. Считается, что уравнение экзотермической реакции характеризуется E > 0 , а эндотермической –
Допустим, имеется химическая реакция, протекающая при V = c o n s t . Это говорит о тепловом эффекте реакции E V , который необходимо рассчитывать по формуле:
E V = U 1 — U 2 ( 4 ) .
Если прохождение этой реакции обусловлено наличием постоянного давления, то выражение ( 3 ) с использованием тепловой функции запишется:
H = U + p V ( 5 ) , E = H 1 — H 2 + ∫ 1 2 V d p ( 6 ) , то случай говорит о наличии теплового эффекта реакции с p = c o n s t :
E p = H 1 — H 2 ( 7 ) .
По уравнениям ( 4 ) , ( 5 ) видно прохождение теплового эффекта при изохорном и изобарном процессах в не зависимости от ее хода реакции (промежуточных стадий). Он определяется начальным и конечным состоянием системы. Данная формулировка получила название закона Гесса – первого закона термохимии. При твердых или жидких начальных и конечных продуктах реакции значения E p и E V практически аналогичны. Это происходит по причине неизменности системы. Реакции, имеющие газообразные составляющие, в виду существенной переменности объема тепловые эффекты E p и E V значительно отличаются, а тепловой эффект рассматривается при постоянном давлении. Наличие заданной температуры теплового эффекта E p почти не зависит от внешнего давления, которое является постоянным для данного процесса. Тепловой эффект, который определяется при t = 25 ° C и p = 760 м м р т . с т . называют стандартным.
Из закона Гесса вытекают следствия, упрощающие расчет химических реакций, в системах с p = c o n s t или V = c o n s t :
- Тепловой эффект реакции разложения химического соединения численно равен и противоположен по знаку тепловому эффекту реакции синтеза этого соединения из продуктов разложения.
- Разность тепловых эффектов двух реакций, приводящих из разных состояний к одинаковым конечным состояниям, равняется тепловому эффекту реакции перехода из одного начального состояния в другое.
- Разность тепловых эффектов двух реакций, приводящих из одного исходного состояния к разным конечным состояниям, равна тепловому эффекту реакции перехода из одного конечного состояния в другое.
Закон Гесса позволяет использовать термохимические уравнения в качестве алгебраических. Зависимость количества теплоты, которая выделяется в реакции E от теплового эффекта реакции E o , и количества вещества n b одного из участников реакции( вещества b в качестве исходного вещества или продукта реакции), выражается при помощи уравнения:
E = n b v b E 0 ( 8 ) , где v b — является количеством вещества b , задаваемое коэффициентом перед формулой вещества b в химическом уравнении.
Видео:Урок 4. Расчет цепей постоянного тока. Законы КирхгофаСкачать

Уравнение Кирхгофа
Большинство термохимических данных в справочниках приведено при температуре 298 К . Чтобы рассчитать тепловые эффекты, обладающие другими температурами, применяют уравнения Кирхгофа. Они записываются для изохорного E V и изобарного E p тепловых эффектов. Дифференциальная форма приобретает вид:
∂ E V ∂ T V = ∂ U 1 ∂ T V — ∂ U 2 ∂ T V = C V 1 — C V 2 = — ∆ C v ( 9 ) , ∂ E p ∂ T p = ∂ H 1 ∂ T p — ∂ H 2 ∂ T p = C p 1 — C p 2 = — ∆ C p ( 10 ) .
В ( 10 ) , ( 9 ) имеется C V , C p , являющиеся теплоемкостями веществ при соответствующих процессах.
Уравнение Кирхгофа для энтальпии изображается в интегральной форме вида:
H T 2 = H T 1 + ∫ T 1 T 2 ∆ C p T d T ( 11 ) , где ∆ C p = ∑ i v j C p B j — ∑ v i C p A i i считается разностью изобарных теплоемкостей продуктов реакции и исходных веществ. Зачастую выражение ( 11 ) применяют в химии.
Видео:Решение задачи. Расчет электрической цепи по законам КирхгофаСкачать

Примеры задач на вычислыние теплового эффекта
Записать выражение для расчета изменения стандартной энтальпии реакции.
Для решения задания необходимо взять за основу закон Гесса.
Именно он способствует оперированию термохимическими уравнениями как алгебраическими. Получаем, что запись принимает вид:
∆ H = ∑ j v j H B j — ∑ i v i H A i ( 1 . 1 ) , с B j , являющейся продуктами реакции, A i – исходными веществами. В задании требуют записать формулу для расчета стандартной энтальпии. Отметим, что все энтальпии, записанные уравнениями ( 1 . 1 ) , выбираются при температуре T = 298 К . Реже это фиксируется в самой формуле.
Даны химические уравнения. Произвести вычисление теплового эффекта реакции E образования 1 моль F e 2 O 3 при стандартных условиях из F e и O 2 .
1 . 2 F e + O 2 = 2 F e O , H 298 К , 1 = — 529 , 6 к Д ж ; 2 . 4 F e O + O 2 = 2 F e 2 O 3 , H ( 298 К , 2 ) = — 585 , 2 к Д ж .
По условию видно, что следует рассчитать тепловой эффект образования 1 моль оксида железа F e 2 O 3 реакции вида:
3 . 2 F e + 1 , 5 O 2 = F e 2 O 3 ( 2 . 1 ) .
Из двух данных реакций, следует сформировать реакцию ( 2 . 1 ) . Далее нужно разделить коэффициенты в ( 2 ) на 2 и произвести сложение с ( 1 ) . Отсюда:
2 F e + O 2 + 2 F e O + 0 , 5 O 2 = 2 F e O + F e 2 O 3 ( 2 . 2 ) .
Проведем преобразование (сокращение):
2 F e + 1 , 5 O 2 = F e 2 O 3 .
Было получено уравнение ( 2 . 1 ) :
Выше перечисленная последовательность действий с уравнениями привела к необходимому ( 2 . 1 ) . При проведении аналогичной схемы действий с тепловыми эффектами, будет результат эффекта реакции ( 2 . 1 ) . Протекание всех процессов обусловлено стандартными условиями, то есть при T = 298 К . Следовательно формула примет вид:
E 3 = H ( 1 ) + 0 , 5 H ( 2 ) ( 2 . 3 ) , где находящиеся в скобках цифры обозначают номер химической реакции. Рассчитаем и получим:
E 3 = — 529 , 6 + 0 , 5 · — 585 , 2 = — 822 , 2 ( к Д ж ) .
Ответ: тепловой эффект реакции равняется — 822 , 2 к Д ж .
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Тепловой эффект. Уравнение Кирхгофа
Вы будете перенаправлены на Автор24
Видео:Урок 265. Задачи на правила КирхгофаСкачать

Что такое тепловой эффект
Тепловым эффектом E процесса называют сумму количества теплоты, которое отдала система ($Q’$) в этом процессе и теплового эквивалента работы ($tilde$), элемент которой равен:
[widetilde=delta A-pdV left(1right),]
где $delta A$- элементарная полная работа системы, $pdV$ — работа расширения.
Можно записать, что $E=-Q$, где $Q$ — количество теплоты, подведенное к системе, тогда в соответствии с первым началом термодинамики, получим:
где $triangle U=U_2-U_1$ — изменение внутренней энергии системы, $p$ — давление, $V$ — объем.
Понятие теплового эффекта часто применяется в термохимии. Тепловым эффектом химической реакции является количество тепла, которое выделяется в ходе этой реакции. Если тепло выделяется, то реакция называется экзотермической, если поглощается — эндотермической. Принято считать, что в экзотермической реакции $E>0$, в эндотермической — $E
Предположим, что химическая реакция протекает при $V=const$. В таком случае тепловой эффект реакции $E_V$ рассчитывается как:
В том случае, если реакция проходит при постоянном давлении, то выражение для теплового эффекта (3) удобнее записать, используя тепловую функцию (энтальпию — H):
В таком случае тепловой эффект реакции при $p=const$ равен:
Уравнения (4) и (5) показывают нам, что тепловой эффект реакции при изохорном и изобарном процессах не зависит от хода (промежуточных стадий) реакции, а определяется начальным и конечным состояниями системы. Это формулировка закона Гесса — первый закон термохимии. Если начальные и конечные продукты реакции — твердые или жидкие, то $E_p$ и $E_V$ почти не отличаются друг от друга. Это происходит из-за неизменности объема системы. В реакциях с газообразными составляющими в виду существенной переменности объема тепловые эффекты $E_p$ и $E_V$ существенно отличаются, чаще всего рассматривают тепловой эффект при постоянном давлении. При заданной температуре тепловой эффект реакции $E_p$ практически (а в идеальном газе совсем) не зависит от внешнего давления (которое поддерживают постоянным). Тепловой эффект определённый при t=250C и p=760 мм рт.ст. считается стандартным.
Из закона Гесса вытекают следствия, которые упрощают расчет химических реакций, в системе при $p=const$ или $V=const$:
- тепловой эффект реакции разложения химического соединения численно равен и противоположен по знаку тепловому эффекту реакции синтеза этого соединения из продуктов разложения;
- разность тепловых эффектов двух реакций, приводящих из разных состояний к одинаковым конечным состояниям, равна тепловому эффекту реакции перехода из одного начального состояния в другое;
- разность тепловых эффектов двух реакций, приводящих из одного исходного состояния к разным конечным состояниям, равна тепловому эффекту реакции перехода из одного конечного состояния в другое.
Закон Гесса позволяет оперировать термохимическими уравнениями, как алгебраическими. Зависимость количества теплоты, выделяющейся в реакции (E) от теплового эффекта реакции (Eo) и количества вещества (nb) одного из участников реакции (вещества b — исходного вещества или продукта реакции), выражается уравнением:
Здесь $ _b$— количество вещества b, задаваемое коэффициентом перед формулой вещества b в термохимическом уравнении.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

Уравнение Кирхгофа
Большинство термохимических данных в справочниках приведено при температуре 298К. Для расчета тепловых эффектов при других температурах используют уравнения Кирхгофа. Уравнения Кирхгофа записываются для изохорного $(E_V)$ и изобарного $_p)$ тепловых эффектов. В дифференциальной форме они имеют вид:
В уравнениях (10) и (9) $C_V$, $C_p$- теплоемкости вещества при соответствующих процессах (изобарном и изохорном).
В интегральной форме уравнение Кирхгофа для энтальпии имеет вид:
где $triangle C_p=sumlimits_j<_jC_p(B_j>)-sumlimits_i<_iC_p(A_i>)$ — разность изобарных теплоемкостей продуктов реакции и исходных веществ. Уравнением (11) в химии пользуются чаще всего.
Задание: Напишите выражение для расчета изменения стандартной энтальпии реакции.
Основой для решения поставленной задачи является закон Гесса.
Закон Гесса позволяет оперировать термохимическими уравнениями, как алгебраическими. Поэтому мы можем записать:
[triangle H=sumlimits_j<_j>Hleft(B_jright)-sumlimits_i<_i>Hleft(A_iright) left(1.1right),]
где $B_j$ — продукты реакции, $A_i$- исходные вещества. Так как в задаче требуется записать формулу для расчета стандартной энтальпии. Необходимо отметить, что все энтальпии, которые записаны в уравнении (1.1), берутся при температуре T=298 K. Иногда это пишут непосредственно в формуле.
Задание: По приведенным ниже химическим уравнениям вычислите тепловой эффект реакции (E) образования 1 моль $_2O_$при стандартных условиях из $Fe$ и $O_2$.
- $2Fe+O_2=2FeO, Hleft(298K, 1right)=-529,6 кДж$
- $4FeO+O_2=2_2O_3, Hleft(298K, 2right)=-585,2 кДж$
Таким образом, необходимо рассчитать тепловой эффект образования 1 моль оксида железа ($_2O_3$) в реакции:
Получается, что из двух реакций, приведенных в условиях задачи, необходимо сформировать реакцию (2.1). Для этого разделим коэффициенты в реакции (2) на 2 и сложим с химическим уравнением (1), таким образом, получим:
Проведем сокращения, получим уравнение реакции:
Мы получили уравнение (2.1)
Так как приведенная выше последовательность манипуляций с химическими уравнениями 1 и 2 из условий задачи привела нас к требуемому уравнению (2.1), то проведя аналогичную схему действий с тепловыми эффектами, мы получим тепловой эффект реакции (2.1). Мы помним, что все процессы протекают в стандартных условиях, то есть при T=298K. Таким образом, получаем:
где цифры в скобках обозначают номер химической реакции. Проведем расчет:
[Eleft(3right)=-529,6+0,5cdot left(-585,2right)=-822,2 left(кДжright).]
Ответ: Тепловой эффект реакции -822, 2 кДж.
Получи деньги за свои студенческие работы
Курсовые, рефераты или другие работы
Автор этой статьи Дата последнего обновления статьи: 26 11 2021
Видео:решение задачи составлением уравнений по правилам киргофа. Законы киргофа кратко на практикеСкачать

Решение задач по химии по уравнению кирхгофа
Термохимия изучает тепловые эффекты химических реакций. Во многих случаях эти реакции протекают при постоянном объеме или постоянном давлении. Из первого закона термодинамики следует, что при этих условиях теплота является функцией состояния. При постоянном объеме теплота равна изменению внутренней энергии:
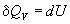
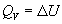
а при постоянном давлении — изменению энтальпии:
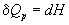
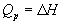
Эти равенства в применении к химическим реакциям составляют суть закона Гесса:
Тепловой эффект химической реакции, протекающей при постоянном давлении или постоянном объеме, не зависит от пути реакции, а определяется только состоянием реагентов и продуктов реакции.
Другими словами, тепловой эффект химической реакции равен изменению функции состояния.
В термохимии, в отличие от других приложений термодинамики, теплота считается положительной, если она выделяется в окружающую среду, т.е. если H . RT, (3.4)
где n — изменение числа молей газов в реакции.
Для того, чтобы облегчить сравнение энтальпий различных реакций, используют понятие «стандартного состояния». Стандартное состояние — это состояние чистого вещества при давлении 1 бар (= 10 5 Па) и заданной температуре. Для газов — это гипотетическое состояние при давлении 1 бар, обладающее свойствами бесконечно разреженного газа. Энтальпию реакции между веществами, находящимися в стандартных состояниях при температуре T, обозначают 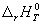
Из закона Гесса вытекают важные следствия, которые позволяют рассчитывать энтальпии химических реакций.
Следствие 1. Стандартная энтальпия химической реакции
равна разности стандартных энтальпий образования продуктов реакции и реагентов (с учетом стехиометрических коэффициентов):
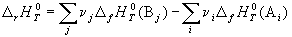
Стандартной энтальпией (теплотой) образования вещества 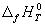
Понятия «энтальпия образования» используют не только для обычных веществ, но и для ионов в растворе. При этом за точку отсчета принят ион H + , для которого стандартная энтальпия образования в водном растворе полагается равной нулю:
Следствие 2. Стандартная энтальпия химической реакции
равна разности энтальпий сгорания реагентов и продуктов реакции (с учетом стехиометрических коэффициентов):
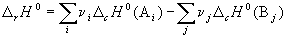
(c означает «combustion»). Стандартной энтальпией (теплотой) сгорания вещества называют энтальпию реакции полного окисления одного моля вещества. Это следствие обычно используют для расчета тепловых эффектов органических реакций.
Следствие 3. Энтальпия химической реакции равна разности энергий разрываемых и образующихся химических связей.
Энергией связи A- B называют энергию, необходимую для разрыва связи и разведения образующихся частиц на бесконечное расстояние:
AB(г) A(г) + B(г).
Энергия связи всегда положительна.
Большинство термохимических данных в справочниках приведено при температуре 298 К. Для расчета тепловых эффектов при других температурах используют уравнение Кирхгофа:
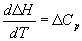
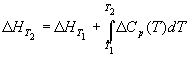
где Cp — разность изобарных теплоемкостей продуктов реакции и исходных веществ. Если разница T2 — T1 невелика, то можно принять Cp = const. При большой разнице температур необходимо использовать температурную зависимость Cp(T) типа:
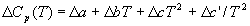
где коэффициенты a, b, c и т.д. для отдельных веществ берут из справочника, а знак обозначает разность между продуктами и реагентами (с учетом коэффициентов).
ПРИМЕРЫ
Пример 3-1. Стандартные энтальпии образования жидкой и газообразной воды при 298 К равны -285.8 и -241.8 кДж/моль, соответственно. Рассчитайте энтальпию испарения воды при этой температуре.
Решение. Энтальпии образования соответствуют следующим реакциям:
H2(г) + ЅO2(г) = H2O(ж), H1 0 = -285.8;
H2(г) + ЅO2(г) = H2O(г), H2 0 = -241.8.
Вторую реакцию можно провести в две стадии: сначала сжечь водород с образованием жидкой воды по первой реакции, а затем испарить воду:
H2O(ж) = H2O(г), H 0 исп = ?
Тогда, согласно закону Гесса,
H1 0 + H 0 исп = H2 0 ,
откуда H 0 исп = -241.8 — (-285.8) = 44.0 кДж/моль.
Ответ. 44.0 кДж/моль.
Пример 3-2. Рассчитайте энтальпию реакции
а) по энтальпиям образования; б) по энергиям связи, в предположении, что двойные связи в молекуле C6H6 фиксированы.
Решение. а) Энтальпии образования (в кДж/моль) находим в справочнике (например, P.W.Atkins, Physical Chemistry, 5th edition, pp. C9-C15): fH 0 (C6H6(г)) = 82.93, fH 0 (C(г)) = 716.68, fH 0 (H(г)) = 217.97. Энтальпия реакции равна:
rH 0 = 82.93 — 6 716.68 — 6 217.97 = -5525 кДж/моль.
б) В данной реакции химические связи не разрываются, а только образуются. В приближении фиксированных двойных связей молекула C6H6 содержит 6 связей C- H, 3 связи C- C и 3 связи C=C. Энергии связей (в кДж/моль) (P.W.Atkins, Physical Chemistry, 5th edition, p. C7): E(C- H) = 412, E(C- C) = 348, E(C=C) = 612. Энтальпия реакции равна:
rH 0 = -(6 412 + 3 348 + 3 612) = -5352 кДж/моль.
Разница с точным результатом -5525 кДж/моль обусловлена тем, что в молекуле бензола нет одинарных связей C- C и двойных связей C=C, а есть 6 ароматических связей C C.
Ответ. а) -5525 кДж/моль; б) -5352 кДж/моль.
Пример 3-3. Пользуясь справочными данными, рассчитайте энтальпию реакции
Решение. Сокращенное ионное уравнение реакции имеет вид:
По закону Гесса, энтальпия реакции равна:
rH 0 = 4 fH 0 (H2O(ж)) + 2 fH 0 (NO(г)) + 3 fH 0 (Cu 2+ (aq)) — 2 fH 0 (NO3 — (aq))
(энтальпии образования меди и иона H + равны, по определению, 0). Подставляя значения энтальпий образования (P.W.Atkins, Physical Chemistry, 5th edition, pp. C9-C15), находим:
rH 0 = 4 (-285.8) + 2 90.25 + 3 64.77 — 2 (-205.0) = -358.4 кДж
(в расчете на три моля меди).
Пример 3-4. Рассчитайте энтальпию сгорания метана при 1000 К, если даны энтальпии образования при 298 К: fH 0 (CH4) = -17.9 ккал/моль, fH 0 (CO2) = -94.1 ккал/моль, fH 0 (H2O(г)) = -57.8 ккал/моль. Теплоемкости газов (в кал/(моль . К)) в интервале от 298 до 1000 К равны:
Решение. Энтальпия реакции сгорания метана
при 298 К равна:
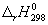
Найдем разность теплоемкостей как функцию температуры:
Cp = Cp(CO2) + 2 Cp(H2O(г)) — Cp(CH4) — 2 Cp(O2) =
= 5.16 — 0.0094T (кал/(моль . К)).
Энтальпию реакции при 1000 К рассчитаем по уравнению Кирхгофа:
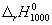
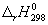
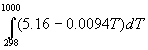
(1000-298) — 0.0094 (1000 2 -298 2 )/2 = -192500 кал/моль.
Ответ. -192.5 ккал/моль.
ЗАДАЧИ
3-1. Сколько тепла потребуется на перевод 500 г Al (т.пл. 658 о С, H 0 пл = 92.4 кал/г), взятого при комнатной температуре, в расплавленное состояние, если Cp(Alтв) = 0.183 + 1.096 10 -4 T кал/(г К)?
3-2. Стандартная энтальпия реакции CaCO3(тв) = CaO(тв) + CO2(г), протекающей в открытом сосуде при температуре 1000 К, равна 169 кДж/моль. Чему равна теплота этой реакции, протекающей при той же температуре, но в закрытом сосуде?
3-3. Рассчитайте стандартную внутреннюю энергию образования жидкого бензола при 298 К, если стандартная энтальпия его образования равна 49.0 кДж/моль.
3-4. Рассчитайте энтальпию образования N2O5(г) при T = 298 К на основании следующих данных:
2NO(г) + O2(г) = 2NO2(г), H1 0 = -114.2 кДж/моль,
4NO2(г) + O2(г) = 2N2O5(г), H2 0 = -110.2 кДж/моль,
N2(г) + O2(г) = 2NO(г), H3 0 = 182.6 кДж/моль.
3-5. Энтальпии сгорания -глюкозы, -фруктозы и сахарозы при 25 о С равны -2802,
-2810 и -5644 кДж/моль, соответственно. Рассчитайте теплоту гидролиза сахарозы.
3-6. Определите энтальпию образования диборана B2H6(г) при T = 298 К из следующих данных:
B2H6(г) + 3O2(г) = B2O3(тв) + 3H2O(г), H1 0 = -2035.6 кДж/моль,
2B(тв) + 3/2 O2(г) = B2O3(тв), H2 0 = -1273.5 кДж/моль,
H2(г) + 1/2 O2(г) = H2O(г), H3 0 = -241.8 кДж/моль.
3-7. Рассчитайте теплоту образования сульфата цинка из простых веществ при T = 298 К на основании следующих данных:
ZnS = Zn + S, H1 0 = 200.5 кДж/моль,
2ZnS + 3O2 = 2ZnO + 2SO2, H2 0 = -893.5 кДж,
2SO2 + O2 = 2SO3, H3 0 = -198.2 кДж/моль,
ZnSO4 = ZnO + SO3, H4 0 = 235.0 кДж/моль.
3-8. Найдите rH 0 298 для реакции
если известны теплоты сгорания метана ( cH 0 (CH4) = -890.6 кДж/моль), хлорметана ( cH 0 (CH3Cl) = -689.8 кДж/моль), водорода ( cH 0 (H2) = -285.8 кДж/моль) и теплота образования HCl ( fH 0 (HCl) = -92.3 кДж/моль)).
3-9. Рассчитайте тепловой эффект реакции
при T = 298 K, если известны следующие данные:
H2O(г) = H2O(ж), H1 0 = -44 кДж/моль,
1/2N2 + 3/2H2 = NH3, H2 0 = -46.2 кДж/моль,
H2 + 1/2O2 = H2O(ж), H3 0 = -285.8 кДж/моль,
NO = 1/2N2 + 1/2O2, H4 0 = -91.3 кДж/моль.
3-10. При взаимодействии 10 г металлического натрия с водой rH298 = -79.91 кДж, а при взаимодействии 20 г оксида натрия с водой rH298 = -76.76 кДж. Вода берется в большом избытке. Рассчитайте теплоту образования оксида натрия fH 0 298(Na2O), если fH 0 298(H2Oж) = -285.8 кДж/моль.
3-11. Энергия связи в молекуле H2 равна 432.1 кДж/моль, а энергия связи в молекуле N2 равна 945.3 кДж/моль. Какова энтальпия атомизации аммиака, если энтальпия образования аммиака равна -46.2 кДж/моль?
3-12. Рассчитайте стандартный тепловой эффект реакции нейтрализации
NaOH + HCl = NaCl + H2O,
протекающей в водном растворе при 298 К.
3-13. Рассчитайте стандартный тепловой эффект реакции
3-14. Напишите уравнение Кирхгофа для реакции, протекающей при постоянном объеме.
3-15. Зависимость теплового эффекта реакции CH3OH(г) + 3/2O2 = CO2 + 2H2O(г) от температуры выражается уравнением:
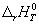
Рассчитайте изменение теплоемкости Cp для этой реакции при 500 К.
3-16. Стандартная энтальпия образования Al2O3(тв) при 298 К равна -1675 кДж/моль. Рассчитайте стандартную энтальпию образования Al2O3(тв) при 800 К, если даны мольные теплоемкости (в Дж/(моль . К)):
3-17. Энтальпия диссоциации карбоната кальция при 900 о С и давлении 1 атм равна 178 кДж/моль. Выведите уравнение зависимости энтальпии реакции от температуры и рассчитайте количество теплоты, поглощенное при разложении 1 кг карбоната кальция при 1000 о С и 1 атм, если даны мольные теплоемкости (в Дж/(моль . К)):


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
📹 Видео
Как решать задачи по химии? Расчет по уравнениям химических реакций | TutorOnlineСкачать

Применение законов Кирхгофа при решении задачСкачать

8 класс. Количество вещества.Решение задач.Скачать

Решение задач на термохимические уравнения. 8 класс.Скачать

8 класс.Ч.1.Решение задач по уравнению реакций.Скачать

Лекция 117. Правила КирхгофаСкачать

Расчет выхода продукта от теоретически возможного. 10 класс.Скачать

Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Законы Кирхгофа - самое простое и понятное объяснение этих законовСкачать

Как решать ЗАДАЧИ ПО ХИМИИ | Типовые задачи по химии | Задачи с уравнением химической реакцииСкачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Химия 9 класс — Как определять Степень Окисления?Скачать

Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 1 ч. 9 класс.Скачать

Тепловой эффект хим. реакции. Энтальпия. Закон Гесса. Капучинка ^-^Скачать