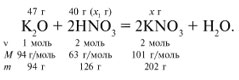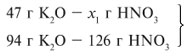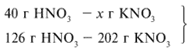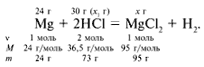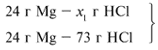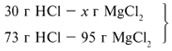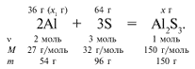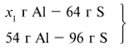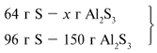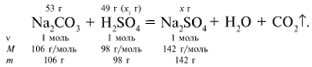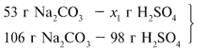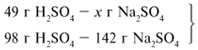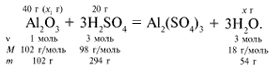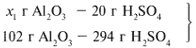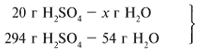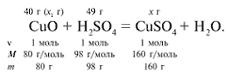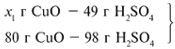на «избыток–недостаток»
в курсе основной
общеобразовательной школы
Умение решать химические задачи – важная составляющая знаний по предмету. Согласно государственному стандарту образования по химии учащиеся, оканчивающие школу, должны уметь решать более десятка типов стандартных задач. Среди них и задачи на «избыток–недостаток».
Предлагаю свой вариант подачи материала по решению таких задач в курсе химии 9-го класса.
На изучение этой темы отвожу 2–2,5 урока, в зависимости от уровня способностей учеников класса. Ознакомление с алгоритмом решения задач данного типа происходит в рамках изучения темы «Теория электролитической диссоциации». Однако если класс сильный, то в рамках эксперимента этот тип задач иногда изучаем и в конце 8-го класса в главе «Галогены», а высвободившееся время можно потратить на изучение органической химии в курсе 9-го класса.
На первом уроке разбираю два типа задач на «избыток–недостаток»:


В качестве домашнего задания обязательно предлагаются две-три задачи, подобные изученным на уроке.
На втором уроке закрепляю и углубляю изученный материал, ввожу понятия «процентная концентрация растворов веществ», вступивших в реакцию, «плотность растворов». Кроме того, усложняю задачи, вводя «процентное содержание примесей в исходном веществе» и т. д. Такой прием позволяет повторить элементы уже изученного материала, сэкономить время. В конце второго урока изучения темы или в начале третьего провожу небольшую самостоятельную работу на закрепление изученного материала, включающую одну-две задачи, причем самостоятельная работа предлагается в трех уровнях сложности, в зависимости от способностей ученика.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Урок 1
Видео:Задачи на ИЗБЫТОК и НЕДОСТАТОК | Самое простое объяснениеСкачать

Решение задач на «избыток–недостаток»
Цели.
- научить алгоритму решения задач нового типа;
- закрепить навыки устного счета;
- повторить правила расчета относительных молекулярных масс веществ;
- закрепить правила грамотного оформления условия задачи;
- формировать навыки химического мышления, логики, а также способствовать воспитанию гармоничной, всесторонне развитой личности.
ХОД УРОКА

Решая химические задачи, следует не забывать о правилах их грамотного оформления по схеме: дано, найти, решение, ответ.
ЗАДАЧА 1. На 47 г оксида калия подействовали раствором, содержащим 40 г азотной кислоты. Найдите массу образовавшегося нитрата калия.
Решение
Рассчитаем относительные молекулярные массы интересующих нас веществ:
Для удобства расчета за х1 примем массу НNО3 и найдем, какое из веществ, вступивших в реакцию, дано в избытке, какое – в недостатке.
Следовательно, азотная кислота дана в недостатке, т. к. по условию ее 40 г, а по расчету необходимо 63 г, поэтому расчет ведем по HNO3:
ЗАДАЧА 2. На 24 г металлического магния подействовали 100 г 30%-го раствора соляной кислоты. Найдите массу образовавшегося хлорида магния.
m(Mg) = 24 г,
m(р-р HCl) = 100 г, 
Решение
Рассчитаем относительные молекулярные массы интересующих нас веществ:
Для удобства расчета за х1 примем массу соляной кислоты и найдем, какое из веществ, вступивших в реакцию, дано в избытке, какое – в недостатке.
Из расчета видно, что соляная кислота дана в недостатке, т. к. по условию задачи ее дано 30 г, а для реакции требуется 73 г. Следовательно, расчет ведем по соляной кислоте:

ЗАДАЧА 1. На 36 г алюминия подействовали 64 г серы. Найдите массу образовавшегося сульфида алюминия.
Решение
Примем массу Al за х1 и найдем, какое из веществ, вступивших в реакцию, дано в избытке, какое – в недостатке.
В данном случае вещества, вступившие в реакцию, взяты в стехиометрических количествах, поэтому расчет можно вести по любому из них:
ЗАДАЧА 2. На раствор, содержащий 53 г карбоната натрия, подействовали раствором, содержащим 49 г серной кислоты. Найдите массу образовавшейся соли.
Решение
Рассчитаем относительные молекулярные массы интересующих нас веществ:
Примем за х1 массу cерной кислоты, чтобы узнать, какое вещество дано в избытке, какое – в недостатке.
В данном случае оба вещества взяты в стехиометрических количествах, поэтому расчет можно вести по любому из них:
Однако учитель, подбирая задачи для решения в классе, должен помнить, что в некоторых случаях (например, если кислота или кислотный оксид дан в избытке) решение задачи не ограничивается расчетом двух пропорций, т. к. реакция будет протекать дальше с образованием кислой соли. Это повысит сложность материала. На первых уроках при решении задач данного типа я не включаю в материал задачи на прохождение реакций с образованием кислых или основных солей.
Видео:Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 1 ч. 9 класс.Скачать

Домашнее задание
ЗАДАЧА 1. На 200 г 10%-го раствора серной кислоты подействовали 40 г оксида алюминия. Найдите массу образовавшейся воды.
M(р-р H2SO4) = 200 г, 
m(Al2O3) = 40 г.
Решение
Рассчитаем относительные молекулярные массы интересующих нас веществ:
Найдем, какое из вступивших в реакцию веществ дано в избытке, а какое – в недостатке.
Из расчета видно, что Al2O3 дан в избытке, следовательно, расчет ведем по кислоте:
ЗАДАЧА 2. На 40 г оксида меди(II) подействовали раствором серной кислоты, содержащим 49 г безводного вещества. Найдите массу образовавшейся соли.
Решение
Найдем, какое из веществ, вступивших в реакцию, дано в избытке, а какое – в недостатке.
Cогласно уравнению данной реакции вещества взяты в стехиометрических количествах, поэтому расчет можно вести по любому из них:
Видео:Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 2 ч. 9 класс.Скачать

Химия, Биология, подготовка к ГИА и ЕГЭ
Задачи такого типа (точнее, это может быть даже не самой задачей, а частью задачи) есть в части С ГИА, они входят в часть С ЕГЭ, теперь они появились и в части B.
Классический пример задачи на избыток и недостаток.
Этапы решения задачи:
1. Записываем уравнение реакции и уравниваем его:
2. Находим количество моль тех веществ, массы которых нам даны в условии:
n(Cu) = mAr =3.2 г 63.5 гмоль = 0,05 моль
m(Hg(NO3)2) = mMr = 20 324 = 0,06 моль
3. Сравниваем количество моль веществ и определяем недостаток:
0,05 моль 0,06 моль
по уравнению реакции меди и нитрат ртути реагируют 1:1, значит, их количество моль тоже должно быть одинаковым
0,05 моль ПО НЕДОСТАТКУ
Почему по недостатку? Это аналогично вопросу — «сколько целых яблок можно сложить из 5 половинок? «
4. Вычисляем массу продукта по количеству моль, соответствующему недостатку:
0,05 моль ——> 0,05 моль
m(Hg)= n*Ar = 0,05 моль * 200 гмоль = 10 г
______________________________________________________________________________________
Пример задачи на избыток и недостаток,
где вещества в другом соотношении:
те же самые этапы решения:
1. Записываем уравнение реакции и уравниваем его:
2. Находим количество моль тех веществ, массы которых нам даны в условии:
n(N2 ) = mMr = 1428=0.5 моль
3. Сравниваем количество моль веществ и определяем недостаток:
0.5 моль 0.5 моль
в этом уравнении все не так очевидно, как в предыдущем, поэтому нужно просто прикинуть:
- если считать по азоту (0.5 моль), то по соотношению коэффициентов (2:5) кислорода должно быть в 2.5 раза больше, т.е. (0.5*2.5) 1,25 моль, а у нас только 0.5, значит, O2 в недостатке;
- если бы количество моль азота оказалось бы меньше, значит, считали бы по азоту
4. Вычисляем массу продукта по количеству моль, соответствующему недостатку:
m(N2O5) = n*Mr = 2* 0.55 моль * 108 гмоль = 21 г
______________________________________________________________________________________
Есть задачи, очень похожие на задачи избыток-недостаток,
1. Записываем уравнение реакции и уравниваем его:
здесь у нас возможно 2 варианта — образование средней и кислой соли:
2. Находим количество моль тех веществ, массы которых нам даны в условии:
n(CO2 ) = V22.4 лмоль = 24.9 22.4 = 1,11 моль
n(NaOH)= mMr = 44.440 = 1,11 моль
т.к. количество моль веществ одинаково, то делаем вывод, что реакция протекает по схеме образования кислой соли:
4. Вычисляем массу продукта по количеству моль:
m ( NaHCO3) = n*Mr = 1,11 * 84 = 93,24 г
_____________________________________________________________________________________ _
Задачи на избыток и недостаток не трудные, зачастую они являются частью более сложных задач, поэтому все, что нужно сделать, это натренироваться — порешать как можно больше таких примеров, внимательно уравнивая и работая с коэффициентами.
Видео:Задачи на "избыток" и "недостаток". 1 часть. 10 класс.Скачать

Материал. Задачи на избыток-недостаток
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Рабочие листы и материалы для учителей и воспитателей
Более 300 дидактических материалов для школьного и домашнего обучения
Решаем задачи на «ИЗБЫТОК-НЕДОСТАТОК»
Расчёты по уравнению реакции, если один из реагентов взят в избытке
Дано: m (ν, V , W ) реагентов Найти: m (ν, V , W ) продукта
1. Составляем уравнение реакции
a моль b моль c моль
2. Нахождение количества вещества реагентов ν(А) и ν(В):
ν = m / M ; ν = V / V m ;
W вещества = ( m вещества •100%)/ m раствора ; m вещества = ( W вещества • m раствора )/100%
3. Сравнение дробей – нахождение недостатка:
Если, ν(А)/ a > ν(В)/ b , то вещество В в недостатке, расчёт ν(С) ведём по ν(В)
Если, ν(А)/ a b , то вещество А в недостатке, расчёт ν(С) ведём по ν(А)
Если, ν(А)/ a = ν(В)/ b , то расчёт ν(С) ведём по ν(В) или ν(А)
4. Определение ν(С) по УХР путём составления и решения пропорции:
ν(В)/ b = ν(С)/с или ν(А)/ a = ν(С)/с
5. Нахождение величин, требуемых по условию:
m = ν• M ; V = ν• V m ; W вещества = ( m вещества •100%)/ m раствора
Решаем задачи на «ИЗБЫТОК-НЕДОСТАТОК»
Расчёты по уравнению реакции, если один из реагентов взят в избытке
Дано: m (ν, V , W ) реагентов Найти: m (ν, V , W ) продукта
1. Составляем уравнение реакции
a моль b моль c моль
2. Нахождение количества вещества реагентов ν(А) и ν(В):
ν = m / M ; ν = V / V m ;
W вещества = ( m вещества •100%)/ m раствора ; m вещества = ( W вещества • m раствора )/100%
3. Сравнение дробей – нахождение недостатка:
Если, ν(А)/ a > ν(В)/ b , то вещество В в недостатке, расчёт ν(С) ведём по ν(В)
Если, ν(А)/ a b , то вещество А в недостатке, расчёт ν(С) ведём по ν(А)
Если, ν(А)/ a = ν(В)/ b , то расчёт ν(С) ведём по ν(В) или ν(А)
4. Определение ν(С) по УХР путём составления и решения пропорции:
ν(В)/ b = ν(С)/с или ν(А)/ a = ν(С)/с
5. Нахождение величин, требуемых по условию:
m = ν• M ; V = ν• V m ; W вещества = ( m вещества •100%)/ m раствора
Решите задачи по теме: «Избыток – Недостаток»
1. На оксид магния количеством вещества 0,1 моль подействовали раствором, содержащим 15 г азотной кислоты. Вычислите массу полученной соли. (Ответ: m Mg ( NO 3 ) 2 )= 14,8 г)
2. Вычислите массу соли, образовавшейся в результате взаимодействия 7,3 г хлороводорода с 5,6 л аммиака (н. у.) (Ответ: m ( NH 4 Cl ) = 10,7 г)
3. Вычислите объём водорода, выделившегося при взаимодействии цинка массой 13 г с раствором, содержащим 30 г серной кислоты (н.у.). (Ответ: V ( H 2 ) = 4,48 л)
1. Какое количество вещества гидросульфата натрия образуется при смешивании 200 г 12% — го раствора серной кислоты со 100 г 8% — го раствора гидроксида натрия? (Ответ: 0,2 моль)
2. К раствору объёмом 153,5 мл с массовой долей гидроксида калия 16% и плотностью 1,14 г/мл прилили раствор объёмом 86,8 мл с массовой долей серной кислоты 20% и плотностью 1,14 г/мл. Определите массу образовавшейся соли. (Ответ: 34,8 г K 2 SO 4 )
1. Смешали 100 г раствора, содержащего нитрат серебра массой 10,2 г, с раствором массой 50 г, содержащим ортофосфат натрия массой 6, 56 г. Определите массовые доли солей в полученном растворе. (Ответ: 3,6% NaNO 3 ; 2,3% Na 3 PO 4 )
2. Водный раствор, содержащий гидроксид кальция массой 3,7 г, поглотил оксид углерода ( IV ) объёмом 1,68 л (н. у.). Определите массу осадка. (Ответ: m ( CaCO 3 ) = 2,5 г)
Решите задачи по теме: «Избыток – Недостаток»
1. На оксид магния количеством вещества 0,1 моль подействовали раствором, содержащим 15 г азотной кислоты. Вычислите массу полученной соли. (Ответ: m Mg ( NO 3 ) 2 )= 14,8 г)
2. Вычислите массу соли, образовавшейся в результате взаимодействия 7,3 г хлороводорода с 5,6 л аммиака (н. у.) (Ответ: m ( NH 4 Cl ) = 10,7 г)
3. Вычислите объём водорода, выделившегося при взаимодействии цинка массой 13 г с раствором, содержащим 30 г серной кислоты (н.у.). (Ответ: V ( H 2 ) = 4,48 л)
1. Какое количество вещества гидросульфата натрия образуется при смешивании 200 г 12% — го раствора серной кислоты со 100 г 8% — го раствора гидроксида натрия? (Ответ: 0,2 моль)
2. К раствору объёмом 153,5 мл с массовой долей гидроксида калия 16% и плотностью 1,14 г/мл прилили раствор объёмом 86,8 мл с массовой долей серной кислоты 20% и плотностью 1,14 г/мл. Определите массу образовавшейся соли. (Ответ: 34,8 г K 2 SO 4 )
1. Смешали 100 г раствора, содержащего нитрат серебра массой 10,2 г, с раствором массой 50 г, содержащим ортофосфат натрия массой 6, 56 г. Определите массовые доли солей в полученном растворе. (Ответ: 3,6% NaNO 3 ; 2,3% Na 3 PO 4 )
2. Водный раствор, содержащий гидроксид кальция массой 3,7 г, поглотил оксид углерода ( IV ) объёмом 1,68 л (н. у.). Определите массу осадка. (Ответ: m ( CaCO 3 ) = 2,5 г)
📸 Видео
Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 3 ч. 9 класс.Скачать

Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

КАК РЕШАТЬ ЕГЭ ПО ХИМИИ? — Задачи на избыток и недостаток #shorts #youtubeshortsСкачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

6.Задачи на избыток и недостаток. Подготовка к олипиадам по химии 8-9 классСкачать

Как решать задачи по химии? Расчет по уравнениям химических реакций | TutorOnlineСкачать

8 класс.Ч.1.Решение задач по уравнению реакций.Скачать

Решение задач на избыток / недостаток. Подробный разбор.Скачать

Решение задач на избыток / недостатокСкачать

Задача на избыток и недостаток №1Скачать

задачи на избыток/недостатокСкачать

Задачи на "избыток" и "недостаток". 2 часть. 10 класс.Скачать

Количество вещества, расчеты по реакциям, избыток и недостаток | ЕГЭ по химии 2022Скачать

Как решать ЗАДАЧИ ПО ХИМИИ | Типовые задачи по химии | Задачи с уравнением химической реакцииСкачать