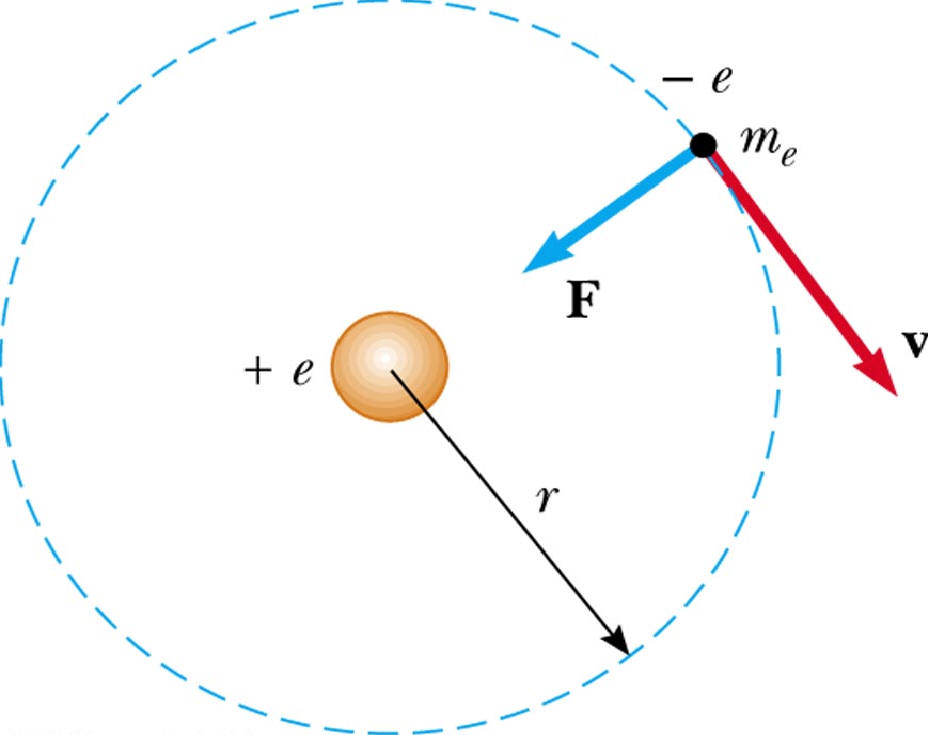
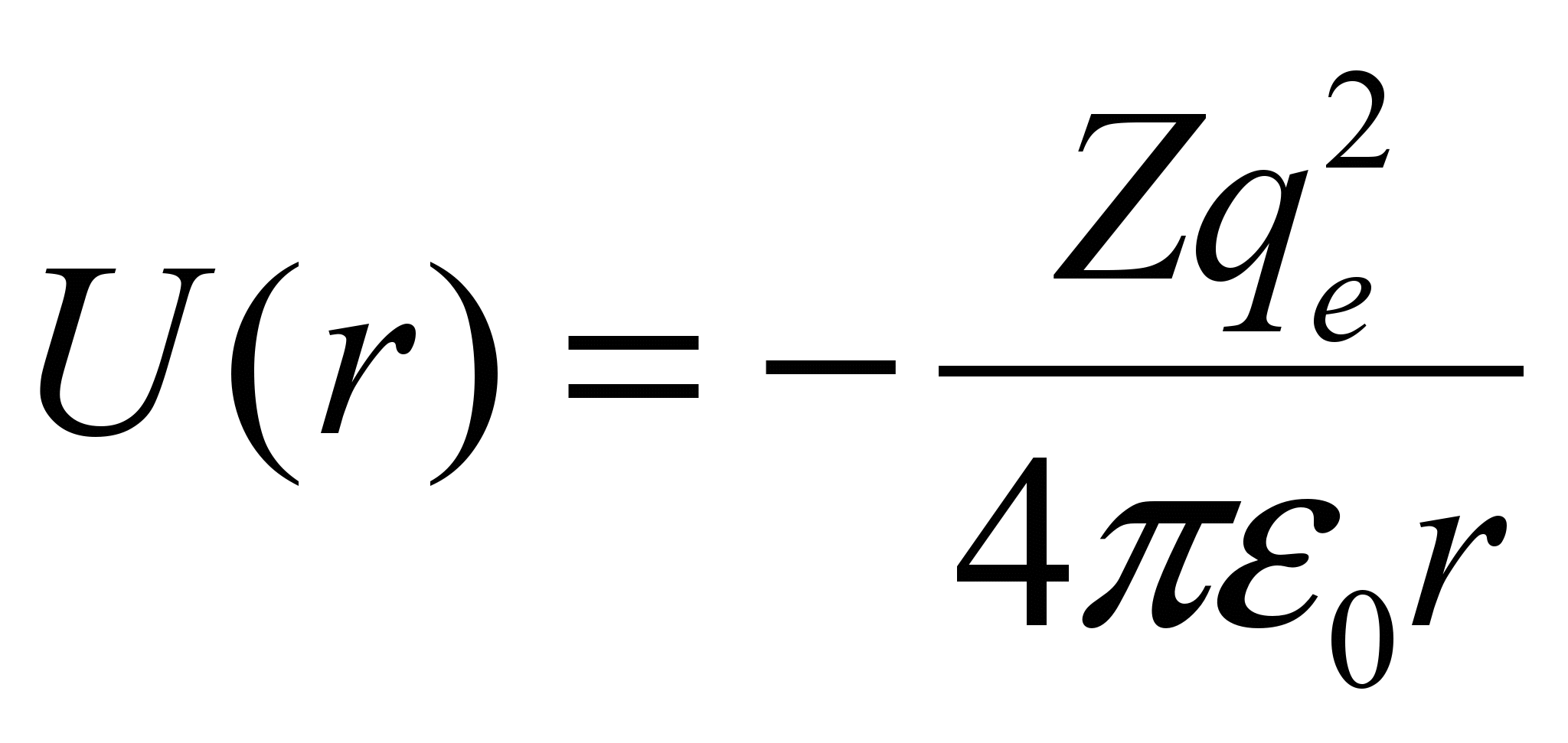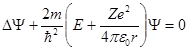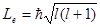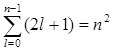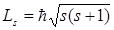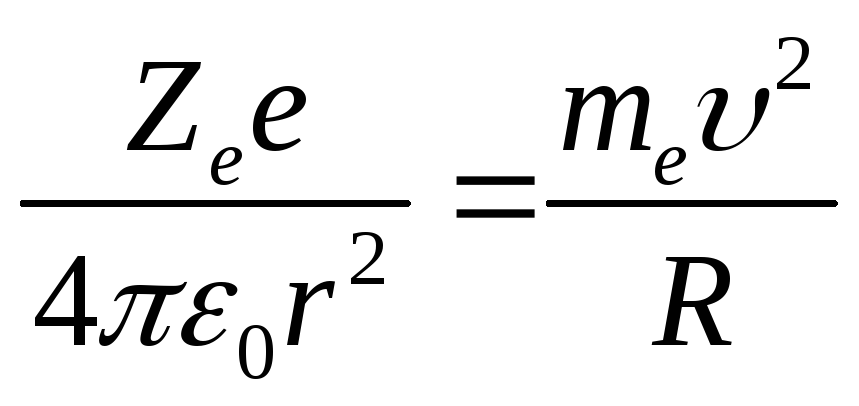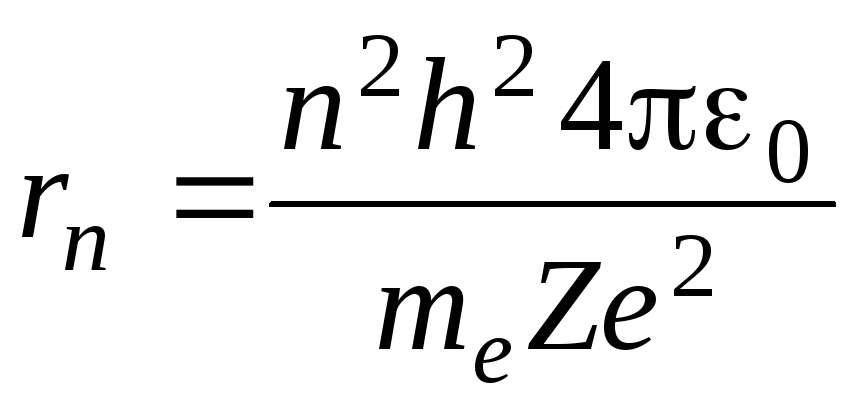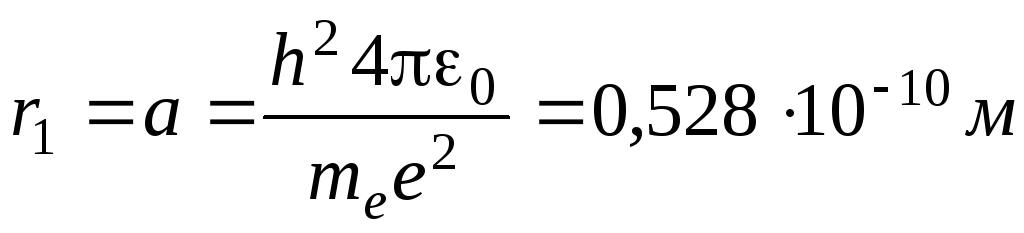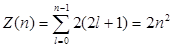Атом водорода и водородоподобные системы – это системы, состоящие из ядра с зарядом Ze и одного электрона (например, ионы He + , Li 2+ ).
Решение задачи об энергетических уровнях электрона для атома водорода (а также водородоподобных систем: иона гелия Не + , двукратно ионизованного лития Li + + и др.) сводится к задаче о движении электрона в кулоновском поле ядра.
Потенциальная энергия взаимодействия электрона с ядром, обладающим зарядом Zе (для атома водорода Z =1):
Состояние электрона в атоме водорода описывается волновой функцией Ψ, удовлетворяющей стационарному уравнению Шредингера
Его решения позволяют определить характеристики ВДПА:
Энергия . В теории дифференциальных уравнений доказывается, что такие уравнения имеют решения, удовлетворяющие требованиям однозначности, конечности и непрерывности волновой функции Ψ, только при собственных значениях энергии
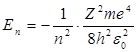
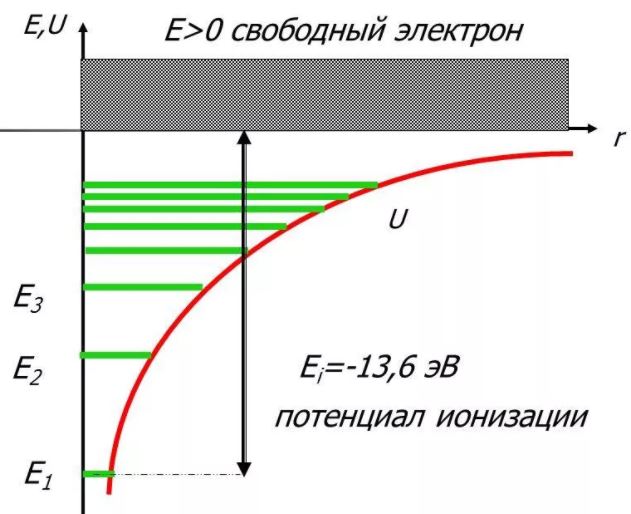
т. е. для дискретного набора отрицательных значений энергии.
Таким образом, как и в случае «потенциальной ямы» с бесконечно высокими «стенками», решение уравнения Шредингера для атома водорода приводит к появлению дискретных энергетических уровней. Самый нижний уровень Е1, отвечающий минимальной возможной энергии, – основной, все остальные (Еn>E1, n = 2, 3,…) – возбужденные. При Е 0 движение электрона является свободным; область непрерывного спектра Е >0 соответствует ионизованному атому.
Энергия ионизации атома водорода равна
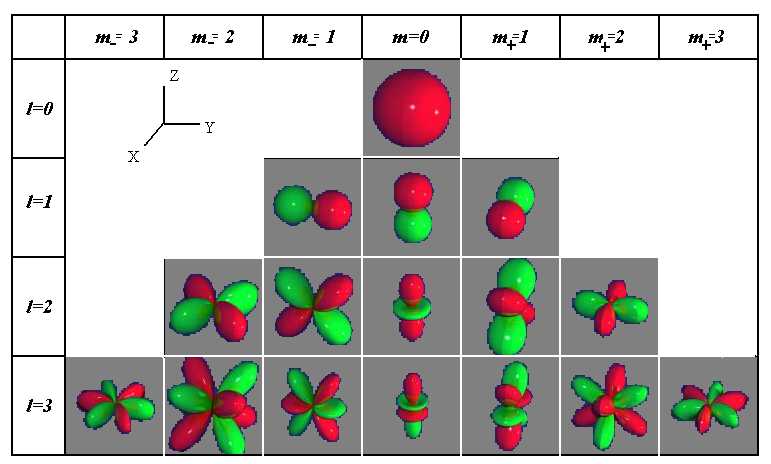
Квантовые числа . В квантовой механике доказывается, что уравнению Шредингера удовлетворяют собственные функции Ψ, определяемые тремя квантовыми числами: главным п, орбитальным l и магнитным ml.
Главное квантовое число n, определяет энергетические уровни электрона в атоме и может принимать любые целочисленные значения, начиная с единицы:
Из решения уравнения Шредингера вытекает, что момент импульса (механический и орбитальный момент) электрона квантуется, т. е. не может быть произвольным, а принимает дискретные значения, определяемые формулой
где l – орбитальное квантовое число,которое при заданном n принимает значения
т. е. всего п значений, и определяет момент импульса электрона в атоме.
Из решения уравнений Шредингера следует также, что вектор Le момента импульса электрона может иметь лишь такие ориентации в пространстве, при которых его проекция Lеz а направление z внешнего магнитного поля принимает квантованные значения, кратные ħ
где тl – магнитное квантовое число,которое при заданном l может принимать значения
т.е. всего 2l+1 значений. Таким образом, магнитное квантовое число тl определяет проекцию момента импульса электрона на заданное направление, причем вектор момента импульса электрона в атоме может иметь в пространстве 2l + 1 ориентаций.
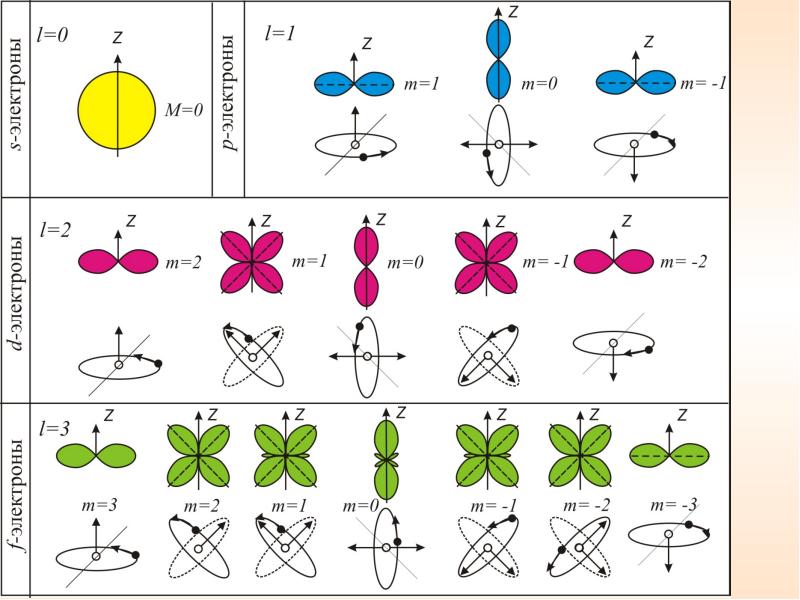
Так как при данном п орбитальное квантовое число l может изменяться от 0 до n – 1, а каждому значению l соответствует 2l + 1 различных значений тl, то число различных состояний, соответствующих данному n, равно
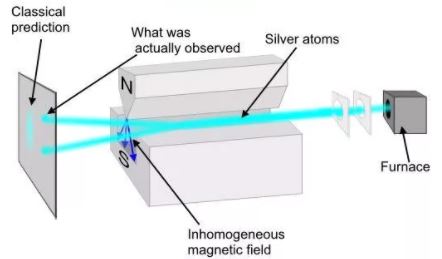
Опыт Штерна и Герлаха
О. Штерном и В. Герлахом были поставлены опыты (1921), целью которых являлось измерение магнитных моментов р m атомов различных химических элементов. Для определения орбитального момента импульса L l и р m одного электрона опыты должны быть поставлены с атомами, у которых орбитальные механические (и магнитные) моменты всех электронов, кроме одного, взаимно компенсируют друг друга. Такими атомами являются атомы химических элементов, образующие первую группу периодической системы Менделеева и имеющие один валентный электрон на внешней оболочке.
Идея опытов Штерна и Герлаха заключалась в измерении силы, действующей на атом в неоднородном магнитном поле. Опыты Штерна и Герлаха обнаружили ошибочность классического предположения отом, что магнитный момент рm и механический момент импульса Ll атома произвольно ориентируются относительно направления внешнего поля, и подтвердили наличие пространcтвенного квантования.
В трубке, где был создан вакуум порядка 10 -5 мм рт. ст., помещался источник пучка атомов — нагреваемый до высокой температуры серебряный шарик К. Атомы серебра вылетали с его поверхности со средней тепловой скоростью порядка 100 м/с, соответствующей температуре испарения серебра. Из этих атомов при помощи щелевых диафрагм В вырезался узкий пучок, проходящий через сильное и неоднородное магнитное поле, направленное перпендикулярно пучку. Основная трудность опыта состояла в том, чтобы достигнуть такой большой неоднородности магнитного поля, которая сказывалась бы на расстояниях порядка размеров атома. При такой величине неоднородности поля можно было рассчитывать получить значительную отклоняющую силу F, действующую на атом в магнитном поле. Необходимая неоднородность поля была достигнута в результате применения сильного электромагнита SN с полюсными наконечниками специальной формы. Приемником атомов серебра служила фотопластинка А.
Если бы момент импульса Ll атома (и его магнитный момент рm ) мог принимать произвольные ориентации в магнитном поле, то можно было бы ожидать непрерывного распределения попаданий атомов на пластинку с большей плотностью попаданий в середине пластинки и меньшей плотностью к ее краям. Опыты, проведенные с серебром и атомами других элементов периодической системы, привели к совершенно другому результату. На рисунке показана фотография результата опыта Штерна и Герлаха с литием. Из рисунка видно, что на фотопластинке получились две резкие полосы — все атомы отклонялись в магнитном поле двояко, что соответствовало лишь двум возможным ориентациям магнитного момента во внешнем поле. Момент импульса атома (и его магнитный момент) равен суммарным моментам электронов, поскольку магнитные моменты ядер имеют значительно меньшее значение, чем магнитные моменты электронов. Последние совпадают с суммарными моментами валентных электронов, так как моменты электронов замкнутых оболочек компенсируются.
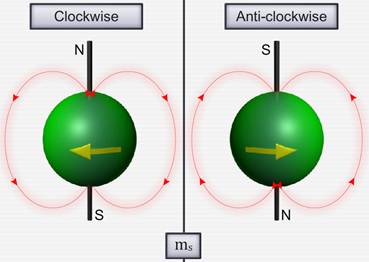
Для объяснения этого американские физики Д. Уленбек (1900- 1974) и С. Гаудсмит (1902-1979) предположили, что электрон обладает собственным неуничтожимым механическим моментом импульса, не связанным с движением электрона в пространстве — спином.
Спин электрона (и всех других микрочастиц) — квантовая величина, у нее нет классического аналога; это внутреннее неотъемлемое свойство электрона, подобное его заряду и массе.
Если электрону приписывается собственный механический момент импульса (спин) Ls, то ему соответствует собственный (спиновый) магнитный момент рms,. Согласно общим выводам квантовой механики, спин квантуется по закону
где s – спиновое квантовое число.
По аналогии с орбитальным моментом импульса, проекция Lsz, спина квантуется так, что вектор Ls, может принимать 2s + 1 ориентаций. Так как в опытах Штерна и Герлаха наблюдались только две ориентации, то 2s + 1 = 2, откуда s = 1 / 2. Проекция спина на направление внешнего магнитного поля, являясь квантованной величиной, определяется выражением
где ms – магнитное спиновое квантовое число; оно может иметь только два значения: ms = ± ½.
Таким образом, опытные данные привели к необходимости характеризовать электроны (и микрочастицы вообще) добавочной внутренней степенью свободы. Поэтому для полного описания состоянии электрона в атоме необходимо наряду с главным, орбитальным и магнитным квантовыми числами задавать еще магнитное спиновое квантовое число.
Движение электрона в атоме водорода по круговой орбите радиусом r описывается уравнением:
Найдем радиус n-орбиты:
Для атома водорода радиус первой орбиты электрона (первый боровский радиус) равен
Принцип запрета Паули
Если перейти от рассмотрения движения одной микрочастицы (одного электрона) к многоэлектронным системам, то проявляются особые свойства, не имеющие аналога в классической физике. Пусть квантово-механическая система состоит из одинаковых частиц, например электронов. Все электроны имеют одинаковые физические свойства – массу, электрический заряд, спин и др. внутренние характеристики (например, квантовые числа). Такие частицы называют тождественными, которые невозможно экспериментально различить тождественные частицы.
В классической механике даже одинаковые частицы можно различить но положению в пространстве и импульсам. Если частицы в какой-то момент времени пронумеровать, то в следующие моменты времени можно проследить за траекторией любой из них. Классические частицы, таким образом, обладают индивидуальностью.
В квантовой механике положение иное. Из соотношения неопределенностей вытекает, что для микрочастиц вообще неприменимо понятие траектории; состояние микрочастицы описывается волновой функцией, позволяющей вычислять лишь вероятность (|Ψ| 2 ) нахождения микрочастицы в окрестностях той или иной точки пространства. Если же волновые функции двух тождественных частиц в пространстве перекрываются, то разговор о том, какая частица находится в данной области, лишен смысла: можно лишь говорить о вероятности нахождения в данной области одной из тождественных частиц. Таким образом, в квантовой механике тождественные частицы полностью теряют свою индивидуальность и становятся неразличимыми.
Принцип неразличимости тождественных частиц ведет к определенному свойству симметрии волновой функции. Если при перемене частиц местами волновая функция не меняет знака, то она называется симметричной,если меняет антисимметричной.Изменение знака волновой функции не означает изменения состояния, так как физический смысл имеет лишь квадрат модуля волновой функции. В квантовой механике доказывается, что характер симметрии волновой функции не меняется со временем.
Установлено, что симметрия или антисимметрия волновых функций определяется спином частиц. В зависимости от характера симметрии все элементарные частицы и построенные из них системы (атомы, молекулы) делятся на два класса.
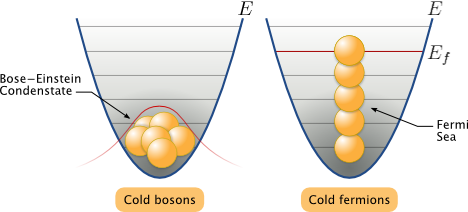
Частицы с полуцелым спином (например, электроны, протоны, нейтроны) описываются антисимметричными волновыми функциями и подчиняются статистике Ферми – Дирака; эти частицы называются фермионами.
Частицы с нулевым или целочисленным спином (например, π-мезоны, фотоны) описываются симметричными волновыми функциями и подчиняются статистике Бозе – Эйнштейна; эти частицы называются бозонами.
Сложные частицы (например, атомные ядра), составленные из нечетного числа фермионов, являются фермионами (суммарный спин – полуцелый), а из четного бозонами (суммарный спин целый).
Зависимость характера симметрии волновых функций системы тождественных частиц от спина частиц теоретически обоснована швейцарским физиком В. Паули (1900—1958), что явилось еще одним доказательством того, что спин является фундаментальной характеристикой микрочастиц.
Квантово-механическая формулировка принципа Паули:
Два одинаковых фермиона, входящих в одну систему, не могут находиться в одинаковых состояниях, так как для фермионов волновая функция должна быть антисимметричной.
Отметим, что число однотипных бозонов, находящихся в одном и том же состоянии, не лимитируется.
Таким образом, принцип Паули утверждает, что два электрона, связанные в одном и том же атоме, различаются значениями по крайней мере одного квантового числа.
Согласно принципу, данному п соответствует п 2 различных состояний электронов, отличающихся значениями l и тl. Квантовое число ms, может принимать лишь два значения (±1/2). Поэтому максимальное число электронов, находящихся в состояниях, определяемых данным главным квантовым числом, равно
Совокупность электронов в многоэлектронном атоме, имеющих одно и то же главное квантовое число n, называют электронной оболочкой.
В каждой из оболочек электроны распределяются по подоболочкам, соответствующим данному l. Поскольку орбитальное квантовое число принимает значения от 0 до п – 1, число подоболочек равно порядковому номеру п оболочки. Количество электронов в подоболочке определяется магнитным и магнитным спиновым квантовыми числами: максимальное число электронов в под оболочке с данным l равно 2 (2l+ 1).
Многоэлектронный атом
В многоэлектронном атоме, заряд которого равен Ze, электроны будут занимать различные «орбиты» (оболочки). При движении вокруг ядра Z‑электроны располагаются в соответствии с квантово‑механическим законом, который называется принципом Паули (1925 г.). Он формулируется так:
1. В любом атоме не может быть двух одинаковых электронов, определяемых набором четырех квантовых чисел: главного n, орбитального /, магнитногоm и магнитного спиновогоms.
2. В состояниях с определенным значением могут находиться в атоме не более 2n 2 электронов.
Значит, на первой оболочке («орбите») могут находиться только 2 электрона, на второй – 8, на третьей – 18 и т. д.
Таким образом, совокупность электронов в многоэлектронном атоме, имеющих одно и то же главное квантовое число n, называют электронной оболочкой . В каждой из оболочек электроны располагаются по подоболочкам, которые соответствуют определенному значению /. Так как орбитальное квантовое число l принимает значения от 0 до (n – 1), число подоболочек равно порядковому номеру оболочки п. Количество электронов в подоболочке определяется магнитным квантовым числом ml и магнитным спиновым числом ms.
- Уравнение Шредингера
- Предпосылки вывода уравнения Шредингера
- Готовые работы на аналогичную тему
- Общий вид уравнения Шредингера
- Уравнение Шредингера на примере атома водорода
- Лекция №1. Квантов0механическ0е обоснование теории строения молекул и химической связи. Строение атома (стр. 4 )
- 1. Молекула. Потенциальная поверхность. Равновесная конфигурация
- 🎦 Видео
Видео:Урок 459. Обзор квантовой теории атома водородаСкачать

Уравнение Шредингера
Вы будете перенаправлены на Автор24
Видео:Урок 455. Уравнение ШрёдингераСкачать

Предпосылки вывода уравнения Шредингера
Основная идея волновой механики заключается в том, что для таких малых тел, как электрон, нельзя с определенностью сказать, где оно находится в данное время и куда направляется. Можно установить только относительную вероятность его нахождения в том или ином месте и наличие определенного количества движения в определенный момент времени.
В соответствии с волновой механикой какая-либо система – атом, молекула, электрон и т.д. – описывается функцией состояния или волновой функцией, обозначаемой $psi$ («пси»), которая является функцией координат всех частиц, образующих эту систему. Следовательно, величина $psi$ зависит только от положения всех частиц в пространстве.
В 1924 г. де Бройль предположил, что точно также, как свет, который, как обычно считают, имеет волновую природу, на самом деле при определенных обстоятельствах ведет себя, как будто он состоит из частиц – квантов, — так и очень малые частицы, такие, как электроны, также могут обладать волновыми свойствами. Де Бройль предположил, что с пучком электронов следует связывать длину волны, определяемую уравнением
где $hbar$ – постоянная Планка ($6,626cdot 1034 Джcdot с$ или $6,626cdot 10-27 эргcdot с$), а $p$ – количество движения (импульс) электрона в пучке, т.е. его масса, умноженная на его скорость.
Физическое подтверждение волновой природы электрона было продемонстрировано в 1927 – 1928 гг. Дейвиссоном, Джермером и Томсоном, которые показали, что пучок электронов может испытывать дифракцию на подходящей решетке (атомы в кристалле золота), аналогичную дифракции пучка света.
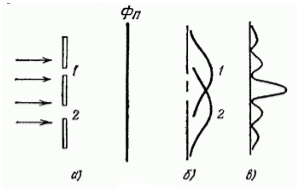
Рисунок 1. Дифракция пучка электронов
На преграду с двумя узкими щелями направлен параллельный пучок моноэнергетических (т.е. обладающих одинаковой кинетической энергией) электронов (рис. 1. а). За преградой находится фотопластина $Фn$. При закрытии щели номер $2$ и экспонировании в течение времени $t$ почернение на проявленной фотопластине будет характеризоваться кривой $1$ (рис. 1. б). При закрытии щели номер $1$, соответственно, почернение на фотопластине будет соответствовать кривой $2$. Однако в случае, когда открыты обе щели картина почернения фотопластины (рис. 1. в) отнюдь не эквивалентна наложению двух первых картин. Зато она аналогична картине, получающейся при интерференции двух когерентных световых волн.
Готовые работы на аналогичную тему
Тот факт, что системы малых частиц проявляют, по крайней мере, при определенных условиях, волновые свойства, предполагает возможность описания таких систем уравнениями, подобными те, которые описывают другие виды волнового движения, например, волны, которые распространяются вдоль колеблющейся струны, или волновое движение, приписываемое электромагнитному излучению. Действительно, можно начать с волнового уравнения, соответствующего электромагнитным волнам, и путем определенных замен, превратить его в уравнение, соответствующее нашему случаю. Хотя эти замены диктуются физическими причинами, они в основном произвольны и могут быть приняты только потому, что приводят к уравнению, которое, как показывает опыт, позволяет получить правильное решение физических задач. Поэтому следует принять волновое уравнение как постулат, так как у химиков основной интерес вызывает применение волнового уравнения к атомным и молекулярным системам, а не физические и математические соображения, которыми руководствовался Шредингер, впервые его предложивший в 1925 г.
Видео:Волновая функция (видео 5) | Квантовая физика | ФизикаСкачать
Общий вид уравнения Шредингера
Рисунок 2. Эрвин Шрёдингер (1887 — 1961)
Волновое уравнение, применяемое для расчета стационарных состояний системы, можно записать в символическом виде:
где $H$ представляет собой определенный способ выражения общей энергии системы, а $E$ – числовое значение этой энергии. Для всех систем, которые обычно интересуют химиков, общая энергия представляет собой сумму кинетической энергии $Т$ и потенциальной энергии $V$:
Это соотношение было широко использовано физиком-теоретиком Гамильтоном, поэтому $H$ часто называют функцией Гамильтона, а $mathcal H$ гамильтонианом системы.
Видео:ЧК МИФ 5 2 01 01 L4 Уравнение Шредингера для атома водородаСкачать

Уравнение Шредингера на примере атома водорода
Рассмотрим модель атома водорода, предложенную Бором. Для простоты предположим, что тяжелое ядро закреплено (оно почти, но не совершенно неподвижно, когда электрон движется вокруг него). Тогда полная кинетическая энергия $Т$ системы представляет собой просто кинетическую энергию электрона
где $m$ – масса электрона и $nu$ – его скорость. Потенциальная энергия системы есть просто энергия, возникающая вследствие электростатического взаимодействия (гравитационные силы приблизительно в $10^$ раз меньше), и ее можно выразить как
где $e$ — заряд электрона, $r$ — радиус орбиты, знак минус появляется вследствие того, что заряд одной из частиц положителен $(+)$, а другой отрицателен $(-)$. Поэтому для атома водорода функция Гамильтона в классической (т.е. доквантовомеханической) физике равна:
Если использовать понятие количества движения электрона $p=mnu$, данное уравнение запишется в следующем виде:
Теперь для перехода от классического описания этой или какой-либо другой системы к описанию при помощи волновой механики, необходимо взять функцию Гамильтона (уравнение 6) и произвести в ней определенные замены: в функции Гамильтона количество движения следует заменить выражением
Таким образом, гамильтониан для атома водорода в его квантовомеханической форме $$ следует записать в виде
Если теперь это выражение гамильтониана подставить в общее волновое уравнение (уравнение 1), то получим:
Это и есть волновое уравнение для атома водорода. Из уравнения 9 следует, что нужно вторые производные функции $psi $ сложить и умножить на $-<^2>/<8^2m>$, затем к этому добавить $left(-/right)psi $, тогда получим величину, тождественную Е$psi $. Если найдена функция $psi $, то говорят, что она является решением волнового уравнения, и ее называют волновой функцией. Вообще, может быть несколько различных функций $psi_1$, $psi_2$, . , $psi_n$, которые являются решениями уравнения 9, причем каждой соответствует свое значение энергии $Е_1$, $Е_2$, . , $Е_n$.
Видео:Квантовые числа (видео 14) | Квантовая физика | ФизикаСкачать

Лекция №1. Квантов0механическ0е обоснование теории строения молекул и химической связи. Строение атома (стр. 4 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 7 8 9 |
Из различных методов определения СЭ наиболее прямой и точный — измерение минимальной энергии фотоотрыва электрона от отрицательного иона.
Для большинства атомов присоединение электрона — экзотермический процесс. Наиболее высоким по абсолютной величине сродством к электрону обладают атомы галогенов в последовательности Cl > F > Вг > I. Энергии ионизации и сродство к электрону молекул определяют также, как это сделано для атома.
ТЕОРЕТИЧЕСКИЕ МЕТОДЫ, ПРИМЕНЯЕМЫЕ ПРИ ИЗУЧЕНИИ СТРОЕНИЯ МОЛЕКУЛ И ХИМИЧЕСКОЙ СВЯЗИ
Видео:Атомная физика. Лекция 14. Атом водорода. Гамильтониан и решение уравнения Шредингера.Скачать

1. Молекула. Потенциальная поверхность. Равновесная конфигурация
2. Теория химической связи и её задачи.
3. Вариационный метод решения уравнения Шрёдингера.
§1. Молекула. Потенциальная поверхность. Равновесная конфгурация.
В химии молекулой называют наименьшую частицу данного вещества, обладающую его химическими свойствами, способную к самостоятельному существованию. Если отвлечься от поступательного движения молекулы как целого, то в ее энергию вносят вклад три вида движения: 1) движение электронов в поле ядер, 2) колебание ядер около положения равновесия и вращение молекулы вокруг оси, проходящей через центр масс, причем Еэл >> Екол >>Евр.
Хотя эти движения взаимосвязаны, можно приближенно рассматривать их как независимые и считать энергию молекулы равной сумме электронной, колебательной и вращательной энергий:
Е = Еэл + Екол +Евр. (6.1)
Волновая функция молекулы в этом приближении равна произведению функций, описывающих указанные три вида движения:

Остановимся на наиболее важной составляющей энергии молекулы — электронной энергии. Так как скорость тяжелых ядер во много раз меньше скорости легких электронов, приближенно можно рассматривать движение электронов в молекуле в каждый данный момент, считая ядра неподвижными (приближение Борна — Оппенгеймера). Выбранному фиксированному положению ядер R отвечает определенная энергия электронов 







При сближении ядер электронная энергия 

Данная потенциальная кривая соответствует классическим представлениям. Однако в нее надо внести поправки, так как равновесное состояние неосуществимо с точки зрения квантовой механики: в этом состоянии ядра неподвижны, значит, одновременно точно определены координата (R = rе) и импульс (р = 0), что противоречит соотношению неопределенностей Гейзенберга. Параметры rе и De (рис. 6.1) относятся таким образом к гипотетическому равновесному состоянию. В действительности даже и при 0К ядра не зафиксированы при R — rе, а совершают колебания около положения равновесия. Реальная энергия молекулы при этом выше, чем предполагалась, на величину энергии «нулевых колебаний» 
Определяемая на опыте энергия диссоциации молекулы D0 отсчитывается не от минимума потенциальной кривой как De, а от уровня нулевых колебаний (рис.и связана с De соотношением

Энергия диссоциации D0, служит мерой прочности химической связи и определяется как изменение энергии в процессе — АВ = А + В при 0 К в идеально-газовом состоянии. Если специальных указаний нет, то понимается, что как молекула АВ, так и атомы А и В находятся в основном электронном состоянии. Это определение сохраняет силу и для многоатомных молекул. Например, для молекулы AmBn энергией диссоциации будет изменение энергии в процессе AmBn = mA + nB.
Потенциальная поверхность. Равновесная конфигурация. При описании потенциальной кривой вместо Eэл. мол обычно используют символ E(R) или Е. Для многоатомной молекулы Е является функцией уже не одной, а нескольких пространственных координат Rij. Например, потенциальная энергия молекулы ABC является функцией трех независимых координат — R1(A — В), R2(B — С) и угла о(АВС) или расстояний R1(A — В), R2(B — С) и R3(А — С).
Для линейной молекулы с фиксированным углом α- 180° эта функция изобразится поверхностью в трехмерном пространстве (потенциальная поверхность) Устойчивому состоянию молекулы отвечает минимальное значение ее энергии E(АВС) и определенное относительное расположение ядер в пространстве, называемое равновесной конфигурацией молекулы с параметрами rе(А — В) и rе(В — С). Глубина потенциальной ямы определяет энергию химической связи De и по формуле (5.4) энергию диссоциации молекулы D0.
Для более сложной молекулы, чем линейная ABC, равновесная конфигурация и энергия равновесного состояния определяются положением минимума на потенциальной поверхности в многомерном пространстве. Если потенциальная поверхность имеет два (или более) минимума, для молекулы возможны два изомера или более, отличающиеся параметрами равновесной конфигурации и энергией. Если минимума на потенциальной поверхности нет, данная система нестабильна, при любом расположении ядер она распадается на невзаимодействующие атомы.
Так же как и атом, молекулу можно перевести в возбужденные электронные состояния (энергия возбуждения Те), каждому из которых отвечает своя потенциальная поверхность или кривая (кривая б на рис. 6.1).
Рассмотрев потенциальную кривую (поверхность), можно дать еще одно определение молекулы молекула — физически устойчивая система, состоящая из двух (или более) ядер и определенного числа электронов, состояние которой описывается потенциальной кривой (поверхностью) с минимумом.
Говоря о физической устойчивости, понимают, что соединение атомов в молекулу сопровождается понижением энергии системы. Данным здесь определением охватываются кроме обычных молекул (Н2, СН4 и др.) также радикалы (СН, ОН, СН3 и др.) и молекулярные ионы (Н+, O2— и др.). Этому отвечает одинаковый подход теории строения к изучению перечисленных типов частиц. В тех случаях, когда молекулы одноатомны (благородные газы, пары металлов), сохраняет силу аналогичное определение для атома.
Равновесная конфигурация предполагает жесткую фиксацию всех межъядерных расстояний в молекуле. Однако реальная молекула не является жесткой системой. Вместе с тем у огромного большинства молекул амплитуды колебаний ядер весьма малы по сравнению с межъядерными расстояниями и можно, пренебрегая колебаниями, рассматривать молекулы как жесткие системы («квазижесткие» или «квазитвердые» молекулы).
Равновесные конфигурации молекул принято относить к тем или иным точечным группам симметрии.
Двухатомные молекулы подразделяются на молекулы с одинаковыми ядрами, или гомонуклеарные (например, Н2), и с неодинаковыми ядрами, или гетеронуклеарные (например, HCI). Свойства симметрии их различны.
Симметрия равновесной конфигурации определяет и симметрию электронного облака молекулы. В связи с этим гомонуклеарные и гетеронуклеарные молекулы различаются по электрическим и оптическим свойствам, таким, как дипольный момент, поляризуемость и магнитная восприимчивость, правила отбора в спектрах. То же относится и к многоатомным молекулам, различающимся по симметрии, как, например, СН4 и СН3С1.
Рассмотренные молекулярные параметры: энергия диссоциации, межъядерные расстояния, равновесная конфигурация важны для химии не только как индивидуальные характеристики молекул. По ним можно рассчитать термодинамические свойства веществ и константы равновесия химических реакций.
§2. Теория химической связи и ее задачи. Уравнение Шредингера для молекул
Взаимодействие атомов, приводящее к образованию молекул простых и сложных веществ, а также кристаллов, называют химической связью. Взаимодействие атомов многообразно, поэтому многообразны и химические связи, которые часто сводят к нескольким основным типам: ковалентной, ионной, донорно-акцепторной, водородной связи и др. Однако все эти взаимодействия можно описать с позиций единой теории химической связи.
1) Эта теория призвана объяснить, какие силы действуют между атомами, как атомы объединяются в молекулы, что обеспечивает устойчивость образовавшейся сложной частицы (то же относится к кристаллам, жидкостям и другим телам).
2) Теория должна объяснить опытные факты, лежащие в основе классического понятия валентности, и наряду с этим существование и устойчивость многочисленных соединений, не укладывающихся в привычные рамки классических структурно-химических представлений.
3) Теория должна разработать единые методы расчета молекулярных параметров, интерпретировать молекулярные спектры.
4) Наконец, теория должна сделать возможным априорный расчет скорости химического процесса, зависимости ее от строения молекул реагирующих веществ.
 |
Современная теория химической связи, теория строения молекул и кристаллов базируется на квантовой механике: молекулы, как и атомы, построены из ядер и электронов, и теория химической связи должна учитывать корпускулярно-волновой дуализм микрочастиц. До применения методов квантовой механики к химии не удавалось создать непротиворечивую теорию химической связи.
Её фундамент был заложен в 1927 г. Гейтлером и Лондоном. Выполнив на основе квантовой механики расчет свойств молекулы водорода, они показали, что природа химической связи электрическая, никаких особых сил химического взаимодействия не существует. Действующие в молекуле между ядрами и электронами гравитационные и магнитные силы пренебрежимо малы по сравнению с электрическими силами.
Квантовомеханический подход к исследованию строения атома и молекулы один и тот же: нужно составить и решить уравнение Шредингера для системы из электронов и ядер и дать физическую интерпретацию полученным решениям. Составляя уравнение Шрёдингера для электронной энергии молекулы в приближении Борна — Оппенгеймера, считают ядра неподвижными.
Следовательно, электронная энергия для молекулы не зависит от координат ядер, а только от фиксированного расстояния R между ними (рис. 6.2). Во внимание принимаются лишь изменения координат электронов. Простейшая из молекул молекулярный ион 


Для молекулярного иона 

включает притяжение электрона 1 к ядрам А и В (первые два члена) и отталкивание ядер (ядра А и В у 


где Ψ — одноэлектронная волновая функция (собственная функция Шредингера для системы с одним электроном). Индексы «эл. мол.» при E и Ψ — опущены для упрощения записи.
Состояние молекулы Н2 описывается уже двухэлектронной функцией Ψ, зависящей от координат двух электронов (см. рис. 6.2).
Многоэлектронными будут и волновые функции более сложных молекул. Уравнение Шредингера для молекулы Н2 имеет вид

Индексы 1 и 2 при операторах Лапласа указывают, что волновая функция молекулы 



В (6.9) первые четыре члена обозначают потенциальную энергию притяжения электронов 1 и 2 к ядрам А и В соответственно, пятый член — потенциальную энергию взаимного отталкивания электронов 1 и 2, последний член — энергию отталкивания ядер. Аналогично записывается уравнение Шредингера и для многоатомных молекул. В уравнениях (6.7) и (6.8) используется координатная молекулярная функция Ψ. Полная волновая функция молекулы Фмол, учитывающая и спин, должна удовлетворять принципу Паули антисимметрии волновых функций и строится в виде определителя.
Для молекулы, так же как и для атома, точное решение уравнения Шредингера возможно лишь для системы, содержащей один электрон — для молекулярного иона типа 

§3. Вариационный метод решения уравнения Шрёдингера
Одним из широко применяемых при рассмотрении теории химической связи приближенных методов решения уравнения Шредингера является вариационный метод. Здесь коротко излагается его сущность.
Уравнение Шредингера (1.1) может быть представлено в так называемой операторной форме. Для этого разделим все члены уравнения на 

Сумма двух действий, производимых над функцией Ψ в левой части, дифференцирование и умножение, может быть записана с помощью оператора 
который называют оператором энергии, оператором Гамильтона или гамильтонианом. Уравнение приобретает лаконичную форму:
По такому же принципу строится оператор Гамильтона для многоатомных систем, например, для молекулы Н2

Умножим обе части уравнения Шредингера (6.10) на функцию Ψ*, комплексно сопряженную с волновой функцией

Если Ψ — действительная функция, то Ψ*=-Ψ. (Левую сторону уравнения (6.12) нельзя записать аналогично правой в виде 



Если функция Ψ нормирована, знаменатель обращается в единицу и

Если известно точное выражение для Ψ, то энергия системы может быть рассчитана по формулам (6.13) или (6.14). Однако, обычно не известны ни Ψ ни Е либо неизвестна Ψ. Тогда для отыскания Ψ и Е можно воспользоваться вариационным принципом: подставив в (6.13) или (6.14) вместо истинной функции приближенную к ней так называемую пробную функцию Ψпробн, получим отвечающее ей значение Е. Оно обязательно будет не ниже энергии основного состояния системы E0

🎦 Видео
Хренова М.Г. - Квантовая химия - 2. Атом водородаСкачать

Квантовая физика. Лекция-семинар 8. Решение уравнения Шредингера для атома водорода.Скачать

Лучшая модель атома? [Минутка физики]Скачать
![Лучшая модель атома? [Минутка физики]](https://i.ytimg.com/vi/eybcxXiYJfc/0.jpg)
Урок 32. Уравнение ШрёдингераСкачать
Классические уравнения | уравнение Шрёдингера (координатное представление) | простейший выводСкачать

Структура материи 6: уравнение Шрёдингера. Зачем нужна квантовая механика – Виталий Бейлин | НаучпопСкачать

Квантовые числа. 1 часть. 10 класс.Скачать

"Мы зажигаем свои звёзды": Вычисления в квантовой химииСкачать

Квантовая механика 41 - Уравнение Шредингера. Гамильтониан.Скачать

Семинар №6 Момент импульса и атом водородаСкачать

Урок 460. "Портрет" атома водорода. Многоэлектронные атомыСкачать

Лекции 5-6. Уравнение Шредингера и его приближенные решения. Межатомные.Скачать

Уравнение ШрёдингераСкачать

Теория Бора. Гипотеза де Бройля. Принцип неопределенности. Уравнение Шрёдингера.Скачать