Видео:Химия | Молекулярные и ионные уравненияСкачать

Основные термины и понятия
Составление уравнений химических реакций невозможно без знания определённых обозначений, показывающих, как проходит реакция. Объединение атомов, имеющих одинаковый ядерный заряд, называют химическим элементом. Ядро атома состоит из протонов и нейтронов. Первые совпадают с числом атомного номера элемента, а значение вторых может варьироваться. Простейшими веществами называют элементы, состоящие из однотипных атомов.
Любой химический элемент описывается с помощью символов, условно обозначающих структуру веществ. Формулы являются неотъемлемой частью языка науки. Именно на их основе составляют уравнения и схемы. По своей сути они отражают количественный и качественный состав элементов. Например, запись HNO3 сообщает, что в соединении содержится одна молекула азотной кислоты, а оно само состоит из водорода, азота и кислорода. При этом в состав одного моля азотной кислоты входит по одному атому водорода и азота и 3 кислорода.
Символика элементов, условное обозначение, представляет собой химический язык. В значке содержится информация о названии, массовом числе и порядковом номере. Международное обозначение принято, согласно периодической таблице Менделеева, разработанной в начале 1870 года.
Взаимодействующие между собой вещества называются реагентами, а образующиеся в процессе реакции — продуктами. Составление и решение химических уравнений фактически сводится к определению результатов реакций, поэтому просто знать формулы веществ мало, нужно ещё уметь подбирать коэффициенты. Располагаются они перед формулой и указывают на количество молекул или атомов, принимающих участие в процессе. С правой стороны от химического вещества ставится индекс, указывающий место элемента в системе.
Записывают уравнения в виде цепочки, в которой указываются все стадии превращения вещества начиная с левой части. Вначале пишут формулы элементов в исходном состоянии, а затем последовательно их преобразование.
Видео:Химия. Молекулярные и ионные уравненияСкачать

Виды химических реакций
Химические явления характеризуются тем, что из двух и более элементов образуются новые вещества. Уравнения описывают эти процессы. Впервые с объяснениями протекания реакций знакомят в восьмом классе средней образовательной школы на уроках неорганической химии. Ученикам демонстрируют опыты, в которых явно наблюдаются различия в протекании реакций.
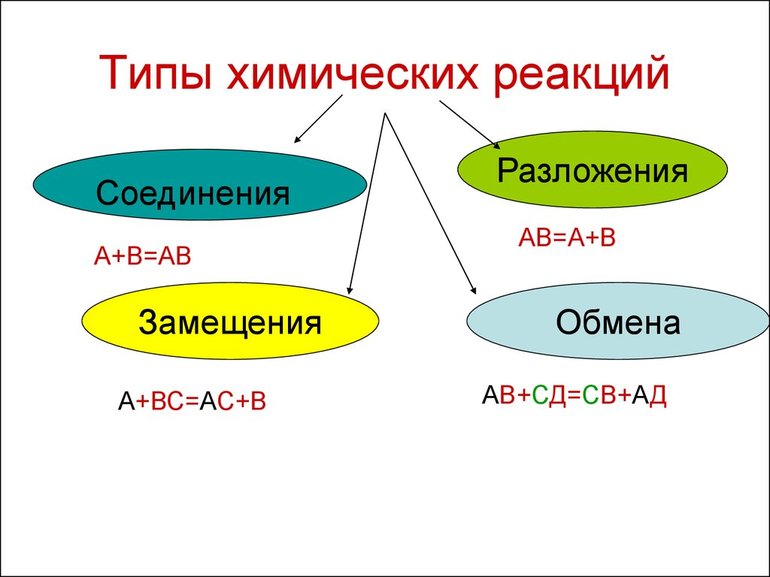
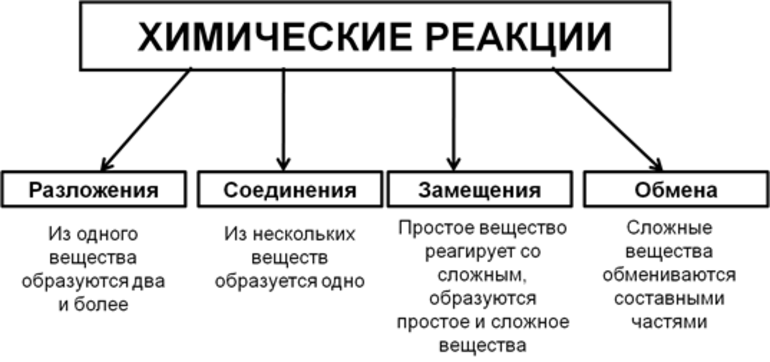
Всего существует 4 типа химического взаимодействия веществ:
- Соединение. В реакцию могут вступать 2 простых вещества: металл и неметалл или неметалл и неметалл. Например, алюминий с серой образуют сульфид алюминия. Кислород, взаимодействуя с водородом, превращается в воду. Объединятся могут 2 оксида с растворимым основанием, как оксид кальция с водой: CaO + H2O = Ca (OH)2 или основной оксид с кислотным: CaO + SO3 = CaSO4.
- Разложение. Это процесс обратный реакции соединения: было одно вещество, а стало несколько. Например, при пропускании электрического тока через воду получается водород и кислород, а при нагревании известняка 2 оксида: CaCO3 = CaO + CO2.
- Замещение. В реакцию вступают 2 элемента. Один из них простой, а второй сложный. В итоге образуются 2 новых соединения, при котором атом простого вещества заменяет сложный, как бы вытесняя его. Условие протекания процесса: простое вещество должно быть более активным, чем сложное. Например, Zn + 2HCl = ZnCl2 + H2. Величину активности можно узнать из таблицы ряда электрохимических напряжений.
- Обмен. В этом случае между собой реагируют 2 сложных элемента, обменивающиеся своими составными частями. Условием осуществления такого типа реакции является обязательное образование воды, газа или осадка. Например, CuO + 2HCl = CuCl2 + H2O. Чтобы узнать, смогут ли вещества прореагировать, используют таблицу растворимости.
Основными признаками химических реакций является изменение цвета, выделение газа или образование осадка. Различают их по числу веществ, вступивших в реакцию и образовавшихся продуктов. Правильное определение типа реакции особо важно при составлении химических уравнений, а также определения свойств и возможностей веществ.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Окислительно-восстановительный процесс
Составление большинства реакций сводится к подбору коэффициентов. Но при этом могут возникнуть трудности с установлением равновесия, согласно закону сохранения массы веществ. Чаще всего такая ситуация возникает при решении заданий, связанных с расстановкой количества атомов в уравнениях окислительно-восстановительных процессов.
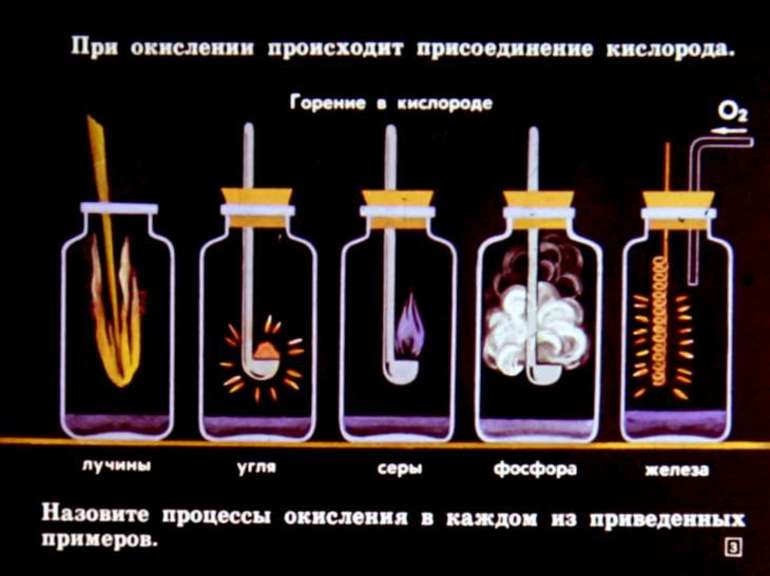
Под ними принято понимать превращения, протекающие с изменением степени окисления элементов. При окислении происходит процесс передачи атомом электронов, сопровождающийся приобретением им положительного заряда или ионом, после чего он становится нейтральным. При этом также происходит процесс восстановления, связанный с присоединением элементарных частиц атомом.
Для составления уравнений необходимо определить восстановитель, окислитель и число участвующих в реакции электронов. Коэффициенты же подбирают с помощью метода электронно-ионного баланса (полуреакций). Его суть состоит в установлении равенства путём уравнивания количества электронов, отдаваемых одним элементом и принимаемым другим.
Видео:как составить к сокращенному ионному уравнению молекулярноеСкачать

Классический алгоритм
В основе решения задач этим методом — закон сохранения массы. Согласно ему, совокупная масса элементов до реакции и после остаётся неизменной. Другими словами, происходит перегруппировка частиц. Если рассматривать решение химического уравнения поэтапно, оно будет состоять из трёх шагов:
- Написания формул элементов, вступающих в реакцию с левой стороны.
- Указания справа формулы образующихся веществ.
- Уравнивания числа атомов с добавлением коэффициентов.
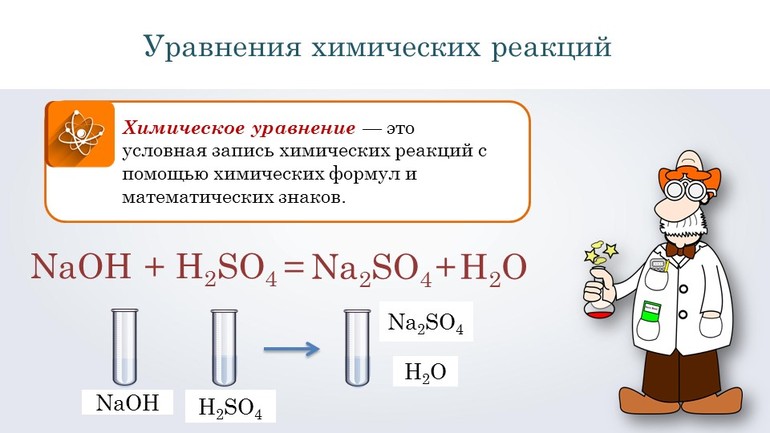
Перед тем как переходить к сложным соединениям, лучше всего потренироваться на простых. Например, нужно составить уравнение, описывающее взаимодействие двух сложных веществ: гидроксида натрия и серной кислоты. При таком соединении образуется сульфат натрия и вода.
Согласно алгоритму, в левой части уравнения необходимо записать реагенты, а в правой продукты реакции: NaOH + H2SO 4 → Na 2SO4 + H2O. Теперь следует уравнять коэффициенты. Начинают с первого элемента. В примере это натрий. В правой части содержится 2 его атома, а в левой один, поэтому необходимо возле реагента поставить цифру 2. Затем нужно уровнять водород. В результате получится выражение: 2 NaOH + H2SO 4 → Na2 SO4 +2H2O.
Ещё одним наглядным примером является процесс реакции тринитротолуола с кислородом. При их взаимодействии образуется: C7H5N3O6 + O2 → CO2 + H2O + N2. Исходя из того, что слева находится нечётное число атомов H и N, а справа чётное, нужно их уравнять: 2C7H5N3O6 + O2 → CO2 + H2O + N2.
Теперь становится понятным, что 14 и 10 атомов углерода и водорода должны образовать 14 долей диоксида и 5 молекул воды. При этом 6 атомов азота превратятся в 3. Итоговое уравнение будет выглядеть как 2C7H5N3O6 + 10,5O2 → 14CO2 + 5H2O + 3N2.
Перед тем как начинать тренировку по составлению уравнений, следует научиться расставлять валентность. Это параметр, равный числу соединившихся атомов каждого элемента. Фактически это способность к соединению. Например, в формуле NH3 валентность атома азота равна 3, а водорода 1.
Видео:Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

Решение методом полуреакций
Алгоритм для решения примеров химических уравнений проще рассмотреть на конкретном задании. Пускай необходимо описать процесс окисления пирита азотной кислоты с малой концентрацией: FeS2 + HNO3. Решать этот пример необходимо в следующей последовательности:
- Определить продукты реакции. Так как кислота является сильным окислителем, сера получит максимальную степень оксидации S6+, а железо Fe3+. HNO3 может восстановиться до одного из двух состояний NO2 или NO.
- Исходя из состава ионов и правила, что вещества, переходящие в газовую форму или плохо растворимые, записываются в молекулярном виде, верным будет записать: FeS2 — Fe3+ + 2SO2−4. Гидролизом можно пренебречь.
- В записи уравнивают кислород. Для этого в левую часть добавляют 8 молекул воды, а в правую 16 ионов водорода: FeS2 + 8H20 — Fe3+ + 2SO2−4 + 16H+. Так как заряда в левой части нет, а в правой он равный +15, то серное железо должно будет отдать 15 электронов. Значит, уравнение примет вид: FeS2 + 8H20 — 15e → Fe3+ + 2SO2−4 + 16H+.
- Теперь переходят к реакции восстановления нитрата иона: NO-3 →NO. Для её составления нужно отнять у оксида азота 2 атома кислорода. Делают это путём прибавления к левой части 4 ионов водорода, а правой — 2 молекул воды. В итоге получится: NO-3 + 4H+ → NO + 2H2O.
- Полученную формулу уравнивают добавлением к левой части 3 электронов: NO-3 + 4H+ 3e → NO + 2H2O.
- Объединяют найденные выражения и записывают результат: FeS2 + 8H20 + 5NO-3 + 20H+ → Fe3+ + 2SO2−4 + 16H+ + 5NO + 10H2O.
Уравнение можно сократить на 16H + и 8H2O. В итоге получится сокращённое выражение окислительно-восстановительной реакции: FeS2 + 5NO — 3 + 4 H + = Fe3 + + 2SO 2- 4 + 5NO + 2H2O.
Такой алгоритм считается классическим, но для упрощения понимания лучше использовать способ электронного баланса. Процесс восстановления переписывают как N5+ + 3e → N2+. Степень же окисления составить сложнее. Сере нужно приписать степень 2+ и учесть, что на 1 атом железа приходится 2 атома серы: FeS2 → Fe3++ 2S6+. Запись общего баланса будет выглядеть: FeS2 + 5N5+ = Fe3+ + 2S6+ + 5N2+.
Пять молекул потратятся на окисление серного железа, а ещё 3 на образование Fe (NO3)3. После уравнения двух сторон запись реакции примет вид, аналогичный полученному с использованием предыдущего метода.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Использование онлайн-расчёта
Простые уравнения решать самостоятельно довольно просто. Но состоящие из сложных веществ могут вызвать трудности даже у опытных химиков. Чтобы получить точную формулу и не подбирать вручную коэффициенты, можно воспользоваться онлайн-калькуляторами. При этом их использовать сможет даже пользователь, не особо разбирающийся в науке.
Чтобы расстановка коэффициентов в химических уравнениях онлайн происходила автоматически, нужно лишь подключение к интернету и исходные данные. Система самостоятельно вычислит продукты реакции и уравняет обе стороны формулы. Интересной особенностью таких сайтов является не только быстрый и правильный расчёт, но и описание правил с алгоритмами, по которому выполняются действия.
После загрузки калькулятора в веб-обозревателе единственное, что требуется от пользователя — правильно ввести реагенты в специальные формы латинскими буквами и нажать кнопку «Уравнять». Иногда возникает ситуация, когда запись сделана верно, но коэффициенты не расставляются. Это происходит, если суммы в уравнении могут быть подсчитаны разными способами. Характерно это для реакций окисления. В таком случае нужно заменить фрагменты молекул на любой произвольный символ. Таким способом можно не только рассчитать непонятное уравнение, но и выполнить проверку своих вычислений.
Видео:Реакции ионного обмена. 9 класс.Скачать

Советы по поиску химический реакций онлайн
Если вам нужно найти уравнение, в котором присутствуют вещества, например HCl напишите в поле выше.
Если вам нужно найти вещества которые вступают в реакцию, напишите Ag3PO4 + HCl =. Будут найдены вещества только в левой части уравнения.
Если вам известны продукты реакции и вы хотите найти какие вещества должны вступить в реакцию, напишите = Ag3PO4 + HCl
Если вы поискали, но ничего не нашли, напишите нам, и мы добавим нужную реакцию на сайт.
If you are looking for chemical equations in English click here.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 🔍 ВидеоЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать  Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать  Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать  Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать  Всё про окислительно-восстановительные реакции | ТурбоЕГЭ по химииСкачать  9 класс. Реакции ионного обмена. Ионные уравнения.Скачать  Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать  МОЛЯРНАЯ МАССА ХИМИЯ // Урок Химии 8 класс: Относительная Молекулярная МассаСкачать  ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать  Составление уравнений химических реакций. 1 часть. 8 класс.Скачать  Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать  Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать  |