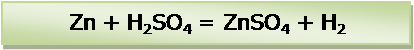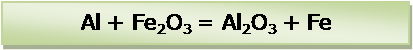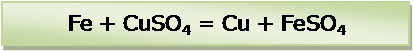8 класс — Итоговое тестирование
8 класс — Названия химических элементов
8 класс — Строение атома
8 класс — Строение электронных оболочек атомов
8 класс — Закономерности изменения химических свойств элементов
8 класс — Классификация неорганических соединений
8 класс — Валентность химических элементов
8 класс — Степени окисления
8 класс — Молярная масса вещества
8 класс — Количество вещества (моль)
8 класс — Типы химических связей
8 класс — Типы химических реакций
8 класс — Расстановка коэффициентов уровень 1
8 класс — Расстановка коэффициентов в химическом уравнении. уровень 2
8 класс — Оксиды и их классификация
8 класс — Химические свойства оксидов
8 класс — Типичные реакции оксидов
8 класс — Составление формул уровень 1
8 класс — Составление формул. Уровень 2
8 класс — Названия кислотных остатков
8 класс — Названия кислот
8 класс — Химические свойства кислот
8 класс — Индикаторы
8 класс — Реакции ионного обмена
8 класс — Типичные реакции кислот
8 класс — Химические свойства оснований
8 класс — Типичные реакции оснований
8 класс — Химические свойства солей
8 класс — Типичные реакции солей
8 класс — Вычисление массовой доли элемента
8 класс — Химические и физические свойства кислорода и водорода
Для учеников 8-х классов мы подготовили большой блок заданий по неорганической химии. Здесь вы найдете ответы на большинство вопросов из школьной программы и сможете прокачать учебные навыки за короткий срок. Все тестовые задания по химии для 8 класса сгруппированы по темам, поэтому вам будет легко ориентироваться и выбирать нужный раздел.
Выполнение каждого теста занимает не более 2 минут, а итоговый тест по химии за 8 класс, в который включены вопросы из разных разделов, можно сделать за 5-10 минут. Система учитывает не только количество правильных ответов, но и время выполнения задания. По итогам она формирует рейтинг ученика и предлагает алгоритм дальнейшего тестирования. Вы сможете оценить собственный уровень подготовки и принять меры для устранения пробелов в знаниях по неорганической химии.
Все задания по химии за 8 класс решаются в режиме онлайн. На экране появляется вопрос и 4 варианта ответа, из которых только один является правильным. Ваша задача – выбрать верный ответ. Если вы ошибетесь, загорится красный цвет, но сразу же будет показан и верный вариант в зеленом поле. Таким образом, время выполнения задания сведено к минимуму. Вам не потребуется ничего писать и листать учебники и справочники. Наш тренажер можно с успехом использовать в качестве гдз по химии, 8 класс, и регулярно проверять правильность ответов с его помощью.
Секрет успеха заключается в том, что с помощью интеллектуальной платформы мы делаем процесс перевода знаний в навык максимально эффективным, учитываем уровень знаний и индивидуальные особенности каждого ученика. Это позволяет в максимально короткие сроки сформировать учебные умения и навыки. Для этого необходимо не просто пройти тестирование по химии для 8 класса, но и воспользоваться тренажером для закрепления знаний.
Входной тест по химии для 8 класса каждый может пройти бесплатно, выбрав тему, которая вызывает наибольшие затруднения. Затем нужно будет зарегистрироваться на сайте и внести плату за доступ к тренажерам. Мы предлагаем различные варианты доступа: на месяц, полугодие или целый учебный год, при этом вы получаете возможность выполнять все типы заданий, размещенные на образовательной платформе. Можно совершенствовать только один навык, в этом случае задания по химии 8 класс с ответами будут предоставляться строго по выбранной теме.
Очень удобно заниматься на тренажере при подготовке к итоговым экзаменам, когда требуется быстро повторить все темы школьной программы. В этом случае вы получите возможность не только пройти тесты по химии за 8 класс с ответами, но и пройти тестирование по другим разделам органической и неорганической химии, вспомнить сложные формулы и повторить решение задач. По итогам тестирования система формирует рейтинги предлагает продолжить занятия, пока не будет достигнут 100% результат. Она напомнит, когда следует вновь сесть за тренажер.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Расстановка коэффициентов в уравнении онлайн
Видео:8 класс. Составление уравнений химических реакций.Скачать

Рекомендации по пользованию сервисом
1) Для того,чтобы расставить расставить коэффициенты в уравнении химической реакции онлайн вставьте уравнение и нажмите «Уравнять»
2) Символы химических элементов следует записывать строго в том виде, в котором они фигурируют в таблице Менделеева. Т.е. первая буква в обозначении символа любого химического элемента должна быть заглавной, а вторая строчной. Например, символ химического элемента марганца следует записать как Mn, но не ни в коем случае как mn и mN;
3) Изредка возникают ситуации, когда формулы реагентов и продуктов записаны абсолютно верно, но коэффициенты все равно не расставляются. Такое может возникать в тех случаях, если коэффициенты в уравнении могут быть расставлены двумя или более способами. Наиболее вероятно возникновение такой проблемы с реакциями окисления органических веществ при которых рвется углеродный скелет. В таком случае попробуйте заменить неизменяемые фрагменты органических молекул на какой-нибудь произвольный символ, например радикал фенил C6H5 можно обозначить как Ph или X. Например, следующее уравнение:
не будет сбалансировано, так как возможна разная расстановка коэффициентов. Однако, введя обозначение C6H5 = Ph, расстановка коэффициентов происходит корректно:
Примечание
В уравнении допускается для разделения формул реагентов от формул продуктов использовать как знак равенства (=), так и стрелку (→), а также случайная запись отдельных букв символов химических элементов не латиницей, а кириллицей в случае их идентичного написания, как, например, символов C, H, O, P.
В случае, если программа оказалась полезной для Вас вы можете поделиться ссылкой на нее с друзьями в социальных сетях (кнопка внизу).
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Решение химических уравнений онлайн тренажер
Проверить количество атомов (ионов) цинка и серы в левой и правой частях уравнения химической реакции. Равное количество: по 1. Проверить количество атомов (ионов) водорода в левой и правой частях уравнения. Равное количество: по 2. Последним проверить количество атомов кислорода. Равное количество: по 4.
Комментарий.
Проверить количество атомов (ионов) меди в левой и правой частях уравнения химической реакции. Равное количество: по 1. Проверить количество атомов азота в левой и правой частях уравнения. Количество разное: левая часть уравнения: 1. В правой части уравнения: 2. Уравнять количество атомов азота. В левой части уравнения перед формулой азотной кислоты (HNO3)поставить коэффициент 2. Количество атомов азота стало равным в левой и правой частях уравнения: по 2. Проверить количество атомов (ионов) водорода. Равное количество: по 2. Последним проверить количество атомов кислорода. Равное количество: по 7. В левой части уравнения: 1 атом в оксиде меди (II) – CuO — и 6 атомов (2∙3) в двух молекулах азотной кислоты.
Комментарий.
Проверить количество атомов алюминия в левой и правой частях уравнения химической реакции. Количество атомов отличается. В левой части: 1 атом. В правой части: 2 атома. В левой части уравнения перед формулой простого вещества алюминий поставить коэффициент 2. Количество атомов алюминия стало равным в левой и правой частях уравнения: по 2. Проверить количество атомов железа. Количество атомов отличается. В левой части: 2 атома. В правой части: 1 атом. В правой части уравнения перед формулой простого вещества железо поставить коэффициент 2. Количество атомов железа стало равным в левой и правой частях уравнения: по 2. Последним проверить количество атомов кислорода. Равное количество: по 3. В левой части уравнения: 3 атома в оксиде железа (III) – Fe2O3 и 3 атома в оксиде алюминия Al2O3.
Комментарий.
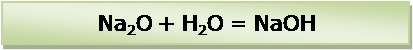
Проверить количество атомов натрия в левой и правой частях уравнения химической реакции. Количество атомов отличается. В левой части: 2 атома. В правой части: 1 атом. В правой части уравнения перед формулой гидроксида натрия (NaOH) поставить коэффициент 2. Количество атомов натрия стало равным в левой и правой частях уравнения: по 2. Проверить количество атомов водорода. Количество атомов равное: по 2. В левой части: 2 атома в молекуле воды. В правой части: 2 атома в двух молекулах гидроксида натрия (в каждой по 1 атому). Последним проверить количество атомов кислорода. Равное количество: по 2. В левой части уравнения: 1 атом в оксиде натрия и 1 атом в оксиде водорода (H2O). В правой части уравнения: 2 атома в двух молекулах гидроксида натрия (в каждой по 1 атому).
Комментарий.
Проверить количество атомов (ионов) железа и меди в левой и правой частях уравнения химической реакции. Равное количество: по 1. Последним проверить количество атомов кислорода. Равное количество: по 4.
📹 Видео
Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

8 класс. Химия. Как расставить коэффициенты в уравнении?Скачать

Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

8 класс.Ч.1.Решение задач по уравнению реакций.Скачать

Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

Химические уравнения. Урок 15. Химия 7 классСкачать

ХИМИЧЕСКИЕ УРАВНЕНИЯ | Как составлять уравнения реакций | Химия 8 классСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Проклятая химическая реакция 😜 #shortsСкачать

Как расставлять коэффициенты в уравнениях реакций? #shorts #youtubeshortsСкачать

Составление уравнений химических реакций. 2 часть. 8 класс.Скачать