Видео:Реакции металлов с кислородом и водой. 8 класс.Скачать

Что такое химия золота

HNO3 + 3HCl → NOCl + Cl2 + 2H2O
Нитрозилхлорид и хлор образуют два активных компонента растворяют золото :
Au + NOCl2 + Cl2 → AuCl3 + 2H2O
Данная реакция протекает уже при комнатной температуре и может не требовать дополнительного нагрева в зависимости от измельченности золота .
Из за большого содержания хлора и соляной кислоты хлорид золота три присоединяет молекулу хлора образуя тетрахлороаурат (III) водорода или тетрахлорозолотую кислоту .
AuCl3 + HCl → H(AuCl4)
В результате получается крупный легко фильтрующий жёлтый порошок .
А если эта кислота растворяет царь золото то её назвали в честь растворения золота царской водкой .
Восстановление золота из хлоридов осуществляется путем взаимодействия тетрахлороаурат (III) водорода с сульфатом железа ( II ) FeSO4 , сернистый газ SO2 , гидразин N2H4 :
AuCl4 + N2H4 → Au + N2 + HCl
2AuCl4 + FeSO4 → 2Au + 3Fe2SO4 + Cl2
AuCl4 + 3SO2 + 6H2O → 2Au + 3SO4 + 8Cl + 12H
Даже перекись водорода в реакции по восстановлению золота ведёт себя как восстановитель :
2AuCl4 + 3H2O2 → 2Au + 8Cl + 6H + 3O2
Взаимодействие чистого углерода с хлоридом золота так же приводит в восстановлению золота :
4[AuCl4] + 3C + 6H2O → 4Au + 3CO2+ 16Cl2 + 12H
Восстановление золота можно проводить и с помощью хлорида олова SnCl2 зачастую эту реакцию используют в качестве качественной реакции на золото в зависимости от кислотности раствора он окрашивается в красный пурпурный цвет , а если кислотность большая цвет окрашивается в тёмные цвета .
Также как качественная реакция по определению золота может быть использована взаимодействие золотохлористводородной кислоты с раствором йодида калия :
AuCl4 + KI → AuI3 + 4Cl
Который осядет в виде нерастворимого тёмно зелёного осадка который в свою очередь может восстановлен в золото с помощью простого нагревания , процесс восстановления начинает протекать уже при 177 градусах :
Так же обратная реакция может быть использована для окисления золота йодом :
Реакция с бромом протекает при комнатной температуре с образованием бромида золота три :
2Au + 3Br2 → Au2Br6
Данный материал используют как катализатор в некоторых химических органических реакциях Для восстановления золота из бромидов нужно нагреть бромид золота три , что приведёт к частичному восстановлению золота . При дальнейшем нагревании бромида золота (I) при температуре свыше 250 градусов приведёт к полной потере брома и полное восстановление золота
AuBr + t → Au + Br
Помимо царской водки которая растворяет золото на основе хлора , нашло широкое применение прямого действия на золото газообразного хлора Cl реакция лежит на основе гидрохлорирования и переменятся для извлечения золота из переработанных радиодеталей .
2Au + 3Cl2 + 2HCl → 2HAuCl4
Недостаток данной реакции в том , что материалы реакции нужно нагревать до температуры не менее чем 200°C , что затрудняет и так опасное получение золота .
Также в этой реакции можно использовать хлорную воду которую получают взаимодействием хлора с водой :
Cl2 + H2O → HClO + HCl
Au + HClO + HCl → H(AuCl4)
Из кислот составляющий одно наименование растворяет золото только селеновая кислота H2SeO3 реакция протекает при температуре 200°C .
2Au + 6H2SeO4 →Au2(SeO3)3 + 3H2SeO3 + 3H2O
в результате чего получаться раствор красно — жёлтого цвета селената золота (III) который не растворим при обычных условиях в воде , но растворим в серной H2SO4 и азотной кислоте HNO3 . А вот соляная кислота HCl приводит к его разрушению .
Самое известное применение по окислению золота после царской водки можно отдать цианированию , оно основано в взаимодействии кислорода воздуха или других окислителей в присутствии цианидов . В качестве цианидов используют соли калия или натрия , другими словами всеми известный цианистый калий , по мимо солей можно использовать и цианистую кислоту ( синильная кислота ) но из за большой ядовитости не используется . Эту реакцию цианирования золота применяют для получения золота из руды с малым содержанием благородного металла .
4Au + 8NaCN + 2H2O → 4Na[Au(CN)2] + 4NaOH
Восстановление из цианоауратов производиться с помощью мелкого цинка :
2Na[Au(CN)2] + Zn → Na2[Zn(CN)4] + 2Au
Со фтором F благородный металл реагирует с образованием фторидов золота , но данная реакция не устойчивая и заканчивается тем что материал просто разлагается на производные фтор и золото . Интервал температуры при которой реакция ведёт стабильно от 300 до 400 градусов :
В недавнем прошлом золото добывали с довольно известным способом амальгамацией , её с начало приписывали к алхимии как получение золота из ртути после возгонки и нагревания некоторых руд . В последствии стало известно , что ртуть вступает в природный сплав с золотом уже при комнатной температуре , а нагревание разлагает на простые компоненты золото и ртуть :
AuHg + t → Au + Hg
Единственное , что нужно было сделать это провести рафинирование золота с последующим электрохимическим восстановлением , что приведёт к получению золота 999, 9 пробы.
Статья на тему химия золота
Похожие страницы:
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
Видео:Взаимодействие щелочных металлов с водойСкачать

Золото (Au)
Золото является одним из самых «необычных» металлов, известных человеку с давних пор — наши предки использовали золото по большей части в культурно-религиозных целях, а также в качестве одного из самых надежных платежных средств.
Золото в природе встречается в подавляющем большинстве случаев в виде самородков. С некоторыми металлами золото может образовывать природные твердые растворы:
- электрум — серебристое золото;
- аурокуприд — меднистое золото;
- платинистое золото.
В виде соединений золото в природе встречается гораздо реже (калагерит AuTe2, ауростибит AuSb2). Достаточно много золота содержится в морской воде, но добыча такого золота нерентабельна.
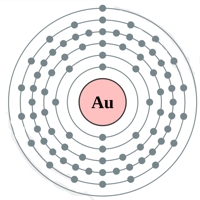
Рис. Строение атома золота.
Электронная конфигурация атома золота — 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 14 5s 2 5p 6 5d 10 6s 1 (см. Электронная структура атомов). Золото является одним из самых малоактивных химических элементов — оно не окисляется на воздухе даже в присутствии влаги, не взаимодействует непосредственно с кислородом, водородом, азотом, углеродом, фосфором.
Физические свойства золота:
- золотисто-желтый металл;
- очень пластичный и мягкий — можно раскатать в прозрачную фольгу толщиной несколько микрон (сусальное золото), которой покрывать разнообразные художественные и религиозные изделия (производить золочение), придавая им эстетический привлекательный вид, который сохраняется длительное время;
- обладает хорошей электро- и теплопроводностью.
Химические свойства золота:
- реагирует с галогенами при нагревании: 2Au + 3Cl2 = 2AuCl3;
- не растворяется в щелочных и кислотных растворах;
- растворяется в смесях кислот: HCl+HNO3 (царской водке) и H2SO4+HNO3: Au + 3HNO3 + 3HCl = AuCl3 + 3NO2 + 3H2O;
- металлическое золото переходит в раствор в виде комплексной соли в водных растворах цианида калия и натрия в присутствии окислителей: 4Au + 8KCN + 2H2O + O2 = 4K[Au(CN)2] + 4KOH;
- легко растворяется в ртути с образованием сплава (амальгамы).
Кислородные соединения золота при незначительном нагревании легко разлагаются со взрывом, например, гремучее золото взрывается при 145°C.
Соединения золота достаточно легко гидролизуются и восстанавливаются до свободного металла в водных растворах, поскольку являются неустойчивыми соединениями: при нагревании гидроксид золота (III) дегидратируется образуя оксид золота (III), который, в свою очередь, распадается с образованием свободного золота при 160°C: 4Au(OH)3 → 2Au2O3 → 4Au + 3O2.
Гидроксид и оксид золота (III) — амфотерные соединения, реагируют с кислотами и основаниями, образуя комплексные соединения:
Применение золота:
- в ювелирном деле;
- как международное платежное средство;
- в электротехнике для золочения контактов;
- для нанесения покрытий на металлические поверхности;
- в медицине для изготовления инструментов и протезов;
- как катализатор при проведении некоторых реакций в химической промышленности;
- радиоактивный изотоп золота применяют в онкологии для лечения новообразований.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

В чем растворяется золото: обзор химикатов, способных растворить золото
Золото — крайне малоактивный металл. Даже в природе оно встречается, в основном, в виде самородков (в отличие от щелочных и щелочноземельных металлов, находящихся исключительно в составе минералов или других соединений). При долгом нахождении на воздухе оно не окисляется кислородом ( сей благородный металл ценят в том числе и за это). Поэтому найти, в чем растворяется золото, достаточно сложно, но можно.
Видео:8 класс. Составление уравнений химических реакций.Скачать

Промышленный метод
При добыче золота из так называемых золотоносных песков приходится работать со взвесью примерно одинаково мелких частиц золота и песчинок, которые нужно отделить друг от друга. Можно сделать это с помощью промывания, а можно использовать цианид натрия или калия — разницы нет. Дело в том, что золото образует растворимый комплекс с цианид-ионами, а песок не растворяется и остается как есть.
Ключевым моментом в этой реакции является наличие кислорода (того, что содержится в воздухе, достаточно): кислород окисляет золото в присутствии цианид-ионов и получается комплекс. При недостаточном количестве воздуха или сама по себе без цианида реакция не идет.
Сейчас это наиболее распространенный способ промышленного получения золота. Конечно, до получения конечного продукта еще много стадий, но нас интересует конкретно этот этап: растворы цианидов — то, в чем растворяется золото.
Видео:Взаимодействие металлов с кислотами. 8 класс.Скачать

Амальгама
Процесс амальгамации также применяют в промышленности, только уже при работе с рудами и твердыми породами. Суть его заключается в способности ртути образовывать амальгаму — интерметаллическое соединение. Строго говоря, ртуть в этом процессе не растворяет золото: оно остается в амальгаме в твердом виде.
При амальгамации идет смачивание породы жидкой ртутью. Однако процесс «вытягивания» золота в амальгаму долгий, опасный (пары ртути ядовиты) и малоэффективный, поэтому этот метод уже редко где применяют.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Царская водка
Есть много кислот, способных разъедать живые ткани и оставлять страшные химические ожоги (вплоть до летального исхода). Однако нет такой одиночной кислоты, в какой растворяется золото. Из всех кислот подействовать на него может только знаменитая смесь — царская водка. Это азотная и соляная (хлороводородная) кислоты, взятые в соотношении 3 к 1 по объему. Замечательные свойства этого адского коктейля обусловлены тем, что кислоты берутся в очень больших концентрациях, что сильно повышает их окислительную способность.
Царская водка начинает действовать с того, что азотная кислота начинает окислять сперва соляную, и в ходе этой реакции образуется атомарный хлор — очень реакционноспособная частица. Именно она идет на атаку золота и образует с ним комплекс — золотохлористоводородную кислоту.
Это очень полезный реактив. Очень часто золото хранят в лаборатории именно в виде кристаллогидрата такой кислоты. Нам же оно служит лишь подтверждением того, что золото растворяется в царской водке.
Стоит еще раз обратить внимание на то, что окисляет металл в этой реакции не одна из двух кислот, а продукт их взаимной реакции. Так что если взять, например, одну лишь «азотку» — известную кислоту-окислитель — ничего не выйдет. Ни концентрация, ни температура не смогут сделать так, чтобы золото растворилось в азотной кислоте.
Видео:Проклятая химическая реакция 😜 #shortsСкачать

Хлорка
В отличие от кислот, в частности хлороводородной кислоты, отдельные вещества могут стать тем, в чем растворяется золото. Широко известная бытовая хлорка — раствор газообразного хлора в воде. Конечно, обычным магазинным раствором ничего не сделаешь, нужны концентрации повыше.
Хлорная вода действует следующим образом: хлор диссоциирует на соляную и на хлорноватистую кислоты. Хлорноватистая кислота под светом разлагается на кислород и соляную кислоту. В таком разложении выделяется атомарный кислород: как и атомарный хлор в реакции с царской водкой, он очень активен и окисляет золото за милую душу. В итоге опять получается комплекс золота с хлором, как и в предыдущем способе.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Другие галогены
Кроме хлора, золото также неплохо окисляют и другие элементы седьмой группы таблицы Менделеева. В полной мере сказать о них: «то, в чем растворяется золото» — трудно.
С фтором золото может реагировать по-разному: при прямом синтезе (с температурой 300-400°С) образуется фторид золота III, который в воде немедленно гидролизуется. Он настолько неустойчив, что разлагается даже при воздействии плавиковой (фтороводородной) кислоты, хотя среди фторид-ионов ему должно быть комфортно.
Также действием сильнейших окислителей: фторидов благородных газов (криптона, ксенона) можно получить и фторид золота V. Такой фторид вообще взрывается при контакте с водой.
С бромом дела обстоят несколько проще. Бром в обычных условиях — жидкость, и золото неплохо рассеивается в его растворах, образуя растворимый бромид золота III.
С йодом золото также реагирует при нагревании (до 400°С), образуя йодид золота I (такая степень окисления объясняется меньшей активностью йода по сравнению с другими галогенами).
Таким образом, золото, несомненно, реагирует с галогенами, однако растворяется ли золото в них — спорное утверждение.
Видео:Типы химических реакций. 1 часть. 8 класс.Скачать

Раствор Люголя
На самом деле, йод (обычный йод I2) в воде нерастворим. А растворим его комплекс с йодидом калия. Это соединение называется раствором Люголя — и он умеет растворять золото. Между прочим, им же часто смазывают горло болеющим ангиной, так что не все так однозначно.
Эта реакция также идет через образование комплексов. Золото образует с йодом комплексные анионы. Используется, как правило, для травления золота — процесс, при котором взаимодействие идет только с поверхностью металла. Раствор Люголя удобен в этом случае, потому что в отличие от царской водки и цианидов, реакция идет заметно медленнее (и реактивы доступнее).
Видео:ВСЕ РЕАКЦИИ С АЗОТОМ И ЕГО СОЕДИНЕНИЯМИ | ЕГЭ ХИМИЯ 2024| НООСкачать

Бонус
Говоря о том, что одиночные кислоты — это то, в чем золото не растворяется, мы немного соврали — на самом деле такие кислоты есть.
Хлорная кислота — одна из самых сильных кислот. Ее окислительные свойства чрезвычайно высоки. В разбавленном растворе они проявляются плохо, однако в больших концентрациях творят чудеса. При реакции образуется ее соль перхлорат золота — желтый и неустойчивый.
Из кислот, в каких растворяется золото, есть еще горячая концентрированная селеновая кислота. В результате также образуется соль — селенат золота красно-желтого цвета.
🎬 Видео
Химия. 8 класс. Реакции металлов с водой /16.10.2020/Скачать

Золото - САМЫЙ СТОЙКИЙ МЕТАЛЛ НА ЗЕМЛЕ!Скачать

25. Схема реакции и химическое уравнениеСкачать

ПРИЗЫВ Х10 // ПРИНЦ ЗИГФРИД И ДЕВА-ЛЕБЕДЬ НОВЫЕ ГЕРОИ // ОБЗОР // Empires Puzzles // SUMMONSСкачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Кислотный оксид + вода = ??? Основной оксид + вода = ???Скачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Рубидий - металл, который дороже золота.Скачать

Взаимодействие воды с оксидамиСкачать