Читайте в этой статье:
Оксид золота — это химическое соединение, в котором задействованы кислород и золото. Как известно, Au относят к благородным металлам, элемент характеризуется таким образом потому, что он не вступает в контакт с реагентами. Кислород, вода, кислоты и щелочи никаким образом не способны навредить золоту и еще шести металлам платиновой группы. Так как же получить химическое соединение кислорода с золотом, если металл инертен?
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Оксиды и их свойства
Оксид золота в природе не образуется, элементы, с которыми соединяется этот металл, можно пересчитать по пальцам. Их крайне мало. Если говорить о чистом золоте, то кислород его не разрушает, то же самое можно сказать о воде и большом количестве других реагентов.

Золото окисляется только при взаимодействии со следующими элементами:
- ртутью;
- смесью соляной и азотной кислот;
- селеновой кислотой;
- хлором и бромом.
Если говорить о ртути, то при взаимодействии элементов образуется сплав, который химики называют амальгамой.
Смесь азотной и соляной кислот в пропорции 1 к 3 называют царской водкой, при погружении в эту смесь металл начинает растворяться. При повышении температуры реакция ускоряется.
Селеновая кислота в высокой концентрации способна окислить золота, подобная технология применяется только в промышленности, для извлечения благородного элемента из породы.
Хлор и бром могут взаимодействовать с Au, присутствие хлора в реакции ускоряет процесс. По этой причине не рекомендуется надевать золотые украшения во время уборки, им может быть нанесен вред.
Оксид золота имеет несколько разновидностей, также существует и гидроксид, который является смесью золота, кислорода и водорода. Если говорить проще, это смесь воды и благородного металла. Но поскольку металл инертен, получить такую смесь не так просто.
Чистое золото окисляться может только при определенных обстоятельствах. Для этого необходимо поддержание температурного режима и соблюдение условий.
Оксид золота бывает всего двух разновидностей, определить, о каком именно химическом элементе идет речь, можно при помощи обозначения. Химики дополняют название веществ римскими цифрами I и III.
Элемент представляет собой неорганическое соединение, окись металла и кислорода, рассматривается как соль аурат или окисел смешанного типа. Представляет собой порошок коричневого цвета.
Окись золота можно получить несколькими способами, но в реакции обязательно должен участвовать кислород.
Соединение воды и Au под номером I получают путем нагревания элемента с аналогичным названием, но под номером III. А для получения оксида понадобится гидроксид, то есть соединение металла с водой.

- имеет химическую формулу Au2O3;
- отличается устойчивостью;
- получают путем обезвоживания при нагревании;
- элемент аморфен;
- имеет красный или бурый оттенок.
Реакция проходит в ампуле из кварца, которая на одну треть должна быть заполнена хлорной кислотой, при температуре в 200 градусов. Из соединения путем повышения температуры испаряют воду, в результате получают порошок красного или бурого оттенка. Бурый оттенок свидетельствует или о низком качестве металла, или его небольшом содержании.
При повышении температуры можно получить кристаллы, которые будут иметь рубиновый оттенок. Показатели должны быть примерно 240–270 градусов.
Можно характеризовать соединение под номером III следующими свойствами:
- Не растворяется в воде.
- Плотность элемента составляет 10,38 г на куб. см.
- Если нагреть элемент до 300 градусов, то пойдет реакция с полным разложением.
- Растворяется в щелочах, но реакция идет медленно.
Кристаллы соединяются друг с другом по типу мостика, то есть одна молекула цепляет две, две молекулы цепляют три и таким образом — по восходящей.
Можно заметить, что оксид имеет определенное сходство с металлом, например, элемент так же ускоренно растворяется в соляной и азотной кислотах.
Что может элемент под номером I и какими обладает свойствами:
- имеет химическую формулу Au2O (две молекулы золота присоединяют одну молекулу кислорода);
- выглядит как порошок синего цвета;
- соединение неустойчивое;
- может находиться в виде гидрозоля.
Получают элемент при нагревании, для проведения реакции понадобятся гидроксид калия и хлорид золота.
Соединение быстро возвращается в первоначальное состояние, по этой причине элемент рассматривают как порошок, который может иметь фиолетовый оттенок. При повышении температуры соединение разлагается.
Если добавить в соединение гидроксид аммония, или, говоря проще, нашатырь, то в процессе реакции образуется осадок черного цвета. При силовом воздействии (от удара) соединение может взорваться.
Соединение с химической формулой 3Au2O·4NH3, не отличается устойчивостью, распадается в горячей воде, не образует осадка.
Видео:Реакции металлов с кислородом и водой. 8 класс.Скачать

Почему происходит окисление?
Окисление может происходить по нескольким причинам; если говорить об обычных металлах, то они взаимодействуют с кислородом и водой, также на элементы могут воздействовать реагенты: щелочи и кислоты. Если реакция проходит в лабораторных условиях, то реагенты используют с определенной целью. В домашних условиях столкнуться со щелочами и кислотами можно при выполнении работ по дому, поскольку большое количество средств для уборки состоит из химических соединений, в состав которых входят либо щелочи, либо кислоты.
Если говорить о чистом золоте и металлах платиновой группы, то они к окислению несвойственны, подобная реакция возможна только в условиях лабораторий с использованием определенных реагентов, которых не так много.
Золото в украшениях может окисляться по причине того, что в состав изделий входят и другие материалы. Сплав готовят из нескольких элементов, разбавляя благородный металл латунью, никелем или медью. Эти элементы не столь устойчивы к факторам внешней среды и реагентам, из-за чего на поверхности драгоценностей и образуется налет. По этой причине стоит беречь украшения и правильно ухаживать за ними. Чем больше в сплаве лигатуры и других примесей помимо золота, тем сильнее оно подвержено коррозии.
Учитывая все свойства золота и характеристики, получение оксида этого металла — это трудоемкий процесс, провести который можно только в лабораторных условиях. Провести процедуру дома, без наличия оснащения невозможно.
Не так давно ученым удалось исполнить мечту всех алхимиков и получить Au из ртути, соединение получилось устойчивым. Но искусственный металл и его производство было признано неперспективным.
Возможно, в скором времени, химики удивят еще чем-нибудь и научатся добывать или синтезировать благородный металл в промышленном масштабе.
Видео:Химия. 8 класс. Реакции металлов с кислородом /09.10.2020/Скачать

Золото (Au)
Золото является одним из самых «необычных» металлов, известных человеку с давних пор — наши предки использовали золото по большей части в культурно-религиозных целях, а также в качестве одного из самых надежных платежных средств.
Золото в природе встречается в подавляющем большинстве случаев в виде самородков. С некоторыми металлами золото может образовывать природные твердые растворы:
- электрум — серебристое золото;
- аурокуприд — меднистое золото;
- платинистое золото.
В виде соединений золото в природе встречается гораздо реже (калагерит AuTe2, ауростибит AuSb2). Достаточно много золота содержится в морской воде, но добыча такого золота нерентабельна.
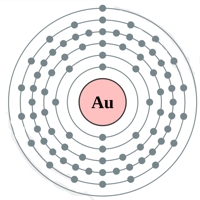
Рис. Строение атома золота.
Электронная конфигурация атома золота — 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 14 5s 2 5p 6 5d 10 6s 1 (см. Электронная структура атомов). Золото является одним из самых малоактивных химических элементов — оно не окисляется на воздухе даже в присутствии влаги, не взаимодействует непосредственно с кислородом, водородом, азотом, углеродом, фосфором.
Физические свойства золота:
- золотисто-желтый металл;
- очень пластичный и мягкий — можно раскатать в прозрачную фольгу толщиной несколько микрон (сусальное золото), которой покрывать разнообразные художественные и религиозные изделия (производить золочение), придавая им эстетический привлекательный вид, который сохраняется длительное время;
- обладает хорошей электро- и теплопроводностью.
Химические свойства золота:
- реагирует с галогенами при нагревании: 2Au + 3Cl2 = 2AuCl3;
- не растворяется в щелочных и кислотных растворах;
- растворяется в смесях кислот: HCl+HNO3 (царской водке) и H2SO4+HNO3: Au + 3HNO3 + 3HCl = AuCl3 + 3NO2 + 3H2O;
- металлическое золото переходит в раствор в виде комплексной соли в водных растворах цианида калия и натрия в присутствии окислителей: 4Au + 8KCN + 2H2O + O2 = 4K[Au(CN)2] + 4KOH;
- легко растворяется в ртути с образованием сплава (амальгамы).
Кислородные соединения золота при незначительном нагревании легко разлагаются со взрывом, например, гремучее золото взрывается при 145°C.
Соединения золота достаточно легко гидролизуются и восстанавливаются до свободного металла в водных растворах, поскольку являются неустойчивыми соединениями: при нагревании гидроксид золота (III) дегидратируется образуя оксид золота (III), который, в свою очередь, распадается с образованием свободного золота при 160°C: 4Au(OH)3 → 2Au2O3 → 4Au + 3O2.
Гидроксид и оксид золота (III) — амфотерные соединения, реагируют с кислотами и основаниями, образуя комплексные соединения:
Применение золота:
- в ювелирном деле;
- как международное платежное средство;
- в электротехнике для золочения контактов;
- для нанесения покрытий на металлические поверхности;
- в медицине для изготовления инструментов и протезов;
- как катализатор при проведении некоторых реакций в химической промышленности;
- радиоактивный изотоп золота применяют в онкологии для лечения новообразований.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Видео:Типы химических реакций. 1 часть. 8 класс.Скачать

Химия золота
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Что такое химия золота

HNO3 + 3HCl → NOCl + Cl2 + 2H2O
Нитрозилхлорид и хлор образуют два активных компонента растворяют золото :
Au + NOCl2 + Cl2 → AuCl3 + 2H2O
Данная реакция протекает уже при комнатной температуре и может не требовать дополнительного нагрева в зависимости от измельченности золота .
Из за большого содержания хлора и соляной кислоты хлорид золота три присоединяет молекулу хлора образуя тетрахлороаурат (III) водорода или тетрахлорозолотую кислоту .
AuCl3 + HCl → H(AuCl4)
В результате получается крупный легко фильтрующий жёлтый порошок .
А если эта кислота растворяет царь золото то её назвали в честь растворения золота царской водкой .
Восстановление золота из хлоридов осуществляется путем взаимодействия тетрахлороаурат (III) водорода с сульфатом железа ( II ) FeSO4 , сернистый газ SO2 , гидразин N2H4 :
AuCl4 + N2H4 → Au + N2 + HCl
2AuCl4 + FeSO4 → 2Au + 3Fe2SO4 + Cl2
AuCl4 + 3SO2 + 6H2O → 2Au + 3SO4 + 8Cl + 12H
Даже перекись водорода в реакции по восстановлению золота ведёт себя как восстановитель :
2AuCl4 + 3H2O2 → 2Au + 8Cl + 6H + 3O2
Взаимодействие чистого углерода с хлоридом золота так же приводит в восстановлению золота :
4[AuCl4] + 3C + 6H2O → 4Au + 3CO2+ 16Cl2 + 12H
Восстановление золота можно проводить и с помощью хлорида олова SnCl2 зачастую эту реакцию используют в качестве качественной реакции на золото в зависимости от кислотности раствора он окрашивается в красный пурпурный цвет , а если кислотность большая цвет окрашивается в тёмные цвета .
Также как качественная реакция по определению золота может быть использована взаимодействие золотохлористводородной кислоты с раствором йодида калия :
AuCl4 + KI → AuI3 + 4Cl
Который осядет в виде нерастворимого тёмно зелёного осадка который в свою очередь может восстановлен в золото с помощью простого нагревания , процесс восстановления начинает протекать уже при 177 градусах :
Так же обратная реакция может быть использована для окисления золота йодом :
Реакция с бромом протекает при комнатной температуре с образованием бромида золота три :
2Au + 3Br2 → Au2Br6
Данный материал используют как катализатор в некоторых химических органических реакциях Для восстановления золота из бромидов нужно нагреть бромид золота три , что приведёт к частичному восстановлению золота . При дальнейшем нагревании бромида золота (I) при температуре свыше 250 градусов приведёт к полной потере брома и полное восстановление золота
AuBr + t → Au + Br
Помимо царской водки которая растворяет золото на основе хлора , нашло широкое применение прямого действия на золото газообразного хлора Cl реакция лежит на основе гидрохлорирования и переменятся для извлечения золота из переработанных радиодеталей .
2Au + 3Cl2 + 2HCl → 2HAuCl4
Недостаток данной реакции в том , что материалы реакции нужно нагревать до температуры не менее чем 200°C , что затрудняет и так опасное получение золота .
Также в этой реакции можно использовать хлорную воду которую получают взаимодействием хлора с водой :
Cl2 + H2O → HClO + HCl
Au + HClO + HCl → H(AuCl4)
Из кислот составляющий одно наименование растворяет золото только селеновая кислота H2SeO3 реакция протекает при температуре 200°C .
2Au + 6H2SeO4 →Au2(SeO3)3 + 3H2SeO3 + 3H2O
в результате чего получаться раствор красно — жёлтого цвета селената золота (III) который не растворим при обычных условиях в воде , но растворим в серной H2SO4 и азотной кислоте HNO3 . А вот соляная кислота HCl приводит к его разрушению .
Самое известное применение по окислению золота после царской водки можно отдать цианированию , оно основано в взаимодействии кислорода воздуха или других окислителей в присутствии цианидов . В качестве цианидов используют соли калия или натрия , другими словами всеми известный цианистый калий , по мимо солей можно использовать и цианистую кислоту ( синильная кислота ) но из за большой ядовитости не используется . Эту реакцию цианирования золота применяют для получения золота из руды с малым содержанием благородного металла .
4Au + 8NaCN + 2H2O → 4Na[Au(CN)2] + 4NaOH
Восстановление из цианоауратов производиться с помощью мелкого цинка :
2Na[Au(CN)2] + Zn → Na2[Zn(CN)4] + 2Au
Со фтором F благородный металл реагирует с образованием фторидов золота , но данная реакция не устойчивая и заканчивается тем что материал просто разлагается на производные фтор и золото . Интервал температуры при которой реакция ведёт стабильно от 300 до 400 градусов :
В недавнем прошлом золото добывали с довольно известным способом амальгамацией , её с начало приписывали к алхимии как получение золота из ртути после возгонки и нагревания некоторых руд . В последствии стало известно , что ртуть вступает в природный сплав с золотом уже при комнатной температуре , а нагревание разлагает на простые компоненты золото и ртуть :
AuHg + t → Au + Hg
Единственное , что нужно было сделать это провести рафинирование золота с последующим электрохимическим восстановлением , что приведёт к получению золота 999, 9 пробы.
Статья на тему химия золота
Похожие страницы:
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
📹 Видео
Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Реакция металлов с кислородом и водойСкачать

Поджигаем спичку марганцовкой и перекисью водорода #shortsСкачать

Взаимодействие металлов с кислотами. 8 класс.Скачать

Золото - САМЫЙ СТОЙКИЙ МЕТАЛЛ НА ЗЕМЛЕ!Скачать

8 класс. Составление уравнений химических реакций.Скачать

Химия 8 класс (Урок№11 - Кислород: получение, физические и химические свойства,применение. Оксиды.)Скачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Рубидий - металл, который дороже золота.Скачать

РТУТЬ, ОСТОРОЖНО!Скачать

Растворение золота в "царской водке". НигмаСкачать

Трансмутация - получение золота из меди.Скачать

Ядерная алхимия: как получить искусственное золото?Скачать

Химическая реакция йода и алюминия.Скачать
