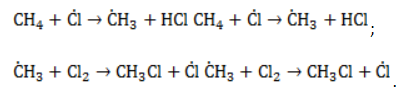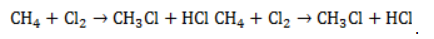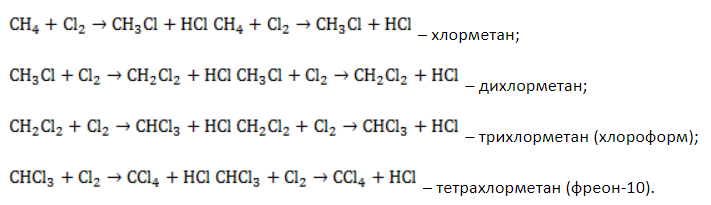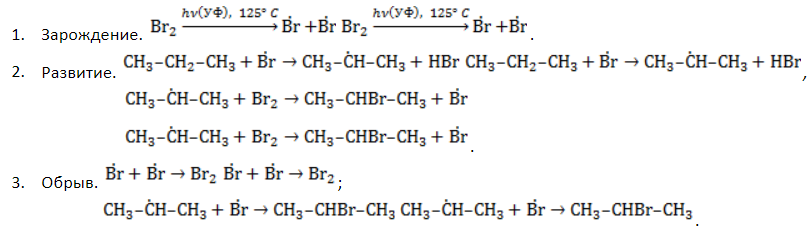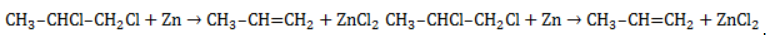Галогенирование – процесс присоединения к молекуле органического соединения атома галогена – это одно из химических взаимодействий, в которых участвуют углеводороды ряда алканов. Благодаря общности структуры молекул у всех членов гомологического ряда реакции с галогеном обладают единым характером. При этом галогенирование пропана и следующих за ним в гомологическом ряду соединений имеет особенности, связанные с наличием в молекулах вторичных, третичных и четвертичных атомов углерода.
- Краткая характеристика алканов
- Галогенирование алканов
- Стадии галогенирования
- Региоселективность
- Хлорирование и бромирование пропана
- Галогенирование бутана
- Реакция отщепления
- Применение галогеналканов
- Галогены. Химия галогенов и их соединений
- Галогены
- Положение в периодической системе химических элементов
- Электронное строение галогенов
- Физические свойства и закономерности изменения свойств
- Соединения галогенов
- Способы получения галогенов
- Химические свойства галогенов
- Галогеноводороды
- Строение молекулы и физические свойства
- Способы получения галогеноводородов
- Химические свойства галогеноводородов
- Галогениды металлов
- Способы получения галогенидов
- Химические свойства галогенидов
- Кислородсодержащие кислоты галогенов
- Хлорноватистая кислота и ее соли
- Хлористая кислота и ее соли
- Хлорноватая кислота и ее соли
- Хлорная кислота и ее соли
- 2.3.1. Химические свойства водорода и галогенов.
- Химические свойства водорода
- Взаимодействие водорода с простыми веществами
- Взаимодействие водорода со сложными веществами
- Химические свойства галогенов
- Взаимодействие галогенов с простыми веществами
- Взаимодействие галогенов с неметаллами
- Взаимодействие галогенов с металлами
- Реакции галогенов со сложными веществами
- Реакции замещения с галогенами
- Взаимодействие галогенов с водой
- Взаимодействие галогенов с растворами щелочей
- 💥 Видео
Видео:Галогенирование алкановСкачать

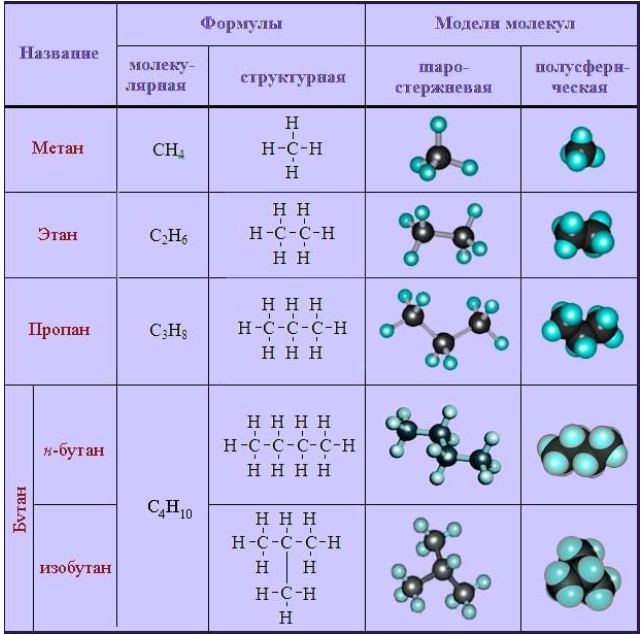
Краткая характеристика алканов
К простейшим органическим соединениям относятся ациклические насыщенные, или предельные углеводороды (алканы). Их отличают следующие структурные особенности:
- неразветвленные (прямые) или разветвленные молекулы, не содержащие циклических образований;
- все химические связи в молекуле – одинарные.
Общая формула имеет вид 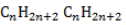
Механизм замещения у алканов носит радикальный характер, так как разрыв слабополярной связи C-H протекает с образованием пары свободных радикалов – нейтральных частиц, имеющих по одному неспаренному электрону. Атом водорода может замещаться галогеном, нитрогруппой или сульфогруппой.
Видео:Реакции замещенияСкачать

Галогенирование алканов
Реакция свободно-радикального замещения (обозначается символом SR – от англ. substitution radical reaction) водородного атома в молекуле алкана атомом галогена называется галогенированием. Ее инициирование требует воздействия ультрафиолетового облучения или повышенной температуры. Реакция носит цепной характер, так как в каждом ее акте образуются свободные радикалы, генерирующие следующий акт.
Замещение фтором – фторирование – чрезвычайно экзотермический процесс, сопровождающийся взрывом и разрушением молекулы алкана. Реакция с участием йода, наоборот, является эндотермической и обратимой – в ходе ее происходит восстановление продукта реакции йодоводородом, поэтому прямое йодирование неэффективно. Практический интерес представляют реакции алканов с хлором и бромом.
Стадии галогенирования
Удобнее всего рассмотреть, какой механизм имеет реакция хлорирования алканов, на примере метана. При облучении или нагреве реакционной смеси реакция инициируется, и далее цепная реакция протекает в несколько стадий.
- Зарождение цепи – распад молекулы хлора на активные радикалы:
- Развитие цепи. Взаимодействуя с молекулой метана
, радикал
отщепляет от нее атом водорода с образованием метил-радикала
, который, в свою очередь, расщепляет другую молекулу хлора. Эти элементарные акты повторяются многократно, образуя новые радикалы и развивая цепную реакцию:
- Обрыв цепи. Цепной процесс прекращается, когда радикалы реагируют между собой:
В общем виде уравнение галогенирования метана хлором записывается в форме:
Процесс замещения не ограничивается образованием хлорметана, на молекулы которого также воздействуют радикалы 
Выход продуктов зависит от мольного соотношения реагентов и условий реакции. Так, при эквимолярном количестве метана и хлора и температуре 440° C соотношение молярных долей продуктов в процентах составляет около 39:41:19:1.
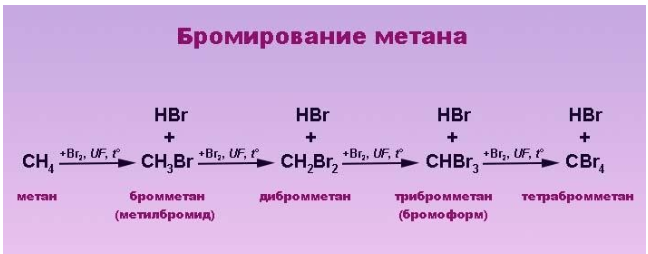
Реакция бромирования отличается меньшим выделением энергии и протекает медленнее, так как его реакционная способность ниже, чем у хлора.
Видео:Галогены: фтор, хлор, бром и иод | Химические свойства #галогены #химия #видеоурок #егэхимияСкачать

Региоселективность
Начиная с пропана 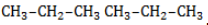
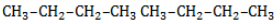
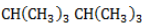
Селективность зависит от следующих факторов:
- Активность реагента. Чем активнее галоген, тем слабее проявляется избирательность при замещении водорода. Так, при взаимодействии алкана с хлором региоселективность значительно меньше, чем в реакциях с бромом, или не наблюдается.
- Температура. Нагревание ведет к снижению селективности.
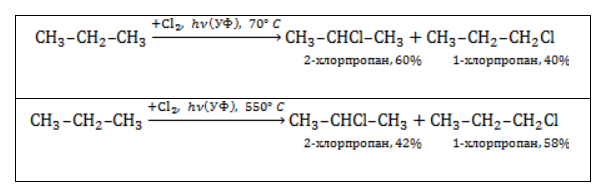
Хлорирование и бромирование пропана
В реакции пропана с хлором при низкой температуре селективная направленность выражена слабо. Несмотря на то, что образующиеся в ходе реакции радикалы 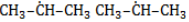
При нагревании радикалы хлора атакуют первичные атомы даже более активно, так как на разрыв их связи с водородом затрачивается меньше энергии.
При бромировании пропана региоселективность вследствие меньшей активности брома достигает высоких значений:
Бромирование протекает аналогично реакции с участием простейших алканов с преимущественным замещением водорода у вторичных атомов:
Продуктом этой реакции является 2-бромпропан.
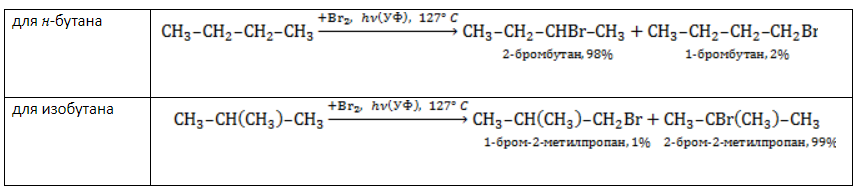
Галогенирование бутана
В реакциях бутана с хлором селективность не играет заметной роли. Даже при низкой температуре соотношение продуктов хлорирования может быть различным:
Бромирование бутана демонстрирует большую селективность:
Видео:Химия 9 класс (Урок№10 - Галогены. Хлор. Хлороводород. Соляная кислота и её соли.)Скачать

Реакция отщепления
Активные двухвалентные металлы (как правило, магний или цинк) отщепляют от молекул дигалогеналканов атомы хлора или брома, если они замещают водород у двух соседних атомов углерода. Между последними образуется двойная связь. Продуктом такой реакции является алкен.
Пример реакции дегалогенирования алканов – отщепление цинком атомов хлора от 1,2-дихлорпропана с образованием пропилена (пропена) и хлорида цинка:
Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Применение галогеналканов
Хлорированные и бромированные алканы применяются в качестве промежуточных соединений в различных отраслях, таких как синтез высокомолекулярных соединений, производство лаков, красок и растворителей. Хлоралканы служат сырьем для фторалканов, которые нельзя получить прямым фторированием.
Токсичность галогеналканов тем меньше, чем активнее входящий в их состав галоген. Поэтому фторалканы наиболее безопасны. Фторсодержащие фреоны широко используются в качестве вспенивателей, хладагентов и пропеллентов.
Видео:Алканы. Химические свойства. Ч.1. Реакции радикального замещения.Скачать

Галогены. Химия галогенов и их соединений
Галогены
Положение в периодической системе химических элементов
Галогены расположены в главной подгруппе VII группы (или в 17 группе в современной форме ПСХЭ) периодической системы химических элементов Д.И. Менделеева.
Электронное строение галогенов
Электронная конфигурация галогенов в основном состоянии соответствует формуле ns 2 np 5 .
Например , электронная конфигурация фтора :
Электронная концигурация хлора :
Атомы галогенов содержат на внешнем энергетическом уровне 1 неспаренный электрон и три неподеленные электронные пары в основном энергетическом состоянии. Следовательно, в основном состоянии атомы галогенов могут образовывать 1 связи по обменному механизму.
При этом у фтора возбужденного состояния нет, т.е. максимальная валентность фтора в соединения равна I.
Однако, в отличие от фтора, за счет вакантной d-орбитали атомы хлора, брома и йода могут переходить в возбужденное энергетическое состояние.
Таким образом, максимальная валентность галогенов (кроме фтора) в соединениях равна VII. Также для галогенов характерны валентности I, III, V.
Степени окисления атома галогенов – от -1 до +7. Характерные степени окисления -1, 0, +1, +3, +5, +7. Для фтора характерная степень окисления -1 и валентность I.
Физические свойства и закономерности изменения свойств
Галогены образуют двухатомные молекулы состава Hal2. В твёрдом состоянии имеют молекулярную кристаллическую решетку. Плохо растворимы в воде, все имеют запах, летучи.
| Галоген | F | Cl | Br | I |
| Электронная формула | … 2s 2 2p 5 | … 3s 2 3p 5 | … 4s 2 4p 5 | … 5s 2 5p 5 |
| Электроотрицательность | 4,0 | 3,0 | 2,8 | 2,5 |
| Степени окисления | -1 | -1, +1, +3, +5, +7 | -1, +1, +3, +5, +7 | -1, +1, +3, +5, +7 |
| Агрегатное состояние | Газ | Газ | Жидкость | Твердые кристаллы |
| Цвет | Светло-желтый | Жёлто-зелёный | Буровато-коричневый | Тёмно-серый с металлическим блеском |
| Запах | Резкий | Резкий, удушливый | Резкий, зловонный | Резкий |
| T плавления | –220 о С | –101 о С | –7 о С | 113,5 о С |
| Т кипения | –188 о С | –34 о С | 58 о С | 185 о С |
Внешний вид галогенов:
Фтор
Хлор
Бром
Йод
В природе галогены встречаются в виде соединений, в основном, в виде галогенидов.
Соединения галогенов
Типичные соединения хлора:
| Степень окисления | Типичные соединения |
| +7 | Хлорная кислота HClO4 Перхлораты MeClO4 |
| +5 | Хлорноватая кислота HClO3 Хлораты MeClO3 |
| +3 | Хлористая кислота HClO2 |
| +1 | Хлорноватистая кислота HClO Гипохлориты MeClO |
| –1 | Хлороводород HCl, Хлориды MeCl |
Бром и йод образуют подобные соединения.
Способы получения галогенов
1. Получение хлора.
В промышленности хлор получают электролизом расплава или раствора хлорида натрия.
Электролиз расплава хлорида натрия.
В расплаве хлорид натрия диссоциирует на ионы:
NaCl → Na + + Cl −
На катоде восстанавливаются ионы натрия:
K(–): Na + +1e → Na 0
На аноде окисляются ионы хлора:
A(+): 2Cl − ̶ 2e → Cl2 0
Ионное уравнение электролиза расплава хлорида натрия:
2Na + + 2Cl − → 2Na º + Cl2º
Суммарное уравнение электролиза расплава хлорида натрия:
2NaCl → 2Na + Cl2
Электролиз раствора хлорида натрия.
В растворе хлорид натрия диссоциирует на ионы:
NaCl → Na + + Cl −
На катоде восстанавливаются молекулы воды:
K(–): 2H2O + 2e → H2° + 2OH −
На аноде окисляются ионы хлора:
A(+): 2Cl − ̶ 2e → Cl2 0
Ионное уравнение электролиза раствора хлорида натрия:
Суммарное уравнение электролиза раствора хлорида натрия:
2NaCl + 2H2O → H2↑ + 2NaOH + Cl2↑
В лаборатории хлор получают взаимодействием концентрированной соляной кислоты с сильными окислителями.
Например , взаимодействием соляной кислоты с оксидом марганца (IV)
Или перманганатом калия:
2KMnO4 + 16HCl → 2MnCl2 + 2KCl + 5Cl2↑ + 8H2O
Бертолетова соль также окисляет соляную кислоту:
KClO3 + 6HCl → KCl + 3Cl2↑ + 3H2O
Бихромат калия окисляет соляную кислоту:
2. Получение фтора.
Фтор получают электролизом расплава гидрофторида калия.
3. Получение брома.
Бром можно получить окислением ионов Br – сильными окислителями.
Например , бромоводород окисляется хлором:
2HBr + Cl2 → Br2 + 2HCl
Соединения марганца также окисляют бромид-ионы.
Например , оксид марганца (IV):
4. Получение йода.
Йод получают окислением ионов I – сильными окислителями.
Например , хлор окисляет йодид калия:
2KI + Cl2 → I2 + 2KCl
Соединения марганца также окисляют йодид-ионы.
Например , оксид марганца (IV) в кислой среде окисляет йодид калия:
Химические свойства галогенов
Химическая активность галогенов увеличивается снизу вверх – от астата к фтору.
1. Галогены проявляют свойства окислителей . Галогены реагируют с металлами и неметаллами .
1.1. Галогены не горят на воздухе. Фтор окисляет кислород с образованием фторида кислорода:
1.2. При взаимодействии галогенов с серой образуются галогениды серы:
1.3. При взаимодействии фосфора и углерода с галогенами образуются галогениды фосфора и углерода:
1.4. При взаимодействии с металлами галогены проявляют свойства окислителей, образуя галогениды.
Например , железо реагирует с галогенами с образованием галогенидов. При этом фтор, хлор и бром образуются галогениды железа (III), а c йодом — соединение железа (II):
3Cl2 + 2Fe → 2FeCl3
Аналогичная ситуация с медью : фтор, хлор и бром окисляют медь до галогенидов меди (II),а йод до йодида меди (I):
I2 + 2Cu → 2CuI
Активные металлы бурно реагируют с галогенами, особенно с фтором и хлором (горят в атмосфере фтора или хлора).
Еще пример : алюминий взаимодействует с хлором с образованием хлорида алюминия:
3Cl2 + 2Al → 2AlCl3
1.5. Водород горит в атмосфере фтора:
С хлором водород реагирует только при нагревании или освещении. При этом реакция протекает со взрывом:
Бром также реагирует с водородом с образованием бромоводорода:
Взаимодействие йода с водородом происходит только при сильном нагревании, реакция протекает обратимо, с поглощением теплоты (эндотермическая):
1.6. Галогены реагируют с галогенами. Более активные галогены окисляют менее активные.
Например , фтор окисляет хлор, бром и йод:
2. Со сложными веществами галогены реагируют, также проявляя преимущественно окислительные свойства. Галогены охотно диспропорционируют при растворении в воде или в щелочах.
2.1. При растворении в воде хлор и бром частично диспропорционируют, повышая и понижая степень окисления. Фтор окисляет воду.
Например , хлор при растворении в холодной воде диспропорционирует до ближайших стабильных степеней окисления (+1 и -1), образует при этом соляную кислоту и хлорноватистую кислоту (хлорная вода):
Cl2 + H2O ↔ HCl + HClO
При растворении в горячей воде хлор диспропорционирует до степеней окисления -1 и +5, образуя соляную кислоту и хлороватую кислоту:
Фтор реагирует с водой со взрывом:
2.2. При растворении в щелочах хлор, бром и йод диспропорционируют с образованием различных солей. Фтор окисляет щелочи.
Например , хлор реагирует с холодным раствором гидроксидом натрия:
При взаимодействии с горячим раствором гидроксида натрия образуются хлорид и хлорат:
Еще пример : хлор растворяется в холодном растворе гидроксида кальция:
2.3. Более активные галогены вытесняют менее активные галогены из солей и галогеноводородов.
Например , хлор вытесняет йод и бром из раствора йодида калия и бромида калия соответственно:
Cl2 + 2NaI → 2NaCl + I2
Cl2 + 2NaBr → 2NaCl + Br2
Еще одно свойство: более активные галогены окисляют менее активные.
Например , фтор окисляет хлор с образованием фторида хлора (I):
Cl2 + F2 → 2Cl + F –
В свою очередь, хлор окисляет йод. При этом в растворе образуется соляная кислота и йодная кислота:
2.4. Галогены проявляют окислительные свойства, взаимодействуют с восстановителями.
Например , хлор окисляет сероводород:
Cl2 + H2S → S + 2HCl
Хлор также окисляет сульфиты:
Также галогены окисляют пероксиды:
Или, при нагревании или на свету, воду:
2Cl2 + 2H2O → 4HCl + O2 (на свету или кип.)
Галогеноводороды
Строение молекулы и физические свойства
Галогеноводороды HHal – это бинарные соединения водорода с галогенами, которые относятся к летучим водородным соединениям. Галогеноводороды – бесцветные ядовитый газы, с резким запахом, хорошо растворимые в воде.
В ряду HCl – HBr – HI увеличивается длина связи и ковалентности связи уменьшается полярность связи H – Hal.
Растворы галогеноводородов в воде (за исключением фтороводорода) – сильные кислоты. Водный раствор фтороводорода – слабая кислота.
Способы получения галогеноводородов
В лаборатории галогеноводороды получают действием нелетучих кислот на хлориды металлов.
Например , действием концентрированной серной кислоты на хлорид натрия:
Галогеноводороды получают также прямым взаимодействием простых веществ:
Химические свойства галогеноводородов
1. В водном растворе галогеноводороды проявляют кислотные свойства . Взаимодействуют с основаниями, основными оксидами, амфотерными гидроксидами, амфотерными оксидами . Кислотные свойства в ряду HF – HCl – HBr – HI возрастают.
Например , хлороводород реагирует с оксидом кальция, оксидом алюминия, гидроксидом натрия, гидроксидом меди (II), гидроксидом цинка (II), аммиаком:
2HCl + CaO → CaCl2 + H2O
HCl + NaOH → NaCl + H2O
Как типичные минеральные кислоты, водные растворы галогеноводородов реагируют с металлами , расположенными в ряду активности металлов до водорода. При этом образуются соль металла и водород.
Например , соляная кислота растворяет железо. При этом образуется водород и хлорид железа (II):
Fe + 2HCl → FeCl2 + H2
2. В водном растворе галогеноводороды диссоциируют , образуя кислоты. Водный раствор фтороводорода (плавиковая кислота) – слабая кислота:
HF ↔ H + + F –
Водные растворы хлороводорода (соляная кислота), бромоводорода и йодоводорода – сильные кислоты, в разбавленном растворе диссоциируют практически полностью:
HCl ↔ H + + Cl –
3. Водные растворы галогеноводородов взаимодействуют с солями более слабых кислот и с некоторыми растворимыми солями (если образуется газ, осадок, вода или слабый электролит).
Например , соляная кислота реагирует с карбонатом кальция:
Качественная реакция на галогенид-ионы – взаимодействие с растворимыми солями серебра.
При взаимодействии соляной кислоты с нитратом серебра (I) образуется белый осадок хлорида серебра:
HCl + AgNO3 = AgCl↓ + HNO3
Осадок бромида серебра – бледно-желтого цвета:
HBr + AgNO3 = AgBr↓ + HNO3
Осадок иодида серебра – желтого цвета:
HI + AgNO3 = AgI↓ + HNO3
Фторид серебра – растворимая соль, поэтому реакция плавиковой кислоты и ее солей с нитратом серебра не является качественной.
Видеоопыты качественных реакций на хлорид-, бромид- и йодид-ионы (взаимодействие с нитратом серебра) можно посмотреть здесь.
4. Восстановительные свойства галогеноводородов усиливаются в ряду HF – HCl – HBr – HI.
Галогеноводороды реагируют с галогенами . При этом более активные галогены вытесняют менее активные.
Например , бром вытесняет йод из йодоводорода:
Br2 + 2HI → I2 + 2HBr
А вот хлор не может вытеснить фтор из фтороводорода.
Фтороводород практически невозможно окислить.
Концентрированная соляная кислота окисляется соединениями марганца с валетностью выше II или соединениями хрома (VI).
Например : концентрированная соляная кислота окисляется оксидом марганца (IV):
Бромоводород – сильный восстановитель и окисляется соединениями марганца, хрома (VI), концентрированной серной кислотой и другими сильными окислителями:
Например , бромоводород окисляется концентрированной серной кислотой:
Бромоводород реагирует с бихроматом калия с образованием молекулярного брома:
Или с оксидом марганца (IV):
Пероксид водорода также окисляет бромоводород до молекулярного брома:
Йодоводород – еще более сильный восстановитель, и окисляется другими неметаллами и даже такими окислителями, как соединения железа (III) и соединения меди (II).
Например , йодоводород реагирует с хлоридом железа (III) с образованием молекулярного йода:
2HI + 2FeCl3 → I2 + 2FeCl2 + 2HCl
или с сульфатом железа (III):
Йодоводород легко окисляется соединениями азота, например , оксидом азота (IV):
или молекулярной серой при нагревании:
2HI + S → I2 + H2S
5. Плавиковая кислота реагирует с оксидом кремния (IV) (растворяет стекло):
Галогениды металлов
Галогениды – это бинарные соединения галогенов и металлов или некоторых неметаллов, соли галогеноводородов.
Способы получения галогенидов
1. Галогениды металлов получают при взаимодействии галогенов с металлами . При этом галогены проявляют свойства окислителя.
Например , хлор взаимодействует с магнием и кальцием:
При взаимодействии железа с хлором образуется хлорид железа (III):
3Cl2 + 2Fe → 2FeCl3
2. Галогениды металлов можно получить при взаимодействии металлов с галогеноводородами.
Например , соляная кислота реагирует с железом с образованием хлорида железа (II):
Fe + 2HCl → FeCl2 + H2
3. Галогениды металлов можно получить при взаимодействии основных и амфотерных оксидов с галогеноводородами.
Например , при взаимодействии оксида кальция и соляной кислоты:
2HCl + CaO → CaCl2 + H2O
Еще пример : взаимодействие оксида алюминия с соляной кислотой:
4. Галогениды металлов можно получить при взаимодействии оснований и амфотерных гидроксидов с галогеноводородами.
Например , при взаимодействии гидроксида натрия и соляной кислоты:
HCl + NaOH → NaCl + H2O
Или при взаимодействии гидроксида меди (II) с соляной кислотой:
Гидроксид цинка (II) также взаимодействует с соляной кислотой:
5. Некоторые соли взаимодействуют с галогеноводородами с образованием галогенидов металлов.
Например , гидрокарбонат натрия реагирует с бромоводородом с образованием бромида натрия:
HBr + NaHCO3 → NaBr + CO2↑ + H2O
Взаимодействие с нитратом серебра – качественная реакция на соляную кислоту, бромодоводород и йодоводород:
HCl + AgNO3 → AgCl↓ + HNO3
HBr + AgNO3 → AgBr↓ + HNO3
HI + AgNO3 → AgI↓ + HNO3
Химические свойства галогенидов
1. Растворимые галогениды вступают в обменные реакции с растворимыми солями, кислотами и основаниями , если образуется осадок, газ или вода.
Например , бромиды, йодиды и хлориды реагируют с нитратом серебра с образованием желтого, желтого и белого осадков соответственно.
NaCl + AgNO3 → AgCl↓ + NaNO3
Фторид серебра – растворимая соль, поэтому реакция фторидов с нитратом серебра не является качественной.
Видеоопыты качественных реакций на хлорид-, бромид- и йодид-ионы (взаимодействие с нитратом серебра) можно посмотреть здесь.
2. Галогениды тяжелых металлов реагируют с более активными металлами . При этом более активные металлы вытесняют менее активные.
Например , магний вытесняет медь из расплава хлорида меди (II):
Mg + CuCl2 → MgCl2 + Cu
Обратите внимание! В растворе более активные металлы вытесняют менее активные только если более активные металлы не взаимодействуют с водой (металлы, расположенные в ряду активности до магния). Если добавляемый металл слишком активен, то он провзаимодействует с водой, а не с солью.
Например , натрий не вытесняет цинк из раствора хлорида цинка. Т.к. натрий реагирует с водой, а реакция с хлоридом цинка не идет.
Na + ZnCl2(раствор) ≠
3. Галогениды подвергаются электролизу в растворе или расплаве. При этом на аноде образуются галогены.
Например , при электролизе расплава бромида калия на катоде образуется клий, а на аноде – бром:
2KBr → 2K + Br2
При электролизе раствора бромида калия на катоде выдялется водород, а на аноде также образуется бром:
4. Галогениды металлов проявляют восстановительные свойства . Хлориды окисляются только сильными окислителями, а вот йодиды уже являются очень сильными восстановителями. В целом, восстановительные свойства галогенидов аналогичны свойствам галогеноводородов.
Например , бромид калия окисляется концентрированной серной кислотой:
Еще пример : йодид калия окисляется соединениями меди (II) и соединениями железа (III):
4KI + 2CuCl2 → 2CuI↓ + I2↓ + 4KCl
2KI + 2FeCl3 → I2↓ + 2FeI2 + 2KCl
Еще несколько примеров восстановительных свойств галогенидов:
KI + 3H2O + 3Cl2 → HIO3 + KCl + 5HCl
Более активные галогены вытесняют менее активные из солей.
При этом галогениды металлов не горят в кислороде.
5. Нерастворимые галогениды металлов растворяются под действием избытка аммиака .
Например , хлорид серебра (I) растворяется под действием избытка раствора аммиака:
6. Нерастворимые галогениды под действием света разлагаются на галоген и металл.
Например , хлорид серебра разлагается под действием ультрафиолета:
2AgCl → 2Ag + Cl2
Кислородсодержащие кислоты галогенов
Рассмотрим кислородсодержащие кислоты галогенов на примере хлора:
| Степень окисления галогена | +1 | +3 | +5 | +7 |
| Формула | HClO | HClO2 | HClO3 | HClO4 |
| Название кислоты | Хлорноватистая | Хлористая | Хлорноватая | Хлорная |
| Устойчивость и сила | Существует только в растворах, слабая кислота | Существует только в растворах, слабая кислота | Существует только в растворах, сильная кислота | Сильная кислота |
| Название соответствующей соли | Гипохлориты | Хлориты | Хлораты | Перхлораты |
Хлорноватистая кислота и ее соли
Хлорноватистая кислота HClO устойчива только в разбавленном водном растворе.
Cпособ получения хлорноватистой кислоты:
1. Диспропорционирование хлора в холодной воде :
Cl2 + H2O ↔ HCl + HClO
Химические свойства хлорноватистой кислоты:
Хлорноватистая кислота HClO – это слабая кислота, но сильный окислитель.
1. Под действием ультрафиолета (на свету) хлорноватистая кислота разлагается :
2HClO → 2HCl + O2
2. Как кислота, хлорноватистая кислота реагирует с сильными основаниями .
Например , с гидроксидом калия:
HClO + KOH → KClO + H2O
3. Ярко выражены окислительные свойства хлорноватистой кислоты за счет атома хлора в степени окисления +1. При взаимодействии с восстановителями хлор, как правило, восстанавливается до степени окисления -1.
Например , хлорноватистая кислота окисляет йодоводород:
HClO + 2HI → HCl + I2 + H2O
Хлорноватистая кислота также окисляет, например , пероксид водорода:
4. Хлорноватистая кислота диспропорционирует:
3HClO → 2HCl + НСlO3
Химические свойства солей хлорноватистой кислоты (гипохлоритов):
1. Более сильные кислоты вытесняют гипохлориты из солей.
Например , соляная кислота реагирует с гипохлоритом натрия:
NaClO + 2HCl → NaCl + Cl2 + H2O
Серная кислота реагирует с гипохлоритом кальция при нагревании или под действием излучения:
Даже угольная кислота вытесняет гипохлориты:
2. Гипохлориты вступают в обменные реакции с другими солями , если образуется слабый электролит.
Например , гипохлорит кальция реагирует с растворимыми карбонатами:
3. При нагревании гипохлориты разлагаются :
Хлористая кислота и ее соли
Хлористая кислота HClO2 – существует только в водных растворах.
Способы получения:
Хлористую кислоту можно получить окислением оксида хлора пероксидом водорода:
Химические свойства хлористой кислоты:
1. Хлористая кислота является также слабой. Реагирует с щелочами с образованием хлоритов:
2. При длительном хранении разлагается:
Хлорноватая кислота и ее соли
Хлорноватая кислота HClO3 – также существует только в водных растворах.
Способы получения:
Хлорноватую кислоту можно получить из солей хлорноватой кислоты – хлоратов.
Например , из хлората бария под действием серной кислоты:
Химические свойства хлорноватой кислоты:
1. Хлорноватая кислота – сильная кислота. Реагирует с щелочами с образованием хлоратов:
2. Хлорноватая кислота – сильный окислитель.
Например , хлорноватая кислота окисляет фосфор:
Химические свойства солей хлорноватой кислоты – хлоратов:
1. Хлораты – сильные окислители.
Например , хлорат калия (бертолетова соль) при нагревании разлагается. При этом без катализатора хлорат диспропорционирует:
4KClO3 → 3KClO4 + KCl
В присутствии катализатора (оксид марганца (IV)) хлорат калия разлагается, окисляя кислород:
2KClO3 → 2KCl + 3O2↑
Еще пример : хлорат калия окисляет серу и фосфор:
2KClO3 + 3S → 2KCl + 3SO2
Хлорная кислота и ее соли
Хлорная кислота HClO4 – это бесцветная жидкость, хорошо растворимая в воде.
Способы получения:
Хлорную кислоту можно получить из солей хлорной кислоты – перхлоратов.
Например , из перхлората натрия под действием серной кислоты:
Химические свойства хлорной кислоты:
1. Хлорная кислота – сильная кислота. Реагирует с щелочами с образованием перхлоратов:
2. Хлорная кислота – сильный окислитель.
Например , хлорная кислота окисляет углерод:
3. При нагревании хлорная кислота разлагается:
Химические свойства солей хлорной кислоты – перхлоратов:
1. Перхлораты – сильные окислители.
Например , перхлорат калия при нагревании разлагается. При этом хлор окисляет кислород:
Еще пример : перхлорат калия окисляет алюминий:
Видео:Галогены (F, Cl, Br, I). Химические свойстваСкачать
2.3.1. Химические свойства водорода и галогенов.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Химические свойства водорода
Атом водорода имеет электронную формулу внешнего (и единственного) электронного уровня 1s 1 . С одной стороны, по наличию одного электрона на внешнем электронном уровне атом водорода похож на атомы щелочных металлов. Однако, ему, так же как и галогенам не хватает до заполнения внешнего электронного уровня всего одного электрона, поскольку на первом электронном уровне может располагаться не более 2-х электронов. Выходит, что водород можно поместить одновременно как в первую, так и в предпоследнюю (седьмую) группу таблицы Менделеева, что иногда и делается в различных вариантах периодической системы:
С точки зрения свойств водорода как простого вещества, он, все-таки, имеет больше общего с галогенами. Водород, также как и галогены, является неметаллом и образует аналогично им двухатомные молекулы (H2).
В обычных условиях водород представляет собой газообразное, малоактивное вещество. Невысокая активность водорода объясняется высокой прочностью связи между атомами водорода в молекуле, для разрыва которой требуется либо сильное нагревание, либо применение катализаторов, либо и то и другое одновременно.
Взаимодействие водорода с простыми веществами
с металлами
Из металлов водород реагирует только с щелочными и щелочноземельными! К щелочным металлам относятся металлы главной подгруппы I-й группы (Li, Na, K, Rb, Cs, Fr), а к щелочно-земельным — металлы главной подгруппы II-й группы, кроме бериллия и магния (Ca, Sr, Ba, Ra)
При взаимодействии с активными металлами водород проявляет окислительные свойства, т.е. понижает свою степень окисления. При этом образуются гидриды щелочных и щелочноземельных металлов, которые имеют ионное строение. Реакция протекает при нагревании:
Следует отметить, что взаимодействие с активными металлами является единственным случаем, когда молекулярный водород Н2 является окислителем.
с неметаллами
Из неметаллов водород реагирует только c углеродом, азотом, кислородом, серой, селеном и галогенами!
Под углеродом следует понимать графит или аморфный углерод, поскольку алмаз — крайне инертная аллотропная модификация углерода.
При взаимодействии с неметаллами водород может выполнять только функцию восстановителя, то есть только повышать свою степень окисления:
Взаимодействие водорода со сложными веществами
с оксидами металлов
Водород не реагирует с оксидами металлов, находящихся в ряду активности металлов до алюминия (включительно), однако, способен восстанавливать многие оксиды металлов правее алюминия при нагревании:
c оксидами неметаллов
Из оксидов неметаллов водород реагирует при нагревании с оксидами азота, галогенов и углерода. Из всех взаимодействий водорода с оксидами неметаллов особенно следует отметить его реакцию с угарным газом CO.
Смесь CO и H2 даже имеет свое собственное название – «синтез-газ», поскольку из нее в зависимости от условий могут быть получены такие востребованные продукты промышленности как метанол, формальдегид и даже синтетические углеводороды:
c кислотами
С неорганическими кислотами водород не реагирует!
Из органических кислот водород реагирует только с непредельными, а также с кислотами, содержащими функциональные группы способные к восстановлению водородом, в частности альдегидные, кето- или нитрогруппы.
c солями
В случае водных растворов солей их взаимодействие с водородом не протекает. Однако при пропускании водорода над твердыми солями некоторых металлов средней и низкой активности возможно их частичное или полное восстановление, например:
Видео:Реакции замещения с галогенамиСкачать

Химические свойства галогенов
Галогенами называют химические элементы VIIA группы (F, Cl, Br, I, At), а также образуемые ими простые вещества. Здесь и далее по тексту, если не сказано иное, под галогенами будут пониматься именно простые вещества.
Все галогены имеют молекулярное строение, что обусловливает низкие температуры плавления и кипения данных веществ. Молекулы галогенов двухатомны, т.е. их формулу можно записать в общем виде как Hal2.
Галоген
Физические свойства
Следует отметить такое специфическое физическое свойство йода, как его способность к сублимации или, иначе говоря, возгонке. Возгонкой, называют явление, при котором вещество, находящееся в твердом состоянии, при нагревании не плавится, а, минуя жидкую фазу, сразу же переходит в газообразное состояние.
Электронное строение внешнего энергетического уровня атома любого галогена имеет вид ns 2 np 5 , где n – номер периода таблицы Менделеева, в котором расположен галоген. Как можно заметить, до восьмиэлектронной внешней оболочки атомам галогенов не хватает всего одного электрона. Из этого логично предположить преимущественно окисляющие свойства свободных галогенов, что подтверждается и на практике. Как известно, электроотрицательность неметаллов при движении вниз по подгруппе снижается, в связи с чем активность галогенов уменьшается в ряду:
Взаимодействие галогенов с простыми веществами
Все галогены являются высокоактивными веществами и реагируют с большинством простых веществ. Однако, следует отметить, что фтор из-за своей чрезвычайно высокой реакционной способности может реагировать даже с теми простыми веществами, с которыми не могут реагировать остальные галогены. К таким простым веществам относятся кислород, углерод (алмаз), азот, платина, золото и некоторые благородные газы (ксенон и криптон). Т.е. фактически, фтор не реагирует лишь с некоторыми благородными газами.
Остальные галогены, т.е. хлор, бром и йод, также являются активными веществами, однако менее активными, чем фтор. Они реагируют практически со всеми простыми веществами, кроме кислорода, азота, углерода в виде алмаза, платины, золота и благородных газов.
Взаимодействие галогенов с неметаллами
водородом
При взаимодействии всех галогенов с водородом образуются галогеноводороды с общей формулой HHal. При этом, реакция фтора с водородом начинается самопроизвольно даже в темноте и протекает со взрывом в соответствии с уравнением:
Реакция хлора с водородом может быть инициирована интенсивным ультрафиолетовым облучением или нагреванием. Также протекает со взрывом:
Бром и йод реагируют с водородом только при нагревании и при этом, реакция с йодом является обратимой:
фосфором
Взаимодействие фтора с фосфором приводит к окислению фосфора до высшей степени окисления (+5). При этом происходит образование пентафторида фосфора:
При взаимодействии хлора и брома с фосфором возможно получение галогенидов фосфора как в степени окисления + 3, так и в степени окисления +5, что зависит от пропорций реагирующих веществ:
При этом в случае белого фосфора в атмосфере фтора, хлора или жидком броме реакция начинается самопроизвольно.
Взаимодействие же фосфора с йодом может привести к образованию только триодида фосфора из-за существенно меньшей, чем у остальных галогенов окисляющей способности:
серой
Фтор окисляет серу до высшей степени окисления +6, образуя гексафторид серы:
Хлор и бром реагируют с серой, образуя соединения, содержащие серу в крайне не свойственных ей степенях окисления +1 и +2. Данные взаимодействия являются весьма специфичными, и для сдачи ЕГЭ по химии умение записывать уравнения этих взаимодействий не обязательно. Поэтому три нижеследующих уравнения даны скорее для ознакомления:
Взаимодействие галогенов с металлами
Как уже было сказано выше, фтор способен реагировать со всеми металлами, даже такими малоактивными как платина и золото:
Остальные галогены реагируют со всеми металлами кроме платины и золота:
Реакции галогенов со сложными веществами
Реакции замещения с галогенами
Более активные галогены, т.е. химические элементы которых расположены выше в таблице Менделеева, способны вытеснять менее активные галогены из образуемых ими галогеноводородных кислот и галогенидов металлов:
Аналогичным образом, бром вытесняет серу из растворов сульфидов и сероводорода:
Хлор является более сильным окислителем и окисляет сероводород в его водном растворе не до серы, а до серной кислоты:
Взаимодействие галогенов с водой
Вода горит во фторе синим пламенем в соответствии с уравнением реакции:
Бром и хлор реагируют с водой иначе, чем фтор. Если фтор выступал в роли окислителя, то хлор и бром диспропорционируют в воде, образуя смесь кислот. При этом реакции обратимы:
HCl + HClO» width=»225″ height=»28″/>
HBr + HBrO» width=»225″ height=»28″/>
Взаимодействие йода с водой протекает в настолько ничтожно малой степени, что им можно пренебречь и считать, что реакция не протекает вовсе.
Взаимодействие галогенов с растворами щелочей
Фтор при взаимодействии с водным раствором щелочи опять же выступает в роли окислителя:
Умение записывать данное уравнение не требуется для сдачи ЕГЭ. Достаточно знать факт о возможности такого взаимодействия и окислительной роли фтора в этой реакции.
В отличие от фтора, остальные галогены в растворах щелочей диспропорционируют, то есть одновременно и повышают и понижают свою степень окисления. При этом, в случае хлора и брома в зависимости от температуры возможно протекание по двум разным направлениям. В частности, на холоду реакции протекают следующим образом:
а при нагревании:
Йод реагирует с щелочами исключительно по второму варианту, т.е. с образованием йодата, т.к. гипоиодит не устойчив не только при нагревании, но также при обычной температуре и даже на холоду:
5NaI + NaIO3 + 3H2O» width=»341″ height=»62″/>
💥 Видео
Механизм реакций замещения | Химия ЕГЭ 10 класс | УмскулСкачать

9 класс. Галогены. Решение упражнений и задач.Скачать

Галогены. 9 класс.Скачать

Химические свойства алканов. 1 часть. 10 класс.Скачать

Габриелян О. С. 8 класс §32 "Реакции замещения".Скачать

Качественные реакции на хлорид-, бромид- и йодид-ионыСкачать

8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Реакции замещенияСкачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

9 класс. Галогены. Химические свойства.Скачать
ГАЛОГЕНЫ | Химия 9 классСкачать



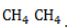 , радикал
, радикал 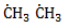 , который, в свою очередь, расщепляет другую молекулу хлора. Эти элементарные акты повторяются многократно, образуя новые радикалы и развивая цепную реакцию:
, который, в свою очередь, расщепляет другую молекулу хлора. Эти элементарные акты повторяются многократно, образуя новые радикалы и развивая цепную реакцию: