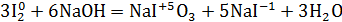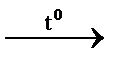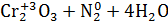Помещу в пробирку 1-2 кристалла йода I2, 3-5 капель концентрированного раствора щелочи NaOH и нагрею. Изменение цвета раствора: фиолетовый раствор → бордовый раствор.
1.Уравнение реакции, учитывая, что продуктом окисления йода в щелочной среде является йода натрия NaIO3.
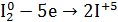
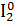
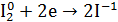
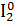
2.Общий вывод: Вещество содержит элемент в промежуточной степени окисления и
молекулы этого элемента реагируют друг с другом как окислитель и как восстановитель. Это вещество может участвовать в реакциях диспропорционирования.
Опыт 4. Внутримолекулярная реакция
1.В сухую пробирку помещу небольшое количество 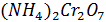

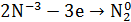
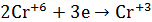
2.Вывод: эта реакция – реакция внутримолекулярная.
- Cоединения йода
- Йодоводород, йодоводородная кислота (HI)
- Иодноватистая кислота (HIO)
- Иодноватая кислота (HIO3)
- Иодная кислота (HIO4)
- Пентаоксид (пятиокись) иода, йодноватый ангидрид (I2O5)
- 2.3.1. Химические свойства водорода и галогенов.
- Химические свойства водорода
- Взаимодействие водорода с простыми веществами
- Взаимодействие водорода со сложными веществами
- Химические свойства галогенов
- Взаимодействие галогенов с простыми веществами
- Взаимодействие галогенов с неметаллами
- Взаимодействие галогенов с металлами
- Реакции галогенов со сложными веществами
- Реакции замещения с галогенами
- Взаимодействие галогенов с водой
- Взаимодействие галогенов с растворами щелочей
- 💥 Видео
Видео:Химическая реакция йода и алюминия.Скачать

Cоединения йода
Видео:Реакция Йода И Гидроксида Натрия. Реакция I2 и NaOH.Скачать

Йодоводород, йодоводородная кислота (HI)
Способы получения йодоводорода
В промышленности
- Взаимодействие йода с гидразином:
- Взаимодействие простых веществ происходит только при нагревании и протекает не до конца:
В лаборатории
- Вытеснение HI из йодидов ортофосфорной кислотой:
- гидролиз галогенидов неметаллов
- восстановление свободного йода:
Физические свойства йодоводорода
Водный раствор HI — иодоводородная кислота. Это бесцветная жидкость с резким запахом. Иодоводородная кислота является сильной кислотой.
В 100 г воды при обычном давлении и 20 °C растворяется 132 г HI, а при 100 °C — 177 г.
Химические свойства йодоводорода
Йодоводород – сильный восстановитель.
- Окисляется кислородом воздуха, приобретая бурый цвет:
- Взаимодействует с концентрированной серной кислотой с образованием сероводорода и свободного йода:
- Окисляется другими неметаллами:
- Окисляется даже слабыми окислителями:
- Присоединяется к кратным связям органических соединений (реакция электрофильного присоединения):
HI + CH3 – CH = CH2 → CH3 – CHI – CH3
- Образуют полииоды, присоединяя элементарный иод:
Кислородные кислоты и окислы иода
Видео:Реакция йода и щелочиСкачать

Иодноватистая кислота (HIO)
Иодноватистая кислота HIO — существует только в очень разбавленных растворах, окрашена в зеленоватый цвет. Очень неустойчива.
Получение йодноватистой кислоты
Образуется при взаимодействии иода с водой. Реакция обратима, а равновесие сильно сдвинуто в сторону исходных веществ:
Химические свойства йодноватистой кислоты
- Проявляет амфотерные свойства – слабая кислота и слабое основание. Диссоциирует и как кислота, и как основание:
- Разлагается при комнатной температуре с течением времени:
- Разлагается щелочами:
3HIO + 3NaOH = 2NaI + NaIO3 + 3H2O
Соли иодноватистой кислоты называют гипоиодитами.
Видео:Реакция йода с алюминием (огонь от капли воды)Скачать

Иодноватая кислота (HIO3)
Йодноватая кислота HIO3— белое кристаллическое вещество со стеклянным блеском и горьковато-кислым вкусом. При обычной температуре устойчива. Сильная одноосновная кислота, имеющая склонность к полимеризации в концентрированных растворах
Получение иодноватой кислоты
Получают в водных растворах при окислении иода хлором, пероксидом водорода либо дымящей азотной кислотой:
Химические свойства йодноватой кислоты
- хорошо растворима в воде:
- При медленном нагревании до 110ºС она частично плавится, частично образует ангидроиодноватую кислоту HI3O8.
При нагревании HIO3 выше 230°C образует порошок иодноватого ангидрида I2O5, при растворении в воде, которого вновь образуется иодноватая кислота:
- Нейтрализуется щелочами:
- Проявляет окислительные свойства:
- При электролизе йодноватой кислоты образуется йодная кислота:
Соли иодноватой кислоты — иодаты
- Они довольно устойчивы и разлагаются при температуре выше 400 °C.
- Обладают сильными окислительными свойствами в кислой среде:
- При электролизе раствора иодаты распадаются на водород и периодаты:
Видео:Опыты по химии. Взаимодействие (реакция) йода с алюминиемСкачать

Иодная кислота (HIO4)
Иодная кислота HIO4 — белое гигроскопичное кристаллическое вещество. В водном растворе Н5IO6 является слабой кислотой. В растворах образует гидраты состава mHIO4•nН2О, например, H3IO5, H4I2O9, H5IO6 и т. д Их устойчивость зависит от концентрации раствора. Проявляет сильные окислительные свойства
Получение йодной кислоты
- При воздействии хлорной кислоты на иод в присутствии катализатора:
- Электролизом раствора иодноватой кислоты:
Химические свойства йодной кислоты
- При растворении в воде образует гидраты:
- НIO4 разлагается при нагревании выше 122ºС:
- Щелочами нейтрализуется не полностью:
- Сильные окислительные свойства:
Cоли йодной кислоты — периодаты
Йодная кислота может образовать соли, содержащие ионы, IO6 5− , IO5 3− , IO4 — и I2O9 4− — соответственно орто-, мезо-, мета- и дипериодаты.
Получение периодатов
Периодаты можно получить при окислении иодатов сильными окислителями в щелочной среде:
Химические свойства периодатов
- Периодаты — сильные окислители, при нагревании выше 300ºС разлагаются с выделением кислорода:
- Разлагаются концентрированными кислотами:
- Разлагаются концентрированными щелочами:
- Проявляют окислительные свойства:
Оксиды йода
Видео:ПОЛУЧЕНИЕ ОГНЯ ИЗ ЙОДА И АЛЮМИНИЯСкачать

Пентаоксид (пятиокись) иода, йодноватый ангидрид (I2O5)
Иодноватый ангидрид I2O5 – белое, гигроскопичное вещество. На свету темнеет из-за частичного разложения.
Получение пентаоксида йода
Получают при медленном нагревании йодноватой или йодной кислоты
Химические свойства пентаоксида йода
- На свету разлагается:
- Как кислотный оксид реагирует с водой, со щелочами:
- Легко фторируется:
- Восстанавливается монооксидом углерода:
Видео:Получение Йодоформа. Реакция Ацетона, Йода и Гидрооксида Натрия. Реакция C3H6O, I2 и NaOH.Скачать

2.3.1. Химические свойства водорода и галогенов.
Видео:реакция крахмала с йодомСкачать

Химические свойства водорода
Атом водорода имеет электронную формулу внешнего (и единственного) электронного уровня 1s 1 . С одной стороны, по наличию одного электрона на внешнем электронном уровне атом водорода похож на атомы щелочных металлов. Однако, ему, так же как и галогенам не хватает до заполнения внешнего электронного уровня всего одного электрона, поскольку на первом электронном уровне может располагаться не более 2-х электронов. Выходит, что водород можно поместить одновременно как в первую, так и в предпоследнюю (седьмую) группу таблицы Менделеева, что иногда и делается в различных вариантах периодической системы:
С точки зрения свойств водорода как простого вещества, он, все-таки, имеет больше общего с галогенами. Водород, также как и галогены, является неметаллом и образует аналогично им двухатомные молекулы (H2).
В обычных условиях водород представляет собой газообразное, малоактивное вещество. Невысокая активность водорода объясняется высокой прочностью связи между атомами водорода в молекуле, для разрыва которой требуется либо сильное нагревание, либо применение катализаторов, либо и то и другое одновременно.
Взаимодействие водорода с простыми веществами
с металлами
Из металлов водород реагирует только с щелочными и щелочноземельными! К щелочным металлам относятся металлы главной подгруппы I-й группы (Li, Na, K, Rb, Cs, Fr), а к щелочно-земельным — металлы главной подгруппы II-й группы, кроме бериллия и магния (Ca, Sr, Ba, Ra)
При взаимодействии с активными металлами водород проявляет окислительные свойства, т.е. понижает свою степень окисления. При этом образуются гидриды щелочных и щелочноземельных металлов, которые имеют ионное строение. Реакция протекает при нагревании:
Следует отметить, что взаимодействие с активными металлами является единственным случаем, когда молекулярный водород Н2 является окислителем.
с неметаллами
Из неметаллов водород реагирует только c углеродом, азотом, кислородом, серой, селеном и галогенами!
Под углеродом следует понимать графит или аморфный углерод, поскольку алмаз — крайне инертная аллотропная модификация углерода.
При взаимодействии с неметаллами водород может выполнять только функцию восстановителя, то есть только повышать свою степень окисления:
Взаимодействие водорода со сложными веществами
с оксидами металлов
Водород не реагирует с оксидами металлов, находящихся в ряду активности металлов до алюминия (включительно), однако, способен восстанавливать многие оксиды металлов правее алюминия при нагревании:
c оксидами неметаллов
Из оксидов неметаллов водород реагирует при нагревании с оксидами азота, галогенов и углерода. Из всех взаимодействий водорода с оксидами неметаллов особенно следует отметить его реакцию с угарным газом CO.
Смесь CO и H2 даже имеет свое собственное название – «синтез-газ», поскольку из нее в зависимости от условий могут быть получены такие востребованные продукты промышленности как метанол, формальдегид и даже синтетические углеводороды:
c кислотами
С неорганическими кислотами водород не реагирует!
Из органических кислот водород реагирует только с непредельными, а также с кислотами, содержащими функциональные группы способные к восстановлению водородом, в частности альдегидные, кето- или нитрогруппы.
c солями
В случае водных растворов солей их взаимодействие с водородом не протекает. Однако при пропускании водорода над твердыми солями некоторых металлов средней и низкой активности возможно их частичное или полное восстановление, например:
Видео:Йодид Олова(4) - SnI4. Реакция Олова и Йода. Реакция Sn и I2.Скачать

Химические свойства галогенов
Галогенами называют химические элементы VIIA группы (F, Cl, Br, I, At), а также образуемые ими простые вещества. Здесь и далее по тексту, если не сказано иное, под галогенами будут пониматься именно простые вещества.
Все галогены имеют молекулярное строение, что обусловливает низкие температуры плавления и кипения данных веществ. Молекулы галогенов двухатомны, т.е. их формулу можно записать в общем виде как Hal2.
Галоген
Физические свойства
Следует отметить такое специфическое физическое свойство йода, как его способность к сублимации или, иначе говоря, возгонке. Возгонкой, называют явление, при котором вещество, находящееся в твердом состоянии, при нагревании не плавится, а, минуя жидкую фазу, сразу же переходит в газообразное состояние.
Электронное строение внешнего энергетического уровня атома любого галогена имеет вид ns 2 np 5 , где n – номер периода таблицы Менделеева, в котором расположен галоген. Как можно заметить, до восьмиэлектронной внешней оболочки атомам галогенов не хватает всего одного электрона. Из этого логично предположить преимущественно окисляющие свойства свободных галогенов, что подтверждается и на практике. Как известно, электроотрицательность неметаллов при движении вниз по подгруппе снижается, в связи с чем активность галогенов уменьшается в ряду:
Взаимодействие галогенов с простыми веществами
Все галогены являются высокоактивными веществами и реагируют с большинством простых веществ. Однако, следует отметить, что фтор из-за своей чрезвычайно высокой реакционной способности может реагировать даже с теми простыми веществами, с которыми не могут реагировать остальные галогены. К таким простым веществам относятся кислород, углерод (алмаз), азот, платина, золото и некоторые благородные газы (ксенон и криптон). Т.е. фактически, фтор не реагирует лишь с некоторыми благородными газами.
Остальные галогены, т.е. хлор, бром и йод, также являются активными веществами, однако менее активными, чем фтор. Они реагируют практически со всеми простыми веществами, кроме кислорода, азота, углерода в виде алмаза, платины, золота и благородных газов.
Взаимодействие галогенов с неметаллами
водородом
При взаимодействии всех галогенов с водородом образуются галогеноводороды с общей формулой HHal. При этом, реакция фтора с водородом начинается самопроизвольно даже в темноте и протекает со взрывом в соответствии с уравнением:
Реакция хлора с водородом может быть инициирована интенсивным ультрафиолетовым облучением или нагреванием. Также протекает со взрывом:
Бром и йод реагируют с водородом только при нагревании и при этом, реакция с йодом является обратимой:
фосфором
Взаимодействие фтора с фосфором приводит к окислению фосфора до высшей степени окисления (+5). При этом происходит образование пентафторида фосфора:
При взаимодействии хлора и брома с фосфором возможно получение галогенидов фосфора как в степени окисления + 3, так и в степени окисления +5, что зависит от пропорций реагирующих веществ:
При этом в случае белого фосфора в атмосфере фтора, хлора или жидком броме реакция начинается самопроизвольно.
Взаимодействие же фосфора с йодом может привести к образованию только триодида фосфора из-за существенно меньшей, чем у остальных галогенов окисляющей способности:
серой
Фтор окисляет серу до высшей степени окисления +6, образуя гексафторид серы:
Хлор и бром реагируют с серой, образуя соединения, содержащие серу в крайне не свойственных ей степенях окисления +1 и +2. Данные взаимодействия являются весьма специфичными, и для сдачи ЕГЭ по химии умение записывать уравнения этих взаимодействий не обязательно. Поэтому три нижеследующих уравнения даны скорее для ознакомления:
Взаимодействие галогенов с металлами
Как уже было сказано выше, фтор способен реагировать со всеми металлами, даже такими малоактивными как платина и золото:
Остальные галогены реагируют со всеми металлами кроме платины и золота:
Реакции галогенов со сложными веществами
Реакции замещения с галогенами
Более активные галогены, т.е. химические элементы которых расположены выше в таблице Менделеева, способны вытеснять менее активные галогены из образуемых ими галогеноводородных кислот и галогенидов металлов:
Аналогичным образом, бром вытесняет серу из растворов сульфидов и сероводорода:
Хлор является более сильным окислителем и окисляет сероводород в его водном растворе не до серы, а до серной кислоты:
Взаимодействие галогенов с водой
Вода горит во фторе синим пламенем в соответствии с уравнением реакции:
Бром и хлор реагируют с водой иначе, чем фтор. Если фтор выступал в роли окислителя, то хлор и бром диспропорционируют в воде, образуя смесь кислот. При этом реакции обратимы:
HCl + HClO» width=»225″ height=»28″/>
HBr + HBrO» width=»225″ height=»28″/>
Взаимодействие йода с водой протекает в настолько ничтожно малой степени, что им можно пренебречь и считать, что реакция не протекает вовсе.
Взаимодействие галогенов с растворами щелочей
Фтор при взаимодействии с водным раствором щелочи опять же выступает в роли окислителя:
Умение записывать данное уравнение не требуется для сдачи ЕГЭ. Достаточно знать факт о возможности такого взаимодействия и окислительной роли фтора в этой реакции.
В отличие от фтора, остальные галогены в растворах щелочей диспропорционируют, то есть одновременно и повышают и понижают свою степень окисления. При этом, в случае хлора и брома в зависимости от температуры возможно протекание по двум разным направлениям. В частности, на холоду реакции протекают следующим образом:
а при нагревании:
Йод реагирует с щелочами исключительно по второму варианту, т.е. с образованием йодата, т.к. гипоиодит не устойчив не только при нагревании, но также при обычной температуре и даже на холоду:
5NaI + NaIO3 + 3H2O» width=»341″ height=»62″/>
💥 Видео
ВСЕ РЕАКЦИИ С АЗОТОМ И ЕГО СОЕДИНЕНИЯМИ | ЕГЭ ХИМИЯ 2024| НООСкачать

Реакция йода на спиртСкачать

Йод взаимодействует с КИПЯЩЕЙ щелочью!!! Смотреть всем!Скачать

Качественная реакция на йодСкачать

Взаимодействие йода с алюминиемСкачать

Как галогены реагируют со щелочами? #егэ2023 #сотка #химияСкачать

Взаимодействие йода с алюминиемСкачать

Спиртовой раствор йода+щелочьСкачать

Реакция ЙОДА и АЛЮМИНИЯ!Скачать

Качественная реакция на йодСкачать

ФИОЛЕТОВЫЙ ДЫМ из ЙОДА.Реакция АЛЮМИНИЯ и ЙОДА.Reaction of aluminum and iodine.Скачать