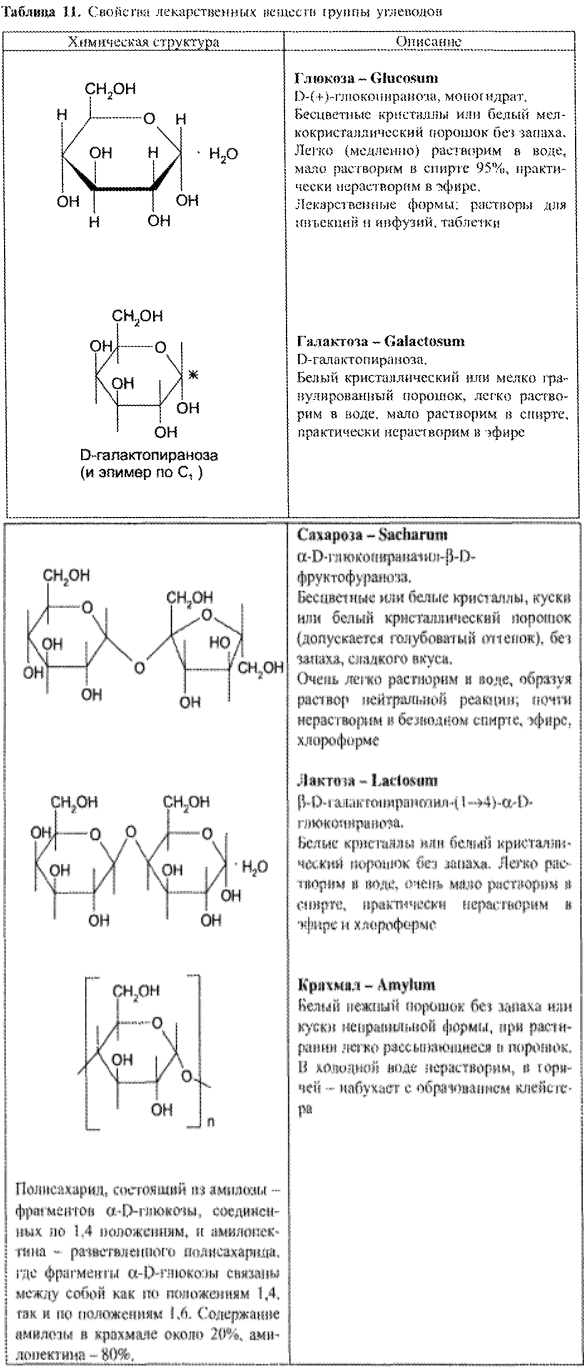
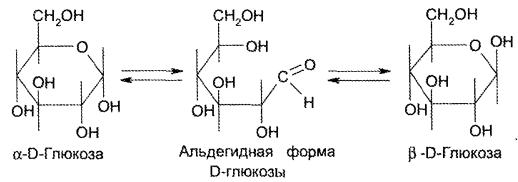
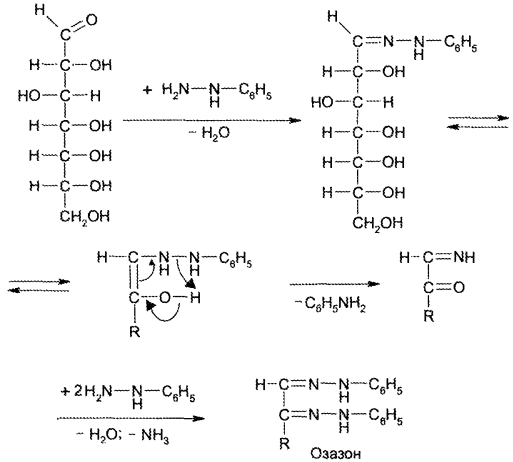
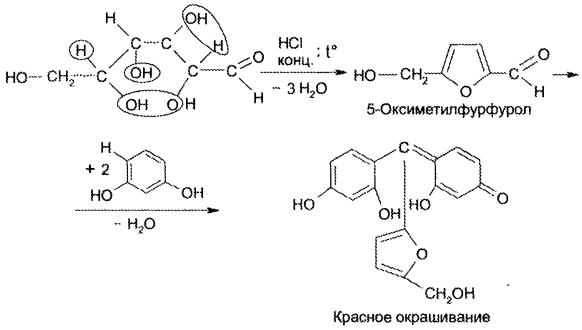
| Название | Лабораторная работа 1 окси, оксокислоты гидроксикарбоновые кислоты опы Свойства молочной кислоты |
| Анкор | Лабораторные органическая химия .doc |
| Дата | 22.04.2017 |
| Размер | 0.81 Mb. |
| Формат файла |  |
| Имя файла | Лабораторные органическая химия .doc |
| Тип | Лабораторная работа #5376 |
| страница | 3 из 3 |
| Подборка по базе: Лабораторная работа-раб с вирт машинами.docx, курсовая работа.docx, Конттрольная работа по дисциплине Документирование.docx, Практическая работа.docx, Проектная работа.docx, ПРАКТИЧЕСКАЯ РАБОТА №1 ЗаданиеИностранный язык. Английский. Част, иностранный язык письменная работа.docx, Курсовая работаЭкономика организации.docx, Практическая работа Русский язык.docx, Лабораторная работа №1.pdf Опыт 27. Реакции на гидроксильные группы дисахаридов 27.2. Ацилирование дисахаридов (тяга). В сухой пробирке смешивают 0,5 г безводной лактозы и 0,5 г безводного ацетата натрия. К полученной смеси приливают 2,5 мл уксусного ангидрида, содержимое пробирки перемешивают и нагревают 5 мин при непрерывном встряхивании. Реакционную смесь охлаждают на воздухе и выливают в стакан с водой и льдом при тщательном перемешивании: По какому механизму идет эта реакция? Опыт 28. Реакции дисахаридов по карбонильной группе. Сравнение свойств восстанавливающих и невосстанавливающих дисахаридов Схема реакции окисления мальтозы реактивом Фелинга: Положительную реакцию с фелинговой жидкостью дают восстанавливающие дисахариды (мальтоза и лактоза), в водных растворах которых вследствие таутомерных переходов имеются свободные альдегидные группы. Раствор, содержащий сахарозу, при нагревании до начинающегося кипения не изменяет своей окраски, так как сахароза относится к невосстанавливающим дисахаридам и не окисляется реактивом Фелинга. Следует помнить, что длительное кипячение раствора сахарозы в щелочной среде приводит к ее расщеплению, и продукты гидролиза могут восстанавливать реактив Фелинга до оксида меди (I). Напишите уравнение реакции окисления лактозы реактивом Фелинга. 28.2. Получение фенилозазонов мальтозы и лактозы. В две сухие пробирки помещают по 100 мг (на кончике шпателя) смеси солянокислого фенилгидразина и безводного ацетата натрия (1:3). Затем в одну пробирку добавляют 1 мл 1%-ного раствора мальтозы, а в другую — 1 мл 1%-ного раствора лактозы при тщательном перемешивании. Пробирки помещают на кипящую водяную баню на 15—20 мин. При охлаждении на воздухе, а потом в стакане со льдом в реакционной смеси выпадают кристаллы фенилозазонов мальтозы и лактозы.
Напишите уравнение реакции образования фенилозазона лактозы. Кристаллы фенилозазонов мальтозы и лактозы рассматривают под микроскопом. Кристаллы озазона мальтозы имеют форму игл, частично образующих сферические скопления, а кристаллы фенилозазона лактозы — форму пластинок, образующих розетки. Зарисуйте кристаллы фенилозазонов мальтозы и лактозы в рабочий журнал. Опыт 29. Гидролиз (инверсия) сахарозы Для доказательства гидролитического расщепления сахарозы необходимо провести реакции, подтверждающие наличие в содержимом пробирки продуктов гидролиза. Для этого содержимое пробирки делят на две части. Первую часть раствора нейтрализуют 10%-ным раствором гидроксида натрия (контроль по универсальной индикаторной бумаге), а затем добавляют равный объем реактива Фелинга и нагревают верхнюю часть жидкости. Наблюдают образование красного осадка оксида меди (I). Для сравнения нагревают смесь исходного раствора сахарозы с равным объемом реактива Фелинга. Окраска раствора не изменяется. Этот опыт показывает, что в результате гидролиза сахарозы, не способной восстанавливать реактив Фелинга, образуется смесь моносахаридов, окисляющихся фелинговой жидкостью. Со второй частью гидролизата проводят реакцию Селиванова на наличие фруктозы, входящей в состав сахарозы (см. опыт 26.1). Опыт 30. Реакция сахарозы с сульфатами кобальта и никеля 3.3. ВЫСШИЕ ПОЛИСАХАРИДЫ В две пробирки наливают по 1 мл 1%-ных растворов полисаха-Ридов: в первую — крахмала, во вторую — гликогена. Затем добавляют равный объем реактива Фелинга. Жидкости тщательно перемешивают и нагревают верхнюю часть растворов до начинающегося кипения. Цвет растворов не изменяется. Молекулы полисахаридов содержат в своем составе большое число соединенных друг с другом при помощи гликозидных связей остатков моносахаридов. Молекулы крахмала (амилоза и амилопектин) содержат в среднем от 1000 до 300000 остатков D-глюкозы, в гликогене число остатков D-глюкозы доходит до нескольких миллионов. Однако в макромолекулах амилозы и амилопектина содержится всего по одному свободному гликозидному гидроксилу, который в растворе может дать альдегидную группу, поэтому концентрация альдегидных групп в растворе настолько мала, что крахмал не восстанавливает реактив Фелинга. В молекулах гликогена общее число глюкозных остатков выше, чем в молекулах амилопектина, поэтому он, как и крахмал, не обладает восстанавливающими свойствами. Опыт 32. Взаимодействие крахмала и гликогена с иодом Реакция крахмала и гликогена с иодом представляет собой сложный процесс. Синюю окраску с иодом дает амилоза — одна из фракций крахмала. Амилоза — полисахарид линейного строения, состоящий из остатков а, D-глюкопиранозы. Ее молекулы имеют структуру спирали, внутри которой есть свободный канал диаметром около 5 мкм, в него внедряются молекулы иода, образуя окрашенные комплексы («соединения включения») за счет взаимодействия с гидроксильными группами моносахаридных остатков. При нагревании молекулы амилозы теряют свою спиралевидную структуру, и окрашенные комплексы разрушаются, при охлаждении спиралевидная структура амилозы и, следовательно, окрашенные комплексы восстанавливаются. Для полисахаридов с разветвленными цепями (амилопектин и гликоген) наряду с процессами образования комплексов большое значение имеет процесс адсорбции иода на поверхности боковых цепей. Если боковые цепи в молекуле гликогена короткие, то развивается бурая окраска, если они длинные, то темно-красная. Опыт 33. Гидролиз крахмала Реактивы и оборудование: 1%-ный раствор крахмала, 10%-ный раствор серной кислоты, разбавленный раствор иода в иодиде калия (раствор Люголя), 10%-ный раствор гидроксида натрия, реактив Фелинга, универсальная индикаторная бумага; конические колбы на 100 мл, пипетки, мерные цилиндры на 50 и 10 мл, пробирки. Схема гидролиза крахмала: После того как реакционная смесь перестанет давать окраску с иодом, ее кипятят еще несколько минут, охлаждают и нейтрализуют 10%-ным раствором гидроксида натрия (контроль по универсальной индикаторной бумаге). Отливают в пробирку 1—2 мл гидролизата и добавляют равный объем реактива Фелинга. Верхнюю часть жидкости нагревают на пламени горелки до начинающегося кипения. Выпадает красный осадок оксида меди (I), что свидетельствует о наличии в растворе продуктов глубокого гидролиза крахмала — глюкозы и мальтозы. Напишите уравнения реакций окисления продуктов гидролиза крахмала фелинговой жидкостью. Опыт 34. Кислотный гидролиз клетчатки Реактивы и оборудование: концентрированная серная кислота, 10%-ный раствор гидроксида натрия, реактив Фелинга, универсальная индикаторная бумага; мелко нарезанная фильтровальная бумага, стеклянные палочки, водяные бани, пробирки. В сухую пробирку помещают несколько мелко нарезанных кусочков фильтровальной бумаги и приливают 1 мл концентрированной серной кислоты. Содержимое пробирки тщательно перемешивают стеклянной палочкой до полного разрушения бумаги и образования бесцветного вязкого раствора. После этого к нему осторожно при перемешивании по каплям добавляют 1 мл дистиллированной воды. Пробирку ставят на кипящую водяную баню. Смесь нагревают 10—15 мин при регулярном перемешивании. После охлаждения жидкость нейтрализуют 10%-ным раствором гидроксида натрия (контроль по универсальной индикаторной бумаге) и проводят с ней реакцию с фелинговой жидкостью (см. опыт 55.3) для обнаружения в продуктах гидролиза восстанавливающих Сахаров. Напишите уравнение реакции гидролиза целлюлозы и объясните опыт. Лабораторная работа №4 Опыт 35. Получение фурфурола и его свойства Фурфурол образуется из пентозанов, которые вместе с клетчаткой входят в состав древесины: С полученным раствором фурфурола проводят некоторые реакции. 35.2. На полоску фильтровальной бумаги наносят каплю анилина. В это же место добавляют каплю уксусной кислоты, а затем раствора фурфурола. Появляется пятно, окрашенное в красный цвет. 35.3. В пробирку наливают 1 мл аммиачного раствора гидроксида серебра (см. опыт 22.1) и добавляют 1—2 капли раствора фурфурола. Раствор нагревают на горячей водяной бане. Выпадает черный осадок металлического серебра. Напишите уравнение реакции взаимодействия фурфурола с аммиачным раствором гидроксида серебра. Подберите коэффициенты методом электронного баланса. Полоску белой хлопчатобумажной ткани смачивают водой, отжимают, а затем опускают в раствор «белого» индиго. Через несколько минут ткань вынимают, отжимают от избытка раствора и оставляют развешенной на воздухе. Постепенно «белое» индиго окисляется кислородом воздуха, и ткань окрашивается в синий цвет: К капле пиридина осторожно прибавляют концентрированную соляную кислоту. Реакционная смесь сильно разогревается, и выпадает белый осадок. К полученному осадку приливают воду. Наблюдают его растворение. Напишите уравнение реакции пиридина с соляной кислотой. 37.2. Образование солей пиридина. В две пробирки наливают по 1мл 2%-ных растворов хлорида железа (III) и сульфата меди и добавляют по 1—2 капли раствора пиридина, полученного в предыдущем опыте. В пробирке с хлоридом железа (III) выпадает осадок бурого цвета: В пробирке с сульфатом меди сначала выпадает голубой осадок В избытке пиридина осадок гидроксида меди (II) быстро ра- Опыт 38. Мочевая кислота Несколько кристаллов мочевой кислоты растворяют в 1—2 мл соляную кислоту. Сначала выпадают кристаллы малорастворимой Кристаллы мочевой кислоты имеют форму удлиненных призм. Во вторую пробирку добавляют равный объем фелинговой Видео:Кислотный гидролиз сахарозыСкачать  Углеводы. Фармацевтический анализ углеводов» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»> УГЛЕВОДЫ Углеводы составляют обширную группу природных веществ, выполняющих в растительных и животных организмах разнообразные функции. Углеводы получают главным образом из растительных источников. Это связано с тем, что углеводы являются первичными продуктами фотосинтеза, осуществляемого растениями из оксида углерода и воды. Углеводы представляют своеобразный мост между неорганическими и органическими соединениями. Название – «углеводы» возникло потому, что многие представители этого класса имеют общую формулу Сn(Н2О)m, и формально могут быть отнесены к «гидратам углерода». Наиболее значимым ЛС данной группы является глюкоза. К группе углеводов относятся также сахароза, лактоза, галактоза и крахмал (табл. 11). Требования НД к качеству глюкозы как лекарственному средству соответствуют требованиям к химически чистым веществам. Характерными физическими свойствами глюкозы являются следующие: – определённая форма крупных или мелких кристаллов, оптическая активность с сильно выраженным вращением плоскости поляризации (удельное вращение 10% раствора глюкозы +52,3°), Тпл безводной глюкозы. Для глюкозы, которую получают в виде моногидрата, количество кристаллизационной воды является показателем качества ЛС. Содержание кристаллизационной воды должно составлять 10% от массы глюкозы моногидрата. Определение удельного вращения глюкозы имеет свои особенности. В свежеприготовленных растворах глюкозы происходит мутаротация (изменение во времени величины угла вращения; через определенный временной интервал эта величина становится постоянной). Мутаротацию можно ускорить путем прибавления к раствору глюкозы раствора аммиака (не более 0,1%). Если определять угол вращения глюкозы сразу после ее растворения и без прибавления к раствору аммиака, то этот показатель составит +109,16° и конечного значения +52,3° достигнет только через несколько часов. Явление мутаротации объясняется тем, что при растворении глюкозы, которая в кристаллическом состоянии находится в какой-либо одной циклической форме, образуется ее альдегидная форма, через которую получаются аномерные циклические формы глюкозы: α и β – формы, различающиеся расположением полуацетального гидроксила относительно 1-го углеродного атома. Для α -D-глюкозы величина угла вращения составляет +109,6°, а для β-D-глюкозы +20,5°. Конечное значение угла вращения соответствует состоянию равновесия между α- и β – формами, которые через альдегидную форму в растворе превращаются друг в друга: ХИМИЧЕСКИЕ СВОЙСТВА Глюкоза и галактоза относятся к моносахаридам, сахароза и лактоза — к олигосахаридам, крахмал — к полисахаридам. Моносахариды, являясь веществами с двойственными функциями, вступают во многие реакции, характерные для спиртов и карбонильных соединений (альдегидов). Олигосахариды и полисахариды подвергаются гидролизу (ферментативному или кислотному) с образованием соответствующих моносахаридов. Реакции на спиртовые гидроксилы Как многоатомные спирты глюкоза, галактоза, сахароза и лактоза (подобно этиленгликолю и глицерину) способны взаимодействовать с меди (II) гидроксидом с образованием комплексных соединений синего цвета (химизм – см. с. 100). Лекарственные вещества группы углеводов способны также к реакциям этерификации. Реакции на альдегидную группу Окисление, В зависимости от условий окисления моносахариды превращаются в различные продукты, В щелочной среде моносахариды окисляются под воздействием таких мягких окислителей, как реактивы Толленса и Фелинга (химизм – см. с, 107). С реактивом Толленса проходит реакция «серебряного зеркала», которая характерна для альдегидов. Следовательно, в эту реакцию моносахариды вступают в своей открытой (альдегидной) форме. С реактивом Фелинга моносахариды образуют Сu2О красно-оранжевого цвета. И в этом случае моносахарид реагирует в открытой форме за счет альдегидной труппы. Обе реакции используются для обнаружения моносахаридов (например, глюкозы) в биологических жидкостях (кровь, моча). Гликозиды и другие производные углеводов, не содержащие по- луацет:шьного гидроксила., не могут переходить в альдегидную форму и поэтому не обладают восстанавливающей способностью и не дают реакций с указанными реактивами. В нейтральной среде окислению подвергается только альдегидная группа. При этом образуются альдоновые кислоты, которые в кислой среде, отщепляя воду, превращаются в лактоны. Образование озазонов. При нагревании моносахаридов с фенил- гидразином сахара превращаются в кристаллические соединения, плохо растворимые в воде, — озазоны. На 1-й стадии образуется фенилгидразон, который перегруппировывается в ходе внутримолекулярной окислительно-восстановительной реакции в моноимин 1,2-дикарбонильного соединения. Из последнего образуется озазон: Озазоны — кристаллические вещества желтого цвета с четкой Тпл Реакция образования озазонов широко используется для установления подлинности сахаров, а также для выделения их из смесей. АНАЛИЗ ИНДИВИДУАЛЬНЫХ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ Глюкоза (декстроза) Подлинность. ФС в качестве испытания подлинности приводит реакцию окисления глюкозы реактивом Фелинга (химизм — см. с. 107). Известны и другие чувствительные и специфические реакции на глюкозу, не включенные в НД. Так, преобразование глюкозы в ме- тилфурфурол является чувствительной реакцией, которая основана на получении фурфурола из глюкозы при действии концентрированных серной или хлороводородной кислот с одновременным взаимодействием фурфурола с каким-либо фенолом (резорцином, тимолом, а-нафтолом) или ароматическим амином: С меди (II) сульфатом глюкоза при подщелачивании (без нагревания!) образует растворимый фиолетово-синий комплекс; при стоянии раствора происходит окислительно- восстановительная реакция с выделением Сu2О. Таким образом, одновременно доказывается наличие и альдегидной, и спиртовых функциональных групп. Регламентируется также определение удельного вращения. Измерение угла вращения проводят после прибавления к испытуемому раствору 2 капель раствора аммиака для предотвращения мутаротации. Чистота, Статья ГФ на глюкозу включает стандартные испытания: прозрачность и цветность раствора, кислотность, присутствие хлоридов, сульфатов, кальция, бария, декстрина, мышьяка. Растворы для инъекций дополнительно проверяют на пирогенность. Количественное определение. ГФ не регламентирует количественное определение субстанции. В препаратах глюкозы, в частности в растворах для инъекций, глюкозу определяют поляриметрически. Сахароза Сахароза является невосстанавливающим дисахаридом (олигосахаридом), так как образование гликозидной связи произошло за счет полуацетальных гидроксилов глюкозы и фруктозы. Поэтому сахароза не окисляется (в обычных условиях) реактивами Толленса и Фелинга. Сахароза — самый распространенный дисахарид, главный источник углеводов в пище человека. В фармации сахарозу применяют в виде сиропа — средство для улучшения вкуса. Подлинность. Как многоатомный спирт сахароза образует с раствором кобальта (И) нитрата в присутствии эквивалентного количества натрия гидроксида комплекс фиолетового цвета. Британская фармакопея (2001) регламентирует регистрацию ИК- спектра, а также ТСХ с использованием в качестве свидетелей стандартного образца сахарозы и других дисахаридов. Чистота. Определение проводят так же, как у глюкозы. Количественное определение не проводят. Лактоза Подлинность. У лактозы гликозидная связь образована между полуацетальным и спиртовым (С4) гидроксилами, поэтому подлинность лекарственного вещества доказывают прибавлением при нагревании реактива Фелинга. В результате выпадает кирпично-красный осадок меди (I) оксида (химизм — см. с. 107). Чистота, Определение проводят так же, как у глюкозы. Видео:Опыты по химии. Взаимодействие сахарозы с гидроксидом меди (II)Скачать  Конспект урока химии по теме: «Дисахариды и полисахариды»Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах. Открытый урок по химии в 10-м классе по теме «Дисахариды и полисахариды» Изучить важнейшие дисахариды и полисахариды: сахарозу, лактозу, крахмал и целлюлозу в сравнении их строения, свойств, применения и значения в природе. Задачи: образовательная: изучить структурные формулы и свойства представителей класса углеводов : ди-, и полисахаридов , изучить химико-технологические свойства, биологические функции, значение, применение. развивающая: формировать способность к самостоятельному приобретению знаний, развивать умения делать выводы на основе сравнения, работать с дополнительной литературой, реактивами, умение выступать перед аудиторией, развивать мышление через установление причинно-следственных связей «строение — свойства — применение» воспитательная: воспитывать коммуникабельность, бережное отношение к оборудованию, аккуратность при работе с реактивами, интерес к предмету. Тип урока: комбинированный с элементами лабораторной работы. Оборудование и реактивы: образцы крахмала, сахарозы, лактозы, целлюлозы; образцы тканей из ацетатного шелка; образцы продуктов, содержащих крахмал (картофель, рис, макароны, геркулес и белый хлеб); химические реактивы: аммиачный раствор оксида серебра, раствор Фелинга, йодная настойка, серная кислота (10%-й раствор), гидроксид натрия (10%-й раствор), резорцин, соляная кислота (конц). химические стаканы, пипетки, фарфоровые чашечки, мерные стаканы, пробирки; I. Организационный момент. II. Актуализация знаний. Постановка цели. “ Белки, жиры и углеводы, Учитель: Ребята, как вы думаете, что необходимо организму для нормального функционирования? Учитель: А как растения получают необходимую им энергию? Учитель: Мы с вами способны фотосинтезировать? Учитель: Тогда как же мы получаем энергию? Вывод: Питание – необходимое условие для нормального роста, развития и жизнедеятельности организма, значит, пища – это жизнь. Таким образом, значение пищи заключается в том, что она, во-первых, содержит органические вещества, а во-вторых, является источником энергии. Учитель: Вспомните из курса биологии, какие функции выполняют органические вещества? Ученик: Питательные вещества выполняют две основные функции: строительную и энергетическую. Учитель: Какие вещества являются главными поставщиками энергии организму человека? Учитель: Правильно, это и будет темой нашего сегодняшнего урока. Ученик (сообщение): Углеводы для человека являются основным источником энергии. Человек получает углеводы в основном из продуктов растительного происхождения (зерновые и бобовые культуры, картофель, фрукты и овощи). Считается, что на 60% потребности человека в энергии должны обеспечиваться углеводами. Ежедневно человеку необходимо до 440 граммов углеводов. Учитель: Ребята, давайте вспомним классификацию углеводов. На доске прикреплены основные классы углеводов. Ученикам показывается название углевода. Задание: Распределить примеры по классам. Учитель: Итак, сегодня наша задача изучить дисахариды и полисахариды. III. Изучение нового материла Учитель: Дисахариды – что означает два сахара. Это всем хорошо известная сахароза (тростниковый или свекловичный сахар) и лактоза (молочный сахар). Сам термин дисахарид красноречиво говорит о том, что в молекулах этих веществ между собой связаны два остатка моносахаридов. Так в сахаре – глюкоза и фруктоза, а в лактозе – глюкоза и галактоза. Учитель: Какими физическими свойствами обладает? Демонстрация сахара, опыты по растворению в теплой воде. Ученик: Сахар довольно сладкое вещество, содержится во фруктах, овощах, но больше в сахарной свёкле и тростнике – 20%, а так же в бахчевых – арбуз, дыня. Учитель: Сейчас сахар – постоянный спутник нашего стола, без которого гостей не накормишь, да и самим чашки чая не выпьешь. Было время, когда сахар считали дорогим лекарством и покупали в аптеках по той же цене, что и серебро. Ученик: В России сахар появился в 1273 году (первое упоминание о кристаллическом сахаре, ввозимом с заморскими товарами, относится ко времени правления великого князя Василия Ярославича), а в Европе – в 1747 году. Спрос на сахар сильно возрос с середины XVII века, когда в России начали употреблять чай, быстро ставший национальным напитком. В 1718 году указом Петра I купцу Верстову было поручено строительство первой в России “сахарной мануфактуры”. Учитель: В стакане у меня водный раствор сахарозы. Как мне доказать, что именно это вещество содержится? Учитель: Давайте опытным путем это докажем. На раствор сахарозы существует качественная реакция: взаимодействие с раствором кобальта Опыт: Качественная реакция на сахарозу. В пробирку берут 2–3 мл раствора сахара, приливают несколько капель водного раствора сульфата кобальта (CoSO4) и избыток щелочи. Появляется фиолетовое окрашивание. Учитель: Посмотрите на формулы сахарозы, из каких моносахаридов она состоит? Опыт: К раствору сахарозы прибавить аммиачный раствор серебра. Как вы думаете, для чего мы с вами это делаем? Учитель: Что происходит? Почему сахароза не дает реакцию «серебряного зеркала»? Опыт: В пробирку наливают 4–6 мл 1%-го раствора сахарозы, несколько капель (2 мл) разбавленной серной кислоты и кипятят. Учитель: Какие процессы происходят с сахарозой при нагревании её раствора с кислотой. Почему после нагревания проба с аммиачным раствором оксида серебра дает положительный результат. Напишите реакцию гидролиза сахарозы. сахароза фруктоза глюкоза Учитель: Таким образом, что мы с вами доказали? Учитель: Но в состав сахарозы входит и фруктоза, как же нам доказать, что она тоже входит в состав сахара? Опыт: В пробирку помещают 2–3 мл исследуемого раствора, 1 мл концентрированной соляной кислоты, прибавляют несколько кристаллов резорцина и нагревают. Появляется вишнево-красное окрашивание . Лактоза – единственный углевод животного происхождения, находится в молоке животных – 4% и, несмотря на это, молоко не отличается особой сладостью, так как она менее сладкая, чем глюкоза. (Демонстрация) Учитель: А чем полисахариды отличаются от дисахаридов? Какими физическими свойствами они обладают? Полисахариды — сложные углеводы, в воде не растворяются, сладкого вкуса не имеют. Образуются в результате реакции поликонденсации и состоят из большого числа моносахаридов. Молекулярная масса велика и составляет от нескольких тысяч до нескольких миллионов . Учитель: Какими свойствами обладает крахмал? Демонстрация физических свойств крахмала. Крахмал – белый порошок нерастворимый в холодной воде, а в горячей воде он набухает. Он совершено безвкусен. Крахмал уже усваивается не так быстро, как сахар. Чтобы облегчить его усвоение, содержащие крахмал продукты подвергают тепловой обработке, то есть картофель, рис варят, хлеб пекут. (Демонстрация продуктов). В этих условиях идет частичный гидролиз крахмала, то есть образуется полимер поменьше – декстрины, а в пищеварительном тракте образуется конечный продукт гидролиза глюкоза. Крахмал считают основным углеводом пищи. Ученик: В древности недобросовестные торговцы подмешивали в сметану муку, чтобы она становилась гуще. Обнаружить такой обман можно было очень легко. Для этого достаточно было капнуть маленькую капельку йода на сметану. И если продукт содержал крахмал, то йод приобретал синюю окраску. Учитель: Как называется такая реакция, которая позволяет распознавать вещества? (Качественная). Сейчас мы с вами проделаем небольшие опыты и постараемся обнаружить крахмал в различных продуктах питания, с которыми сталкиваемся каждый день. Перед вами картофель и белый хлеб. (Демонстрация качественной реакции) Целлюлоза – тоже растительный полисахарид, образованный глюкозой. Её еще называют клетчаткой. Она содержится в овощах, фруктах, злаках. Это волокнистое вещество нерастворимое в воде. У целлюлозы есть один недостаток – она непитательна. Конечно, мы её едим, потому что она содержится в растениях. Но она не переваривается желудочно-кишечным трактом. Так как нет ферментов, которые расщепляют её. А зачем тогда она нам нужна? Ученик: Оказывается она необходима! Одно из самых замечательных свойств пищевых волокон – их способность удерживать воду, например, сырые морковь, яблоко, капуста в желудке и кишечнике разбухают вдвое и создают иллюзию сытости. Еще один плюс пищевых волокон – они поглощают холестерин и желчные кислоты, что тормозит камнеобразование. Поэтому ешьте побольше капусты, моркови, свёклы постарайтесь есть яблоки, смородину, малину. Из крупяных – пшено, перловка, овес и из бобовых – горох, фасоль, а так же дары леса – грибы, орехи. (демонстрация продуктов) Мы уже достаточно много знаем о полисахаридах. Давайте попробуем сформулировать области применения этих веществ в нашей жизни. IV. Выводы. Подведение итогов урока Ребята, сегодня на уроке мы с вами изучили свойства основных представителей классов ди- и полисахариды. Опытным путем доказали из каких моносахаридов состоят, как при помощи качественных реакций различать основных представителей классов углеводы. V. Закрепление изученного материала. Тест из 5-ти вопросов: Домашнее задание и его инструктаж: Пользуясь учебником и опорным конспектом, подготовиться дать характеристику классу углеводов. Домашние опыты: 1) Попробуйте долго разжевывать кусочек белого хлеба. Вы заметите, что вкус его становится сладковатым. Это работает фермент амилаза, превращая в мальтозу крахмал, содержащийся в хлебе. 2) Поучимся правильно готовить крахмальный клейстер — коллоидный раствор крахмала в воде. Налейте в кастрюлю немного холодной воды и добавьте крахмал, из расчета примерно две чайные ложки на стакан. Смесь хорошо размешайте — получится так называемое крахмальное молоко. При перемешивании добавьте к нему кипяток и, продолжая размешивать, нагревайте на огне до тех пор, пока раствор не станет прозрачным. Остудите его. Это и есть крахмальный клейстер, который так хорошо склеивает бумагу; поэтому его часто применяют, например, для приклеивания обоев. 3) Вы, конечно, знаете, что в присутствии свободного йода крахмал синеет (заметьте только, что раствор йода должен быть очень слабым). Кстати, пользуясь таким раствором (а чтобы приготовить его, достаточно разбавить аптечный раствор водой), можно исследовать на содержание крахмала различные пищевые продукты. Проведите исследование. Результаты оформите в виде таблицы: продукт, наличие крахмала. 🔥 ВидеоОпыты по химии. Гидролиз сахарозыСкачать  Дегидратация сахарозыСкачать  ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать  Отсутствие восстанавливающей способности сахарозыСкачать  Аэробный и анаэробный гликолиз. Реакции катаболизма глюкозы. Расчет выхода АТФ в гликолизеСкачать  Химия 10 класс (Урок№10 - Углеводы. Глюкоза. Олигосахариды. Сахароза.)Скачать  Отсутствие восстановительных свойств у сахарозыСкачать  Отсутствие восстанавливающей способности сахарозыСкачать  ХИМИЯ С НУЛЯ — Как решать задачи по Химии на Массовую ДолюСкачать  Кислотный гидролиз сахарозыСкачать  Гидролиз сахарозыСкачать  Взаимодействие сахара с концентрированной серной кислотойСкачать  Химия 10 класс (Урок№11 - Полисахариды. Крахмал. Целлюлоза.)Скачать  Гидролиз сахарозы: олимпиадная задача от кандидата химических наук (Задачи на даче-6)Скачать  Химия. Углеводы. Сахароза.Скачать  Дисахариды. Сахароза. 11 класс.Скачать  Відсутність відновлювальних властивостей у сахарозиСкачать  Качественные реакции на глицерин, глюкозу и сахарозуСкачать  |