При выполнении различных заданий ЕГЭ по химии (например, задачи 34 или задания 32 «мысленный эксперимент») могут пригодиться знания о том, какие вещества при нагревании разлагаются и как они разлагаются.
Рассмотрим термическую устойчивость основных классов неорганических веществ. Я не указываю в условиях температуру протекания процессов, так как в ЕГЭ по химии такая информация, как правило, не встречается. Если возможны различные варианты разложения веществ, я привожу наиболее вероятные, на мой взгляд, реакции.
- Разложение оксидов
- Разложение гидроксидов
- Разложение кислот
- Разложение солей
- Разложение хлоридов
- Разложение нитратов
- Разложение карбонатов и гидрокарбонатов
- Разложение сульфатов
- Разложение фосфатов, гидрофосфатов и дигидрофосфатов
- Разложение сульфитов
- Разложение солей аммония
- Разложение перманганата калия
- Разложение хлората и перхлората калия
- Реакция разложения: примеры и уравнение
- Что за процесс называется химической реакцией
- Условия протекания химических реакций
- Какие виды химических реакций существуют
- Реакция разложения (расщепления): что это
- Уравнение реакции разложения
- Виды реакций разложения
- Расщепление Н2О
- Расщепление Н2О2
- Реакция термического разложения CaCO3
- Уроки по неорганической химии для подготовки к ЕГЭ
- Реакции разложения
- 1) термическое разложение нерастворимых оснований (а также LiOH и Ca(OH)2):
- 2) термическое разложение нерастворимых карбонатов:
- 3) термическое разложение гидрокарбонатов:
- 4) термическое разложение некоторых кислот:
- 5) термическое разложение нитратов:
- 6) термическое разложение солей аммония:
- 7) некоторые примеры термического разложения с изменением степени окисления (разложение нитратов также идет с изменением степени окисления):
- 8) термическое разложение солей кислот хлора:
- 9) термическое разложение гидроксокомплексов:
Видео:Реакции разложенияСкачать

Разложение оксидов
При нагревании разлагаются оксиды тяжелых металлов:
2HgO = 2Hg + O2
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Разложение гидроксидов
Как правило, при нагревании разлагаются нерастворимые гидроксиды. Исключением является гидроксид лития, он растворим, но при нагревании в твердом виде разлагается на оксид и воду:
2LiOH = Li2O + H2O
Гидроксиды других щелочных металлов при нагревании не разлагаются.
Гидроксиды серебра (I) и меди (I) неустойчивы:
2AgOH = Ag2O + H2O
2CuOH = Cu2O + H2O
Гидроксиды большинства металлов при нагревании разлагаются на оксид и воду.
В инертной атмосфере (в отсутствии кислорода воздуха) гидроксиды хрома (III) марганца (II) и железа (II) распадаются на оксид и воду:
Большинство остальных нерастворимых гидроксидов металлов также при нагревании разлагаются:
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Разложение кислот
При нагревании разлагаются нерастворимые кислоты.
Например , кремниевая кислота:
Некоторые кислоты неустойчивы и подвергаются разложению в момент образования. Большая часть молекул сернистой кислоты и угольной кислоты распадаются на оксид и воду в момент образования:
В ЕГЭ по химии лучше эти кислоты записывать в виде оксида и воды.
Например , при действии водного раствора углекислого газа на карбонат калия в качестве реагента мы указываем не угольную кислоту, а оксид углерода (IV) и воду, но подразумеваем угольную кислоту при этом:
Азотистая кислота на холоде или при комнатной температуре частично распадается уже в водном растворе, реакция протекает обратимо:
При нагревании выше 100 о С продукты распада несколько отличаются:
Азотная кислота под действием света или при нагревании частично обратимо разлагается:
Видео:Реакции разложения. Как понять?Скачать

Разложение солей
Видео:Химия 8 класс: Реакции разложенияСкачать

Разложение хлоридов
Хлориды щелочных, щелочноземельных металлов, магния, цинка, алюминия и хрома при нагревании не разлагаются.
Хлорид серебра (I) разлагается под действием света:
2AgCl → Ag + Cl2
Хлорид аммония при нагревании выше 340 о С разлагается:
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Разложение нитратов
Нитраты щелочных металлов при нагревании разлагаются до нитрита металла и кислорода.
Например , разложение нитрата калия:
Видеоопыт разложения нитрата калия можно посмотреть здесь.
Нитраты магния, стронция, кальция и бария разлагаются до нитрита и кислорода при нагревании до 500 о С:
При более сильном нагревании (выше 500 о С) нитраты магния, стронция, кальция и бария разлагаются до оксида металла, оксида азота (IV) и кислорода:
Нитраты металлов, расположенных в ряду напряжений после магния и до меди (включительно) + нитрат лития разлагаются при нагревании до оксида металла, диоксида азота и кислорода:
Нитраты серебра и ртути разлагаются при нагревании до металла, диоксида азота и кислорода:
Нитрат аммония разлагается при небольшом нагревании до 270 о С оксида азота (I) и воды:
При более высокой температуре образуются азот и кислород:
Видео:8 класс. Составление уравнений химических реакций.Скачать

Разложение карбонатов и гидрокарбонатов
Карбонаты натрия и калия плавятся при нагревании.
Карбонаты лития, щелочноземельных металлов и магния разлагаются на оксид металла и углекислый газ:
Карбонат аммония разлагается при 30 о С на гидрокарбонат аммония и аммиак:
Гидрокарбонат аммония при дальнейшем нагревании разлагается на аммиак, углекислый газ и воду:
Гидрокарбонаты натрия и калия при нагревании разлагаются на карбонаты, углекислый газ и воду:
Гидрокарбонат кальция при нагревании до 100 о С разлагается на карбонат, углекислый газ и воду:
При нагревании до 1200 о С образуются оксиды:
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Разложение сульфатов
Сульфаты щелочных металлов при нагревании не разлагаются.
Сульфаты алюминия, щелочноземельных металлов, меди, железа и магния разлагаются до оксида металла, диоксида серы и кислорода:
Сульфаты серебра и ртути разлагаются до металла, диоксида серы и кислорода:
Видео:Реакции замещенияСкачать

Разложение фосфатов, гидрофосфатов и дигидрофосфатов
Эти реакции, скорее всего, в ЕГЭ по химии не встретятся! Гидрофосфаты щелочных и щелочноземельных металлов разлагаются до пирофосфатов:
Ортофосфаты при нагревании не разлагаются (кроме фосфата аммония).
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Разложение сульфитов
Сульфиты щелочных металлов разлагаются до сульфидов и сульфатов:
Видео:Алкены. Реакции окисления | Органическая химия| ХИМИЯ ЕГЭ 2024Скачать

Разложение солей аммония
Некоторые соли аммония, не содержащие анионы кислот-сильных окислителей, обратимо разлагаются при нагревании без изменения степени окисления. Это хлорид, бромид, йодид, дигидрофосфат аммония:
Cоли аммония, образованные кислотами-окислителями, при нагревании также разлагаются. При этом протекает окислительно-восстановительная реакция. Это дихромат аммония, нитрат и нитрит аммония:
Видеоопыт разложения нитрита аммония можно посмотреть здесь.
Видео:Типы химических реакций. 1 часть. 8 класс.Скачать

Разложение перманганата калия
Видео:Уравнивание реакций горения углеводородовСкачать

Разложение хлората и перхлората калия
Хлорат калия при нагревании разлагается до перхлората и хлорида:
4KClO3 → 3KClO4 + KCl
При нагревании в присутствии катализатора (оксид марганца (IV)) образуется хлорид калия и кислород:
2KClO3 → 2KCl + 3O2
Перхлорат калия при нагревании разлагается до хлорида и кислорода:
Видео:Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Реакция разложения: примеры и уравнение
Часто от приличных на вид людей можно услышать о вреде для здоровья какого-то продукта или средства. Причем главным аргументом в пользу такого утверждения будет фраза: «Это химия!». Однако так говорить могут лишь те, кто в школе явно прогуливал уроки по данному предмету. Дело в том, что человеческий, да и любой биологический организм, сам по себе состоит из множества органических и неорганических веществ. При этом поддерживать его жизнеспособность помогают различные процессы, непрерывно происходящие внутри него. Одним из главных среди них — является химическая реакция разложения. Давайте узнаем больше о ней и особенностях ее протекания с органическими и неорганическими веществами.
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Что за процесс называется химической реакцией
Прежде всего, стоит узнать значение понятия «химическая реакция». Это словосочетание означает превращение одного и более исходных веществ (называются реагентами) в другие. В процессе подобной метаморфозы ядра атомов взаимодействующих соединений не поддаются изменениям, однако происходит перераспределение электронов. Таким образом, после превращения на выходе образуются новые атомные соединения.
Химические реакции имеют качественное отличие от физических и ядерных.
- В результате первых исходные реагенты никогда не меняют свой состав, хотя и способны образовывать смеси или переходить из одного агрегатного состояния в другое. В отличие от них, процессы химические сопровождаются образованием новых соединений, с совершенно иными свойствами.
- Результатом вторых является изменения изотопного состава и числа атомов. Таким образом, на выходе из одних элементов, образовываются другие. Однако для химических процессов, столь глубокие метаморфозы не характерны. Поскольку изменения, произошедшие из-за них, не влияют на внутреннюю структуру атомов.
Видео:Реакции разложения.ПримерыСкачать

Условия протекания химических реакций
Во многих случаях, для успешного протекания процессов такого рода, необходим просто физический контакт реагентов друг с другом или их смешивание. Но часто для начала химической реакции, ей необходимы катализаторы. В этой роли могут выступать как различные вещества, так и определенные внешние условия.
- Воздействие температуры. Для того чтобы запустить отдельные химические процессы, необходимо нагревать реагенты. К примеру, чтобы начать реакцию разложения карбоната кальция, это температуру этого соединений необходимо повысить до 900-1200 °C.
- Электромагнитные волны. Наиболее эффективно стимулирующей протекание любых процессов является воздействие на реагенты световыми волнами. Такие реакции носят название «фотохимические». Классическим примером такой реакции является фотосинтез.
- Ионизирующее излучение.
- Воздействие электрического тока.
- Разного рода механическое влияние на реагирующие вещества.
Видео:Реакции разложенияСкачать

Какие виды химических реакций существуют
Классификация подобных процессов в основном производится по шести признакам.
- По наличию границы разделения фаз: гомо-/гетерогенные реакции.
- По выделению/поглощению тепла: экзотермически и эндотермические процессы.
- По наличию/отсутствию катализаторов: каталитические и некаталитические реакции.
- По направлению протекания: обратимые и необратимые процессы. В зависимости от данной категории находится тип знака между левой и правой частями химического уравнения. При необратимых — это две стрелки направленные в противоположные стороны, при обратимых — только одна, направленная слева на право.
- По изменению степени окисления. По этому принципу выделяют окислительно-восстановительную реакцию.
- Разложение (расщепление), соединение, замещение и обмен – это виды химических процессов по типу метаморфоз реагентов.
Видео:Реакции разложенияСкачать

Реакция разложения (расщепления): что это
Под данным термином подразумевается процесс, в результате которого одно сложное вещество разделяется на два и более простых. В большинстве случаев катализатором для этого выступает высокая температура. По этой причине данный процесс еще называют реакцией термического разложения.
В качестве примера можно привести один из классических способов получения чистого кислорода (О2) в промышленности. Это происходит в следствии нагревании KMnO4 (более известен всем под бытовым названием «марганцовка»).
В результате расщепления образуется не только кислород, но и манганат калия (K2MnO4) , а также диоксид марганца (MnO2).
Видео:Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

Уравнение реакции разложения
Любое химическое уравнение состоит из двух частей: левой и правой. В первой из них записываются реагирующие соединения, а во второй – продукты реакции. Между ними обычно ставится направленная вправо стрелка. Иногда она бывает двухсторонней, если речь идет об обратимом процессе. В отдельных случаях ее допустимо заменить знаком равенства (=).
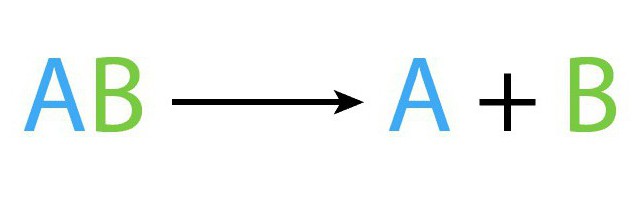
Рассматриваемый процесс, как и остальные виды химических процессов, имеет собственную формулу. Схематически уравнение реакции разложения выглядит таким образом: AB (t) → A+B.
Стоит помнить, что преимущественное большинство таких процессов происходит под воздействием тепла. Чтобы сообщить об этом, над стрелкой или рядом с ней часто ставится либо литера t, либо треугольник. Однако, иногда вместо тепла, в роли катализаторов выступают различные вещества, излучения.
В рассмотренной выше формуле AB — то исходное сложное соединения, A, B – это новые вещества, образованные в результате реакции разложения.
Примеры практические такого процесса встречаются очень часто. Можно проиллюстрировать данную формулу, с помощью уравнения процесса, описанного в предыдущем пункте: 2KMnO4 (t) → K2MnO4 + MnO2 + O2↑.
Видео:📒Реакции разложения. Химия 8 класс📒Скачать

Виды реакций разложения
В зависимости от типа катализатора (который способствует расщеплению сложного вещества на более простые) выделяют несколько видов разложения.
- Биодеградация – распад веществ вследствие деятельности живых организмов (микроорганизмы, грибы, водоросли). Более простым языком данный процесс можно назвать гниением. Именно из-за него портятся продукты. В одной стороны это препятствует их долгому хранению, с другой – помогает природе утилизировать все лишнее, восстанавливая таким образом экосистемы.
- Радиолиз – распад соединений при помощи воздействия на их молекулы ионизирующим излучением.
- Термолиз – повышение температуры для того, чтобы запустить реакцию разложения (примеры подобных процессов можно найти в пунктах 8-9).
- Сольволиз – обменное разложения между растворенным веществом и непосредственно самим растворителем. В зависимости от типа последнего, выделяются такие виды этого процесса: гидролиз (вода), алколиз (спирты), аммонолиз (амиак).
- Электролиз – разложение молекул с помощью воздействия на них электрического тока (пример в следующем пункте).
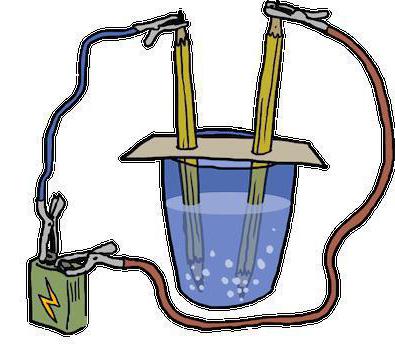
Расщепление Н2О
Разобравшись с теорией, касающейся реакции разложения, примеры практические ее проведения стоит рассмотреть. Поскольку Н2О сегодня является одним из наиболее доступных веществ для проведения химических опытов, стоит начать с нее.
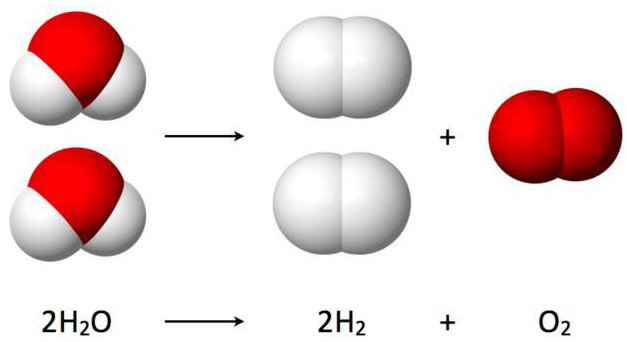
Данная реакция разложения воды именуется еще электролизом и выглядит таким образом: 2Н2О (электрический ток) → 2Н2↑ + О2↑.
Расшифровывается данное уравнение так: под воздействием на молекулы воды электрического тока, они расщепляют и образуют два газа – кислород и водород.Стоит отметить, что этот метод активно используется на подводных лодках для получения кислорода. В современном мире он заменил более дорогой способ получения этого жизненно важного вещества из пероксида натрия (Na2O2), с помощью его взаимодействия с углекислым газом: Na2O2 + CO2↑ → Na2CO3 + O2↑.
В перспективе реакция разложения воды может иметь огромное значение для будущего планеты. Поскольку таким образом можно добывать не только кислород, но и водород, использующийся как ракетное топливо. Разработки в этой области уже ведутся многие годы, однако основной проблемой является необходимость снизить количество энергозатрат на расщепление молекул воды.
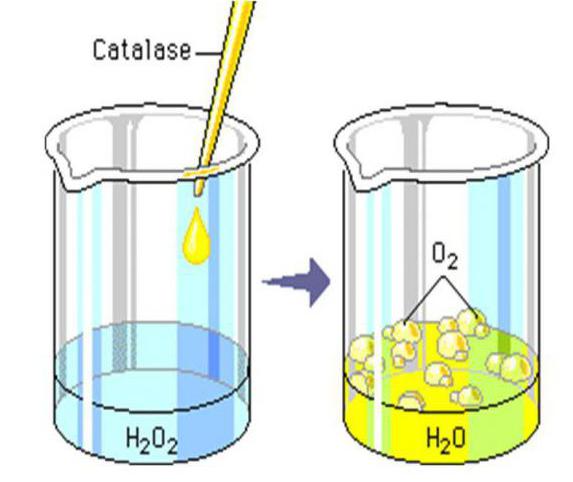
Расщепление Н2О2
Среди других примеров реакции разложения стоит обратить внимание на образование воды и кислорода из пероксида водорода (перекись).
Данный процесс также является термическим, поскольку для его начала, необходимо, чтобы исходное веществ было нагрето до температуры в 150 °C.
Именно по этой причине, перекись водорода (которую большинство использует для обработки ран) не превращается в воду, стоя в домашних аптечках.
Однако стоит помнить, что реакция разложения пероксида водорода может происходить и при обычной комнатной температуре, если вещество контактирует с такими соединениями, как каустическая сода (NaOH) или диоксид марганца (MnO2). Также в роли катализаторов могут выступать платина (Pt) и купрум (Cu).
Реакция термического разложения CaCO3
Еще одним интересным примером может служить расщепление карбоната кальция. Данный процесс можно записать с помощью такого уравнения: CaCO3 (t) → CaO + CO2↑.
Продуктом этой реакции буде негашеная известь (оксид кальция) и углекислый газ.
Представленный выше процесс активно используется в промышленности для получения углекислого газа. Подобные реакции производятся в специализированных шахтах, поскольку расщепление карбоната кальция происходит лишь при температуре от 900 °C.
Уроки по неорганической химии для подготовки к ЕГЭ
Свойства простых веществ:
Свойства сложных веществ:
Особенности протекания реакций:
Реакции разложения
1) термическое разложение нерастворимых оснований (а также LiOH и Ca(OH)2):
Ca(OH)2 → CaO + H2O
2LiOH → Li2O + H2O
Mg(OH)2 → MgO + H2O
Fe(OH)2 → FeO + H2O
Cu(OH)2 → CuO + H2O;
2) термическое разложение нерастворимых карбонатов:
CaCO3 → CaO + CO2
FeCO3 → FeO + CO2
MgCO3 → MgO + CO2;
3) термическое разложение гидрокарбонатов:
Ca(HCO3)2 → CaCO3 + CO2 + H2O
Mg(HCO3)2 → MgCO3 + CO2 + H2O
2NaHCO3 → Na2CO3 + CO2 + H2O;
4) термическое разложение некоторых кислот:
H2CO3 → CO2 + H2O
H2SO3 → SO2 + H2O
H2SiO3 → SiO2 + H2O
4HNO3 → 4NO2 + O2 + 2H2O
5) термическое разложение нитратов:
MNO3 → MNO2 + O2 M – металл, находящийся в ряду напряжений металлов левее Mg, исключая Li. MNO3 → MO + NO2 + O2 M – металл, находящийся в ряду напряжений металлов от Mg до Cu (Mg и Cu включительно), а также Li. MNO3 → M + NO2 + O2 M – металл, находящийся в ряду напряжений металлов правее Cu. 6) термическое разложение солей аммония:
NH4Cl → NH3 + HCl
(NH4)3PO4 → H3PO4 + 3NH3
(NH4)2CO3 → 2NH3 + CO2+ H2O
NH4HCO3 → NH3 + CO2+ H2O
Соли аммония азотной и азотистой кислот разлагаются с изменением степени окисления:
NH4NO3 → N2O + H2O
NH4NO2 → N2 + H2O7) некоторые примеры термического разложения с изменением степени окисления (разложение нитратов также идет с изменением степени окисления):
2H2O2 → 2H2O + O2
2KMnO4 → K2MnO4 + MnO2 + O2
8) термическое разложение солей кислот хлора:
2KClO3 → 2KCl + 3O2 (t, kt = MnO2)
9) термическое разложение гидроксокомплексов:
K2[Zn(OH)4] → K2ZnO2 + 2H2O (t)
Na[Al(OH)4] → NaAlO2 + 2H2O (t)
Этот вид расщепления имеет подвид – пиролиз. От обычного термолиза он отличается тем, что помимо воздействия высокой температуры на молекулы вещества, также их лишают возможности взаимодействовать с кислородом (О2).