- Ваш ответ
- решение вопроса
- Похожие вопросы
- Реакция протекает по уравнению А+В = 2С. Начальная концентрация вещества А равна 0,22 моль/л, а через 10 сек -0,215 моль/л. Вычислите среднюю скорость реакции
- Please wait.
- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- Урок №75. Скорость химической реакции. Закон действующих масс
- 🔍 Видео
Видео:Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 1ч. 10 класс.Скачать

Ваш ответ
Видео:Задачи на скорость реакции в зависимости от концентрации реагентовСкачать

решение вопроса
Видео:Влияние концентрации на скорость химических реакций. 10 класс.Скачать

Похожие вопросы
- Все категории
- экономические 43,421
- гуманитарные 33,634
- юридические 17,906
- школьный раздел 608,184
- разное 16,858
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Видео:123. Решение задач на нахождение скорости хим. реакции по известным концентрациям и времени.Скачать

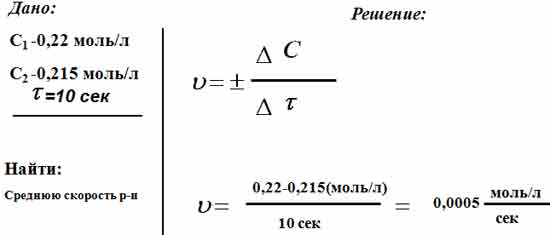
Реакция протекает по уравнению А+В = 2С. Начальная концентрация вещества А равна 0,22 моль/л, а через 10 сек -0,215 моль/л. Вычислите среднюю скорость реакции
Из курса химии вам встретится задание такого содержания:
Реакция протекает по уравнению А+В = 2С. Начальная концентрация вещества А равна 0,22 моль/л, а через 10 сек -0,215 моль/л. Вычислите среднюю скорость реакции
Так выглядит правильное решение этой задачи:
Нам дано уравнение, согласно которому протекает реакция: А+В = 2С. По условии задачи, в начале реакции концентрация вещества A была равна 0,22 моль/л, но уже через 10 секунд она стала составлять -0,215 моль/литр. Нужно узнать скорость реакции. Для этого узнаем разницу концентрации вещества в начале реакции и в конце, а дальше разделим на указанное нам время. В итоге получим, что средняя скорость реакции составляет 0,0005 моль/л/секунд. Это и будет являться правильным ответом на вопрос.
Видео:В реакции A(г) + 2В(г) → C(г) начальные концентрации веществ [A] = 0,2 mol/l, [В] = 0,2 mol/lСкачать
![В реакции A(г) + 2В(г) → C(г) начальные концентрации веществ [A] = 0,2 mol/l, [В] = 0,2 mol/l](https://i.ytimg.com/vi/BxaovBkDiBY/0.jpg)
Please wait.
Видео:N2 + 3H2 ↔ 2NH3. В данной реакции начальная концентрация исходных веществ равна 0,4M и 0,5М.Скачать

We are checking your browser. gomolog.ru
Видео:В реакции A(г) + хВ(г) → 2С(г) при повышении концентрации веществ А и В в 2 раза скорость реакцииСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:задачи по химии "Зависимость скорости химической реакции от концентрации реагирующих веществ"Скачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 706e605489da76ba • Your IP : 85.95.179.80 • Performance & security by Cloudflare
Видео:Скорость химических реакций. 9 класс.Скачать

Урок №75. Скорость химической реакции. Закон действующих масс
Образцы решений задач по теме «Скорость химической реакции»
Задача №1
Реакция протекает по уравнению А+В = 2С. Начальная концентрация вещества А равна 0,22 моль/л, а через 10 с — 0,215 моль/л. Вычислите среднюю скорость реакции.
Используем формулу для расчёта
υ = ± ΔС/Δτ = ± (0,215-0,22)/(10-0) = 0,0005 моль/л ∙ с
Задача №2
Вычислите, во сколько раз увеличится скорость реакции при повышении температуры от 30 до 70 ∘ С, если температурный коэффициент скорости равен 2.
По правилу Вант-Гоффа
υ=υ 0 ·γ (t2-t1)/10
По условию задачи требуется определить υ/υ 0 :
υ/υ 0 =2 (70-30)/10 = 2 4 = 16
Задача №3
Запишите кинетическое уравнение для следующих уравнений реакций:
А) S(тв) + O 2 (г) = SO 2 (г)
Б) 2SO 2 (г) + O 2 (г) = 2SO 3 (ж)
Согласно закону действующих масс, который действует для газов и жидкостей:
υ = к 2 C 2 (SO 2 )·C (O 2 )
Задача №4
Как изменится скорость реакции:
S (тв) + O 2 (г) = SO 2 (г)
при увеличении давления в системе в 4 раза?
Запишем кинетическое уравнение для реакции до повышения давления в системе. Обозначим концентрацию кислорода
С(О 2 ) = а, концентрация серы — твёрдого вещества не учитывается.
При повышении давления в 4 раза, объём уменьшается в 4 раза, следовательно концентрация газа кислорода увеличится в 4 раза и кинетическое уравнение примет вид:
Определяем, во сколько раз возрастёт скорость реакции:
υ ‘ /υ = к 1 4а / к 1 а = 4
Следовательно, при повышении давления в 4 раза, скорость данной реакции увеличится в 4 раза.
Задача №5
Как изменится скорость реакции:
2SО 2 (г) + O 2 (г) = 2SO 3 (г)
при увеличении давления в системе в 2 раза?
Запишем кинетическое уравнение для реакции до повышения давления в системе. Обозначим концентрацию SO 2
С(SО 2 ) = а, концентрация кислорода C(O 2 ) = b.
При повышении давления в 2 раза, объём уменьшается в 2 раза, следовательно концентрация газа кислорода и SO 2 увеличится в 2 раза и кинетическое уравнение примет вид:
υ ‘ = к 1 (2а) 2 ·2b = к 1 4а 2 ·2b= к 1 8а 2 ·b
Определяем, во сколько раз возрастёт скорость реакции:
υ ‘ /υ = к 1 8а 2 ·b / к 1 а 2 ·b =8
Следовательно, при повышении давления в 2 раза, скорость данной реакции увеличится в 8 раз.
Задача №6
При температуре 10 ºС реакция протекает за 5 мин, при 20ºС – за 1 мин. Рассчитайте температурный коэффициент скорости реакции.
1) При условии, что концентрация вещества (С), вступившего в реакцию, постоянна:
При температуре 10 ºС скорость реакции равна υ 0 =∆C/∆τ 0 ,
При температуре 30 ºС скорость реакции равна υ=∆C/∆τ,
υ=∆C/60, ∆C= 60υ. Следовательно, 300υ 0 =60υ, а υ/υ 0 =300/60=5.
2) По правилу Вант Гоффа: υ = υ 0 γ ∆t/10 , υ/υ 0 = γ ∆t/10
3) Согласно рассуждениям (1) и (2), получим γ (20-10)/10 = γ=5
🔍 Видео
Определение порядка реакции методом подбора кинетического уравненияСкачать

В обратимой реакции: X(g) ↔ Y(g) + Z(g) равновесная концентрация вещества X равна 4 mol/l.Скачать

Зависимость скорости реакции от концентрации реагентовСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Реакция на результаты ЕГЭ 2022 по русскому языкуСкачать

задачи на порядок хим реакцииСкачать

Решение задач по теме Скорость химической реакцииСкачать

Скорость реакции. Химия – ПростоСкачать

Физическая химия #3. Первый, второй и третий порядки химической реакции. Времена полупревращенияСкачать

Влияние температуры на скорость химических реакций. 10 класс.Скачать

81. Факторы, влияющие на скорость реакции (часть 2)Скачать